经导管二尖瓣缘对缘修复治疗梗阻性肥厚型心肌病PIMSRA失败1例
2023-11-15严慧翔林心平徐瑶李华俊李晶郁婷燕陈晓沛孟庆娜梁思颖蒲朝霞
严慧翔 林心平 徐瑶 李华俊 李晶 郁婷燕 陈晓沛 孟庆娜 梁思颖 蒲朝霞
1 临床资料
患者 女,58岁。因“胸闷、气促1年,加重2个月”于2022年8月17日入浙江大学医学院附属第二医院。患者1年前无明显诱因出现胸闷气促,休息可缓解,近2个月胸闷气促加重,休息时也无法缓解,偶感头晕,不伴心悸胸痛。遂于外院就诊,查超声心动图示:(1)符合梗阻性肥厚型心肌病(hypertrophic obstructive cardiomyopathy,HOCM)超声改变,左心室流出道(left ventricular outflow,LVOT)中度梗阻,二尖瓣中重度反流,主动脉瓣轻度反流;(2)左心室充盈异常。要求入我院,门诊拟“梗阻性肥厚型心肌病”收住入院。否认其他病史,否认中毒、输血史,自诉头孢类药物,复方氨基比林(安痛定)过敏。否认糖尿病史。否认家族其他成员肥厚型心肌病(hypertrophic cardiomyopathy,HCM)史。3大常规各项、心肌酶、凝血功能未见异常。心脏CT血管造影(computed tomography angiography,CTA)示:左主干及左前降支近段、左回旋支近段、右冠状动脉近段、右冠状动脉中段均混合斑块形成,最狭窄处轻度狭窄。纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅳ级。经胸超声心动图(transthoracic echocardiography,TTE)诊断为HOCM:增厚区位于室间隔基底段(前间隔最厚17.1 mm,后间隔最厚17.9 mm);静息状态(心率55次/分)LVOT峰值压差39 mmHg(1 mmHg=0.133 kPa);Valsalva动作下(心率53次/分)LVOT峰值压差73 mmHg;二尖瓣收缩期前向运动(systolic anterior motion,SAM)2级,二尖瓣反流(mitral regurgitation,MR)2+(图1A),反流颈宽0.66 cm,有效反流口面积0.21 cm²,反流容积39 ml;左心室射血分数(left ventricular ejection fraction,LVEF)65.3%;踏车运动负荷超声心动图LVOT峰值压差为101 mmHg(心率80次/分,图1B)。心肌声学造影(myocardial contrast echocardiography,MCE)示:室间隔基底段增厚,超声爆破后基底段心肌内对比剂迅速显影,且基底段心肌灌注明显强于不增厚的心肌(图1C)。心脏磁共振(cardiac magnetic resonance,CMR)示:左心室心肌不对称增厚,以基底段室间隔增厚为主(前间隔厚约11 mm,后间隔厚约18 mm,左心室游离壁厚约8 mm),左心室心内膜下心肌未见明显灌注延迟(图1D)。冠状动脉CT血管造影(coronary CT angiography,CCTA)示:左、右冠状动脉局限性钙化斑块,管腔轻度狭窄。药物治疗2个月(酒石酸美托洛尔47.5 mg、每天1次,沙库巴曲缬沙坦钠100 mg、每天1次)症状未见缓解。HCM团队评估后为患者选择行经皮心肌内室间隔射频消融治疗(percutaneous intramyocardial septal radiofrequency ablation,PIMSRA)。该手术经浙江大学医学院附属第二医院伦理委员会批准,手术按照《赫尔辛基宣言》的伦理标准进行。
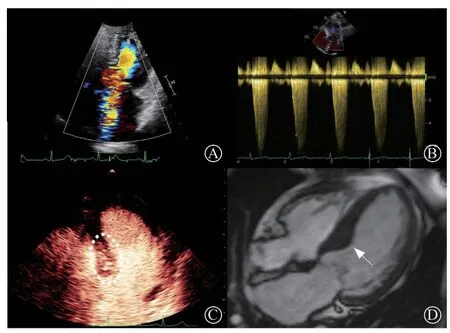
图1 PIMSRA 术前多模态影像学评估 A.SAM 引起的MR 2+;B.踏车运动负荷试验最大压差101 mmHg(出现在运动恢复期);C.MCE显示肥厚的心肌内灌注丰富(白色虚线区域);D.CMR 显示增厚的心肌区域(白色箭头所指),且强化均一Figure 1 Multimodal imaging evaluation before PIMSRA
患者在全身麻醉状态下,使用Liwen RFTM(杭州诺诚医疗器械有限公司)射频消融设备。TTE实时引导射频电极针(RFEF02A)经皮经心尖路径插入室间隔心尖段,沿室间隔逆行进针至针尖位于室间隔基底段中心(图2A),距离主动脉瓣10 mm,避免对房室结造成损伤。依次消融肥厚的前间隔基底段及后间隔基底段,消融的功率从低逐渐增加至最大功率40 W,累计持续时间为17 min,手术全程心电图监测,无束支传导阻滞或其他心电图异常,术后即刻超声造影观察消融区域心肌灌注缺损,黑洞面积6.72 cm2(图2B),且LVOT压差下降至小于30 mmHg,认为消融完成。

图2 PIMSRA 术中实时监测及评估 A.双平面显示穿刺针尖的位置(箭头所示);B.消融完成后即刻MCE 评估消融范围(黑洞面积6.72 cm2)Figure 2 Real-time monitoring and evaluation during PIMSRAe
术后1个月随访, 患者胸闷、气促未明显缓解,NYHA 心功能分级Ⅲ级。室间隔基底段最厚16 mm,静息状态(心率60次/分)LVOT峰值压差28 mmHg;Valsalva动作下(心率72次/分)LVOT峰值压差86 mmHg,MR 3+,有效反流口面积0.33 cm²,反流容积47 ml。SAM 3级,LVEF 71.2%。

术后7个月,患者胸闷、气促症状仍未缓解,NYHA心功能分级Ⅲ级。室间隔基底段心肌(后间隔)最厚15.2 mm,MCE显示室间隔内管状消融痕迹(考虑未完全封闭的消融针道),消融区域心肌部分瘢痕样强回声,周边可见部分对比剂延迟显影(较未消融区心肌灌注显影慢)(图3C)。静息状态(心率52次/分)LVOT峰值压差39 mmHg;Valsalva动作下(心率55次/分)LVOT峰值压差60 mmHg(图3A),MR 4+(图3B),有效反流口面积0.51 cm²,反流容积88 ml,SAM 3级。LVEF 68.2%。CMR心肌钆延迟增强显像显示室间隔基底段消融区斑片状混杂信号,中心液化坏死组织灌注缺损,边缘蛋壳样延迟强化(图3D)。

图3 PIMSRA 术后7 个月随访 A.valsalva 动作下LVOT 最大压差60 mmHg;B.MR 加重;C.MCE 显示心肌内消融痕迹(针道)及旁边的坏死区对比剂显影;D.CMR 显示消融区(箭头所示)斑片状混杂信号,局部心肌首过灌注缺损,消融心肌内局部可见延迟强化Figure 3 Follow up at 7 months after PIMSRA
经过HCM小组讨论,患者消融术后7个月心肌厚度仅变薄3 mm改善不理想,MCE与CMR均呈现消融区无灌注,证明心肌组织已坏死不适合再次PIMSRA。患者加重的MR机制主要是消融坏死心肌未完全吸收、心肌未明显变薄、SAM持续存在所致。经食管超声心动图精细评估二尖瓣解剖结构:瓣叶纤细,前叶(A2区)长24.9 mm,后叶(P2区)长16.9 mm,二尖瓣面积3.28 cm2,瓣口面积虽具有挑战性,但在患者强烈意愿下团队尝试采用经导管二尖瓣缘对缘修复(transcatheter edge-to-edge mitral valve repair,TEER)以改善临床症状。该手术经医院伦理委员会批准,使用DragonFly™ 经导管二尖瓣瓣膜夹系统在A2、P2区成功放置长窄夹子(XN0412)一枚,MR从4+降为1+,夹子两侧少量残余MR(1+,图4D),二尖瓣前向跨瓣平均压差4 mmHg(图4E)。术后静息状态LVOT(心率58次/分)峰值压差11 mmHg;Valsalva动作下LVOT(心率:65次/分)峰值压差25 mmHg(图4F),SAM消失。
TEER术后1个月随访,胸闷、气促消失,NYHA心功能分级Ⅱ级。静息状态LVOT(心率60次/分)峰值压差9 mmHg;Valsalva动作下LVOT(心率57次/分)峰值压差24 mmHg。二尖瓣前向跨瓣平均压差4 mmHg,夹子稳定,SAM消失,夹子两侧少量残余MR(1+)。LVEF 61.8%。
2 讨论
HCM是全球常见的遗传性心脏病,是青少年和运动员发生心原性猝死的常见原因,呈常染色体显性遗传,在性别分布上无显著差异。其定义是排除了其他心血管疾病或全身性、代谢性疾病所引起的心室壁增厚。中国的一项研究显示普通人群中超声心动图筛查HCM的患病率约为80/100 000[1],但中国的一个单中心研究显示近年来临床诊断HCM占心肌病患者的45%,并呈上升趋势[2]。基于基因检测的一项研究显示HCM基因携带的患病率估计为1/200或更大[3]。据报道70%的HCM患者存在静息性或诱发性的左心室流出道梗阻(left ventricular outflow obstruction,LVOTO)[4],大多数非药物治疗策略都是针对扩大LVOT和缓解LVOTO。
Liu等人开创的PIMSRA是一种治疗HOCM的中国原创·微创治疗方法,是在心脏非停跳状态下,超声实时引导射频针依次经皮肤、肋间、心尖精准穿刺送至室间隔心肌肥厚区域,利用射频电极针前端发出的可调控高频交变电流,使肥厚心肌组织局部升温、脱水,造成不可逆凝固性坏死;同时,消融室间隔穿支动脉,阻断肥厚室间隔的血供,等待消融区心肌组织吸收,使室间隔变薄,扩大LVOT内径,以达到缓解梗阻的效果。在大型动物实验和早期探索性临床试验中都证实是一种安全有效的治疗严重、有症状的HOCM的方法,可持续降低LVOT压差,消除因SAM引起的MR,并持续改善心功能,且没有发生重大术中并发症[5-9]。然而PIMSRA后消融区心肌组织吸收情况,LVOTO是否完全解除及后续治疗的病例未见报道。
HCM依据肥厚的不同区域分为乙状肥厚型(sigmoid)、中间肥厚型(reverse curve)和心尖肥厚型(apical),虽然PIMSRA可以通过调节消融针尖的位置和能量来改变消融区域,但是消融结束后的恢复阶段需要经历消融区组织的吸收以及针道的封闭。不同类型的HCM在PIMSRA后消融区域的吸收是否有差异尚未见报道。回顾分析本病例,乙状肥厚型,心肌最厚处17.9 mm。而在Liu等[7]报道的几个研究中室间隔厚度是21 mm(平均值)以及(23.56±4.55)mm[8]。在乙状肥厚型室间隔中很多厚度<20 mm且有LVOTO,虽然>30 mm并未列入PISMRA的禁忌证中,但是参考经皮腔内室间隔心肌消融术的禁忌证,过于肥厚的室间隔是否适合PISMRA同样值得思考。因此,关于PISMRA预后与HCM类型和室间隔厚度之间的相关性研究显得很有必要。
本病例的PISMRA均按标准程序操作,但不同于所报道的室间隔厚度明显减低[7-8],本病例7个月后消融区组织仍未完全吸收(从术前17.9 mm至15.2 mm),除去个体差异可能导致的不吸收、吸收慢之外,不能排除消融针道未完全封闭影响了消融区心肌组织的吸收。PIMSRA使用的消融针是17/18 G,对应直径为1.27/1.50 mm,沿针道心肌出血是术后心包积液的主要原因之一。在PIMSRA的标准流程中,并不需要在退消融针的同时消融针道,如果针道一直未封闭,似乎等同于给消融区域心肌重新开通一条冠状动脉间隔支。根据常识,在一定范围内心肌收缩越好,对针道的挤压越强,针道的封闭越快,而HCM心肌的舒缩性与心肌纤维化程度、厚度有关。因此,可以推测,PISMRA后消融区域的吸收及针道的封闭与心肌厚度有关,期待能有更多相关的临床研究以验证推测。
传统的室间隔减容术较难实现室间隔厚度的安全及充分减少,特别是对于轻度室间隔肥厚的HOCM患者[10-12]。与之相比,PIMSRA可在实时超声引导下实现心肌内精准移动、定位,以避开心内膜保护传导系统,还可在术中及时调整消融能量、范围及时长,避免过度消融引起的室间隔穿孔、恶性心律失常等严重并发症发生[13]。由于手术复杂性,各种潜在并发症也相继发生[14],一项研究认为,排除二尖瓣内源性病变的前提下,足够的室间隔减容足以缓解轻度室间隔肥厚的LVOTO和SAM,而无需额外的二尖瓣手术[15]。对于同时存在严重MR的HCM,TEER是一种新兴的介入方法,通过限制二尖瓣叶活动来降低LVOT峰值压差,减少MR。但到目前为止,TEER在HCM的治疗只有数个病例报道及小样本、中短期的临床研究[16-19]。经过心脏瓣膜团队的充分评估,本例患者二尖瓣前后瓣叶足够长,但瓣口面积仅3.25 cm2、狭窄风险高,具有挑战性,因此TEER术中选用一枚长窄夹子置入。TEER术后LVOT压差完全正常,MR减少至1+且二尖瓣无狭窄,表明治疗策略正确。虽然TEER对HOCM患者长期疗效尚不明确,但这次治疗解除了LVOTO,显著减轻了患者MR程度和临床症状, 说明TEER可以成为PIMSRA后组织未完全吸收致重度MR的有效解决方案之一。
现有报道的PIMSRA是一种安全的、有效减少LVOTO的方法,但局限于小样本的研究,如何更好地评估和提高这项技术的临床适用范围,以及手术后疗效不佳的后续治疗方式,需要更大规模的临床研究及潜在的技术升级。
利益冲突 所有作者均声明不存在利益冲突
