产地加工与炮制一体化工艺对玄参质量的影响
2023-11-14赵重博
邹 婷, 王 晶, 武 旭, 杨 凯, 党 明, 赵重博,3*
1.陕西中医药大学,咸阳 712046; 2.陕西省中药饮片工程技术研究中心,咸阳 712046; 3.陕西省中药炮制技术传承基地,咸阳 712046
玄参最早记载于《神农本草经》,被列为中品,为玄参科植物玄参ScrophularianingpoensisHemsl.的干燥根,具有清热凉血、滋阴降火、解毒散结之功,主要用于治疗热入营血、温毒发斑、热病伤阴、舌绛烦渴、津伤便秘、骨蒸劳嗽、目赤、咽痛、白喉、瘰疬和痈肿疮毒等症[1]。现代药理研究表明,玄参具有抗炎、镇痛、保肝、抗氧化、抗疲劳、保护心肌、抗血小板聚集等作用[2]。这与玄参所含的环烯醚萜类、苯丙素苷类、甾醇类、生物碱类、有机酸、多糖类等成分有关,其中哈巴苷、哈巴俄苷等环烯醚萜类成分是玄参质量控制的指标成分[3-5]。
玄参从新鲜药材到饮片需要经过产地加工、饮片炮制2个环节,其中产地加工由种植农户或合作社完成,即在冬季茎叶枯萎时采挖,除去根茎、幼芽、须根及泥沙,晒或烘至半干,堆放3~6 d,反复数次至干燥;饮片炮制则由生产企业将经产地加工的干燥玄参再洗净、润透、切薄片、干燥,或微泡、蒸透、稍晾、切薄片、干燥。上述过程存在以下问题:农户产地加工过程无明确的工艺参数标准,操作不规范;干燥过程易造成有效成分的损失,严重影响饮片的质量,二次浸润会导致有效成分的流失等。市场上流通的玄参饮片质量参差不齐,根据饮片的外形、色泽、断面等判定其质量的优劣,带有一定程度上的主观性,无法客观地评价饮片的质量、保证临床疗效与用药安全[6]。
为了提高玄参饮片的质量、减少生产过程中的重复环节、规范炮制加工工艺、减少有效成分的损失,同时也为了响应国家和省市对产地加工技术的积极探索的号召,有必要对玄参的产地加工与饮片炮制工艺进行整合研究,缩短其加工周期,规范加工过程。因此本实验以玄参为原料药材,对玄参产地加工与炮制生产一体化工艺进行研究,将一体化与传统工艺得到的玄参进行质量和药效评价,为玄参一体化生产实施的可行性提供科学依据。
1 仪器与材料
1.1 仪器
LC-2030 Plus型高效液相色谱仪(配置 LC-2030 UV 检测器,日本岛津公司);New Classic MS-S 型电子天平(上海梅特勒-托利多仪器有限公司);HH-2 型电热恒温水浴锅(北京科伟永兴仪器有限公司);L5 型紫外-可见分光光度计(上海仪电分析仪器有限公司);UPL-10L 型超纯水机(四川卓越水处理有限公司);BCD-269WDGG 型海尔冰箱(青岛海尔股份有限公司)。
1.2 试药
对照品:哈巴苷(批号PS011468,质量分数为98%)、哈巴俄苷(批号PS011486,质量分数为98%)、桃叶珊瑚苷(批号PS020259,质量分数为98%)、安格洛苷C(批号PS000098,质量分数为95%)、肉桂酸(批号PS000800,质量分数为98%)、毛蕊花糖苷(批号PS012711,质量分数为98%),均购自成都普思生物科技股份有限公司;甲醇、苯酚、浓硫酸均为分析纯,购自科密欧化学试剂有限公司;乙腈、甲醇均为色谱纯,购自科密欧化学试剂有限公司;磷酸、醋酸、二甲苯均为分析纯,购自国药集团化学试剂有限公司;阿司匹林(批号20190321,丹东医创药业有限公司)。新鲜玄参由柞水县世纪生态农业有限公司提供,经赵重博副教授鉴定为玄参科植物玄参ScrophularianingpoensisHemsl.的新鲜根。
1.3 实验动物
KM小鼠,体质量为18~22 g,购自西安交通大学医学部实验动物中心,生产许可证号为SCXK(陕)2020-001,动物实验伦理号为SUCMDL20220718002。
2 方法与结果
2.1 饮片的制备
传统玄参饮片:取新鲜玄参,除去须根及泥沙,堆积成堆,盖上麻袋“发汗”11 d,取出,置于烘箱(50 ℃)中充分干燥,即得。玄参洗净,润透,切制成2 mm厚的薄片,干燥,即得传统玄参饮片。
一体化玄参饮片:取新鲜玄参,除去须根及泥沙,堆积成堆,盖上麻袋“发汗”11 d,切制成2 mm厚的薄片,50 ℃充分干燥,即得一体化玄参饮片。
2.2 鉴别
2.2.1性状鉴别 对2种玄参饮片的外观进行观察。
传统玄参饮片:本品呈类圆形或椭圆形的薄片,外表皮呈灰褐色,切面呈黑色,微有光泽,有的具裂隙,气特异似焦糖,味甘,微苦。
一体化玄参饮片:本品呈椭圆形的薄片,外表皮呈灰褐色,切面呈黑色,微有光泽,有的具裂隙,气特异似焦糖,味甘,微苦。
2种玄参饮片的外观性状与2020年版《中华人民共和国药典》(以下简称《中国药典》)所记载的玄参饮片性状基本一致。一体化玄参饮片的颜色较传统玄参饮片更黑润,这可能是因为在一体化玄参饮片加工过程中环烯醚萜苷类化合物更易被氧化。见图1。

注:A.新鲜药材;B.发汗第11天;C.玄参切面;D.传统玄参饮片;E.一体化玄参饮片。
2.2.2薄层鉴别 对照品溶液的制备:精密称取适量哈巴俄苷对照品,置于量瓶中,加甲醇定容,摇匀,即得1.49 mg·mL-1的哈巴俄苷对照品溶液。
供试品溶液的制备:取玄参饮片粉末2 g(过3号筛),加甲醇25 mL,浸泡1 h,超声处理30 min,滤过,滤液蒸干,残渣加水25 mL使溶解,用水饱和的正丁醇振摇提取2 次,每次30 mL,合并正丁醇液,蒸干,残渣加甲醇5 mL使溶解,作为供试品溶液。
按照2020年版《中国药典》(通则0502)薄层色谱法实验,吸取上述3种溶液各4 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-水(12∶4∶1)的下层溶液为展开剂,置于用展开剂预饱和15 min的展开缸内,展开,取出,晾干,喷以50 g·L-1的香草醛硫酸溶液,热风吹至斑点显色淸晰。见图2。

注:1~3.传统玄参饮片;4.哈巴俄苷对照品;5~7.一体化玄参饮片。
由图2可见,传统玄参饮片和一体化玄参饮片与哈巴俄苷对照品在相同位置的色谱行为一致。
2.3 检查
2.3.1水分的测定 按照2020年版《中国药典》通则0832项下的第二法水分测定法(烘干法)实验,结果见表1。

表1 水分、浸出物、总灰分、酸不溶性灰分的测定结果 (n=3)
2.3.2浸出物的测定 按照2020年版《中国药典》通则2201项下的热浸法实验,结果见表1。
2.3.3总灰分的测定 按照2020年版《中国药典》通则2302项下的方法实验,结果见表1。
2.3.4酸不溶性灰分的测定 按照2020年版《中国药典》通则2302项下的方法实验,结果见表1。
2种玄参饮片的水分、浸出物、总灰分、酸不溶性灰分均符合2020年版《中国药典》的要求。
2.4 含量测定
2.4.1多糖含量的测定 对照品溶液的制备:精密称取105 ℃干燥至恒定质量的无水葡萄糖对照品,置于50 mL量瓶中,用蒸馏水定容,摇匀制备得0.408 mg·mL-1的葡萄糖对照品溶液。
供试品溶液的制备:精密称取2种玄参饮片各10 g(过3号筛),置于圆底烧瓶中,分别加入体积分数为95%的乙醇100 mL,于80 ℃回流2 h,重复提取2 次,药渣再加100 mL蒸馏水回流提取2 h,趁热抽滤,重复提取2次,合并滤液浓缩至一定体积,加无水乙醇至乙醇体积分数为80%,放置24 h,抽滤,依次用乙醇、丙酮、乙醚各10 mL洗涤沉淀,50 ℃干燥,称定质量,得玄参样品粗多糖。精密称取2种玄参饮片粗多糖各7 mg,加蒸馏水定容至50 mL量瓶中,即得供试品溶液,冷藏备用[7]。
线性关系的考察:分别精密吸取葡萄糖对照品溶液1、2、3、4、5、6 mL,分别置于50 mL量瓶中,用蒸馏水稀释至刻度并摇匀,配制成系列葡萄糖对照品溶液。准确吸取系列对照品溶液各2 mL,置于具塞试管中,分别移入1 mL 50 g·L-1的苯酚溶液,再迅速加入7 mL浓硫酸,摇匀,40 ℃水浴30 min,再放入冷水中冷却至室温。在486 nm处测定吸光度(A)值。以蒸馏水为空白对照,在486 nm处测定上述显色葡萄糖对照品溶液的A值,以葡萄糖溶液质量浓度为横坐标(x)、A值为纵坐标(y),绘制标准曲线并计算回归方程。结果y1=0.054 9x1+0.021 2,r=0.999 5,表明葡萄糖对照品溶液在1.632~9.792 μg·mL-1范围内线性关系良好。
重复性实验:精密称取传统玄参饮片粗多糖7 mg,5份,加蒸馏水溶解,定容于50 mL量瓶中,摇匀,按上述方法操作并测定其A值,计算得多糖含量的RSD值为1.94%,表明该方法的重复性良好。
精密度实验:精密吸取传统玄参饮片多糖供试液,按上述方法连续测定A值6次,计算其A值的RSD值为0.39%,表明仪器的精密度良好。
稳定性实验:精密吸取多糖对照品溶液,按上述方法分别在0、10、20、30、60、90、120 min测定A值,计算其A值的RSD值为1.16%,结果表明多糖对照品溶液在120 min内稳定性良好。
加样回收率实验:精密称取传统玄参饮片粗多糖3 mg,6份,置于50 mL量瓶中,分别精密加入葡萄糖对照品溶液适量,加蒸馏水溶解并定容,摇匀,按上述方法测定其A值,结果葡萄糖平均回收率为99.27%,RSD值为1.31%。
含量测定:精密称取2种玄参饮片粗多糖各7 mg,加蒸馏水溶解,定容于50 mL量瓶中,摇匀,按上述方法测定A值并计算多糖含量,结果见表2。

表2 多糖含量 (n=3)
2.4.2玄参饮片中6种成分含量的测定 色谱条件:色谱柱为 Ultimate XDB-C18柱(250 mm×4.6 mm,5 μm)。流动相为乙腈(A)-0.3 mL·L-1磷酸水溶液(B),梯度洗脱,0~10 min,10%~20% A;10~25 min,20%~30% A;25~35 min,30%~60% A;35~45 min,60%~80% A;45~55 min,80%~10% A。流速为0.4 mL·min-1;检测波长为210 nm;柱温为30 ℃;进样量为20 μL。色谱图见图3。

注:A.混合对照品;B.传统玄参饮片;C.一体化玄参饮片;1.桃叶珊瑚苷;2.哈巴苷;3.毛蕊花糖苷;4.安格洛苷C;5.哈巴俄苷;6.肉桂酸。
对照品溶液的制备:取哈巴苷、哈巴俄苷、桃叶珊瑚苷、安格洛苷C、毛蕊花糖苷、肉桂酸对照品适量,精密称定,加体积分数为30%的甲醇制成质量浓度分别为0.115 500、0.057 000、0.262 500、0.051 000、0.009 520、0.000 944 mg·mL-1的对照品溶液,即得。
供试品溶液的制备:取本品粉末(过3号筛)约0.5 g,精密称定,置于具塞锥形瓶中,精密加入体积分数为50%的甲醇50 mL,密塞,称定质量,浸泡1 h,超声处理(功率为500 W,频率为40 kHz)45 min,放冷,再称定质量,用体积分数为50%的甲醇补足减失的质量,摇匀,滤过,取续滤液,即得[8]。
线性关系的考察:精密称取上述混合对照品溶液,按照上述色谱条件进行测定,进样量为4、8、12、16、20、24 μL,以样品质量浓度(mg·mL-1)为横坐标(x)、以峰面积为纵坐标(y),分别绘制标准曲线。见表3。由表3可见,各成分在其线性范围内均呈现出良好的线性关系。

表3 各成分的回归方程、相关系数、线性范围
精密度实验:取对照品溶液,按上述色谱条件连续进样6次,记录色谱峰面积,哈巴苷、哈巴俄苷、桃叶珊瑚苷、安格洛苷C、毛蕊花糖苷、肉桂酸峰面积的RSD值分别为1.36%、0.76%、2.54%、2.44%、0.87%、1.87%。
重复性实验:精密称取传统玄参饮片6份,按上述方法制备供试品溶液,各取20 μL进样,测定其峰面积,哈巴苷、哈巴俄苷、桃叶珊瑚苷、安格洛苷C、毛蕊花糖苷、肉桂酸峰面积的RSD值分别为2.60%、2.73%、1.93%、2.68%、2.64%、2.87%。
稳定性实验:取供试品溶液,分别于配制后0、2、4、6、8、10、12 h进样20 μL,测定其峰面积,计算得哈巴苷、哈巴俄苷、桃叶珊瑚苷、安格洛苷C、毛蕊花糖苷、肉桂酸峰面积的RSD值分别为0.50%、0.47%、0.75%、0.67%、0.46%、1.17%。
加样回收率实验:取玄参样品约0.25 g,共6份,精密称定,分别加入一定量对照品,按上述制样方法制备供试品溶液,按上述色谱条件进样分析,计算回收率。哈巴苷、哈巴俄苷、桃叶珊瑚苷、安格洛苷C、毛蕊花糖苷、肉桂酸的平均回收率分别为98.54%、97.92%、100.34%、99.58%、98.88%、96.86%;RSD值分别为1.04%、1.96%、1.97%、1.19%、1.68%、1.59%。结果见表4。
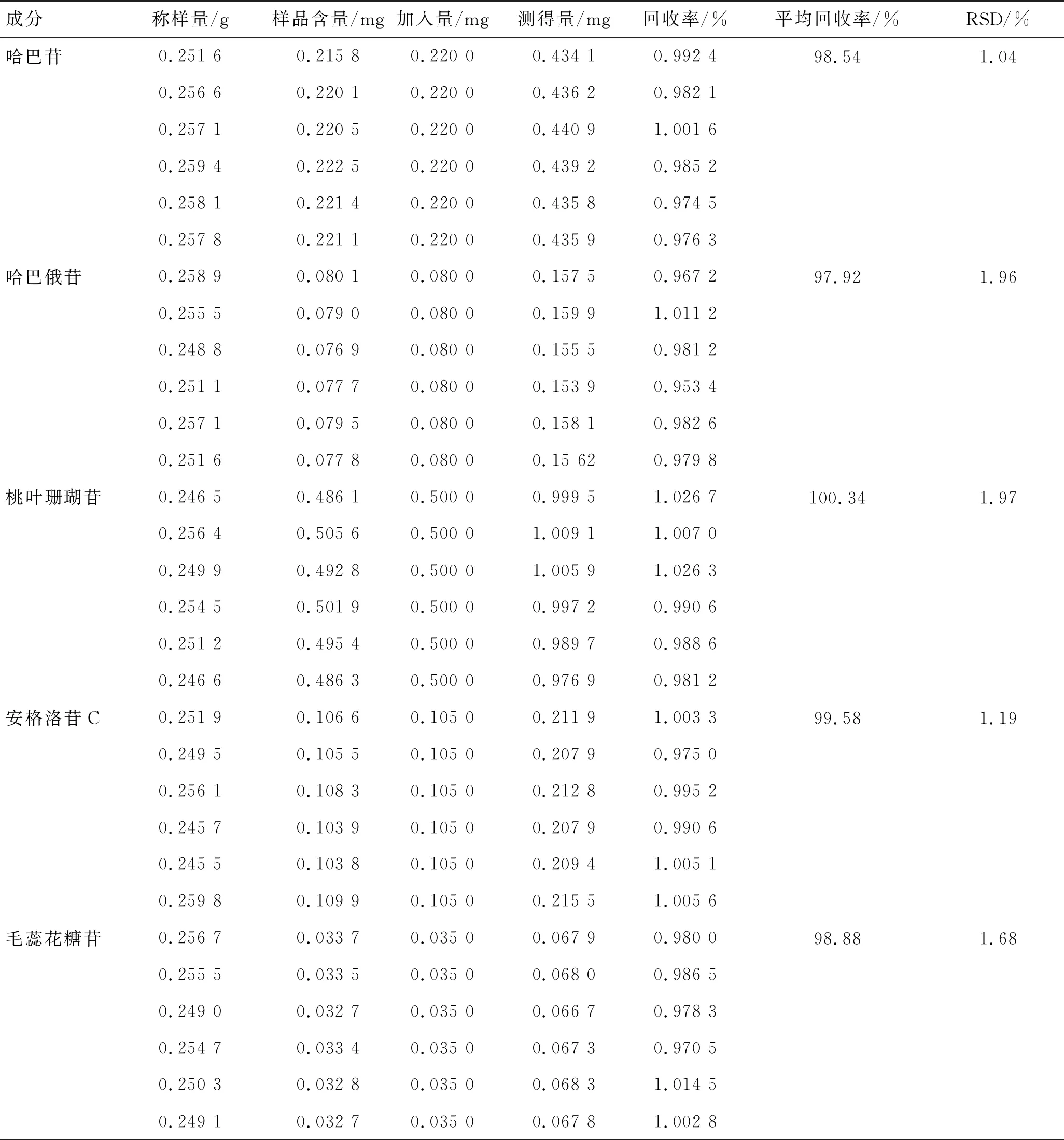
表4 加样回收率实验结果 (n=6)
含量测定:取2种玄参饮片约0.5 g,精密称定,按供试品溶液处理方法制备样品,分别吸取对照品和供试品溶液20 μL进样分析,用标准曲线法计算含量,见表5。
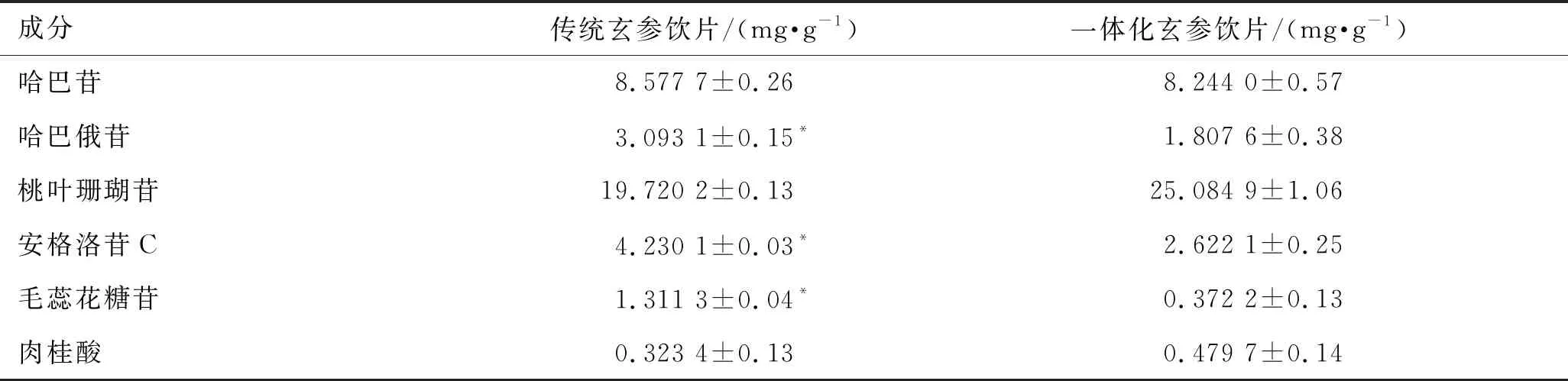
表5 各成分含量 (n=3)
用SPSS 26软件进行统计学分析,多样本之间的两两比较用单因素方差分析,P<0.05为差异具有统计学意义。与一体化玄参饮片比较,哈巴俄苷、安格洛苷C、毛蕊花糖苷升高,且差异有统计学意义,桃叶珊瑚苷、肉桂酸虽有降低,但差异无统计学意义。
2.5 抗炎镇痛实验
2.5.1玄参饮片水提取物的制备 取2种玄参饮片打粉(过3号筛),各称取150 g,依次加入10倍量、8倍量热水浸提,每次1.5 h,滤过后合并2次水提取液,按小鼠灌胃给药体积计算,减压浓缩至一定体积,得到质量浓度为1.25 g·mL-1的玄参提取液,储存,备用。
2.5.2镇痛药效的评价 取80只KM小鼠,适应性饲养7 d,依据《药理实验方法学》中的方法换算玄参给药剂量,把小鼠随机分成空白对照组(生理盐水,ig)、阳性对照组(阿司匹林,0.5 g·kg-1,ig),传统玄参饮片高剂量、中剂量、低剂量(3.64、1.82、0.91 g·kg-1,ig)组及一体化玄参饮片高剂量、中剂量、低剂量(3.64、1.82、0.91 g·kg-1,ig)组,每组10只,每日1次,连续7 d。末次给药1 h后,小鼠腹腔注射体积分数为0.6%的醋酸溶液0.2 mL·只-1,记录小鼠从给醋酸至出现扭体的时间(潜伏期)及给醋酸后15 min内的扭体次数(扭体现象表现为腹部凹陷、伸展后肢或臀部抬高),并计算痛阈抑制率,结果的统计处理用单因素方差分析[9]。
痛阈抑制率(%)=[(对照组扭体次数均值-给药组扭体次数均值)/对照组扭体次数均值]×100%。

表6 玄参样品对冰醋酸致小鼠扭体反应的影响
2.5.3抗炎药效评价 取80只KM小鼠,适应性饲养7 d,依据《药理实验方法学》换算玄参给药剂量,将小鼠随机分成空白对照组(生理盐水,ig)、阳性药组(阿司匹林,0.5 g·kg-1,ig)和传统玄参饮片高剂量、中剂量、低剂量组(3.64、1.82、0.91 g·kg-1,ig)及一体化玄参饮片高剂量、中剂量、低剂组(3.64、1.82、0.91 g·kg-1,ig),每组10只,每日1次。小鼠连续给药7 d,于末次给药后45 min,用0.03 mL二甲苯涂于小鼠右耳正反两面使其致炎,15 min后脱颈椎处死,剪下小鼠左、右耳,分别用直径6 mm的打孔器在左、右耳相同部位打孔,称定质量,计算差值作为肿胀度,计算肿胀抑制率,结果的统计处理用单因素方差分析[10]。
抑制率(%)=[(空白对照组平均耳肿胀度-给药组耳肿胀度)/空白对照组平均耳肿胀度]×100%。
表7 玄参样品对二甲苯致小鼠耳肿胀度的影响
3 讨论
近年来,中药材产地加工与饮片炮制工艺的一体化研究越来越受到学者们的关注,目前已有关于秦皮、黄精、知母、商陆、香薷等的一体化炮制研究[11-13],均验证了一体化炮制工艺的可行性,表明发展一体化炮制工艺已成为一种趋势。玄参作为常用的中药品种,现有研究主要集中在其炮制工艺、化学成分和药效学等方面[14-16],为从源头保证玄参饮片的质量,对其进行产地加工与饮片炮制工艺的一体化研究具有现实指导意义。
本实验以玄参的薄层鉴别、水分、灰分、水溶性浸出物及6种成分和总多糖的含量以及镇痛、抗炎作用评价一体化玄参饮片与传统玄参饮片的质量差异。其中性状鉴别、检查、浸出物和含量测定均符合2020年版《中国药典》规定玄参饮片的各项指标。一体化玄参饮片较传统玄参饮片少了水软化处理的过程,水溶性成分如多糖、桃叶珊瑚苷、肉桂酸含量较高。而哈巴苷、哈巴俄苷、毛蕊花糖苷等环烯醚萜苷受热易分解为葡萄糖和相应的苷元,相比传统玄参整体直接干燥,一体化玄参饮片是将新鲜玄参直接切制后干燥,增大了其与空气的接触面积,使得新鲜玄参的氧化程度增大,成分含量有所降低,这也是一体化玄参饮片色泽较传统玄参饮片乌黑的原因。玄参多糖、桃叶珊瑚苷和肉桂酸均有明显的抗炎和抗氧化作用[17-19],其含量增高,抗炎活性增强。哈巴苷、哈巴俄苷具有抗炎、抗血小板聚集和抗病毒的生物活性[20],安格洛苷C能够缓解由压力诱导的心室重构[21],而毛蕊花糖苷具有调节免疫、改善记忆等多种药理活性[22-27],药理实验结果,2种工艺处理的玄参饮片虽然在成分含量上有差异,但最终的药效指标均非常接近。
综上所述,产地加工炮制一体化玄参饮片在化学成分含量上虽与传统玄参饮片有差异,但其成分含量均远高于2020年版《中国药典》的要求,且与传统炮制玄参饮片在镇痛和抗炎作用相似。在加工周期上,一体化玄参饮片缩短约三分之一的加工时间,能减少中间储藏环节,避免由于储藏造成的中药材质量下降和损耗[28]。表明玄参的一体化生产具有一定的可行性。本实验为玄参产地加工炮制一体化技术的实施提供了科学依据,为玄参饮片生产模式的改进提供借鉴。
