各国药典中的过程分析技术相关通则概况
2023-11-14徐昕怡洪小栩
徐昕怡,洪小栩
国家药典委员会,北京 100061
过程分析技术(process analytical technology,PAT)是通过实时测量来设计、分析和控制生产的系统,它在工艺过程中能测量原辅料和中间物料的关键质量属性(critical quality attribute,CQA)及工艺的性能,确保终产品的质量[1]。通过PAT可实时控制产品质量,促进制造技术的持续改进和创新,从而实现先进过程控制和产品的实时放行(real time release testing,RTRT),最终实现连续制造[2-4]。PAT是实现质量源于设计(quality by design,QbD)理念的有效工具,越来越多的国际制药企业开始关注和使用PAT,发达国家和地区的药品监管机构也先后出台了相关标准和指导原则指导制药行业使用PAT[5-9]。2020年,欧洲药典(European Pharmacopoeia,EP)10.0版新增了PAT通则,美国药典(United States Pharmacopoeia,USP)、日本药典(Japanese Pharmacopoeia,JP)也在相关标准中提及了PAT的应用。目前,我国药品监管部门尚未发布有关PAT的法规和指导性文件,在对PAT的引领推动方面落后于发达国家。本文介绍了各国药典中有关PAT内容的收载情况,为《中华人民共和国药典》(以下简称《中国药典》)制定PAT相关标准提供参考。
1 PAT简介
PAT是制药领域的前沿技术,是实现制药行业数字化、信息化、智能化制造的基础。PAT工具主要包括4类:(1)用于设计、数据采集和过程分析的多变量分析工具;(2)现代过程分析仪器和过程分析化学工具;(3)过程控制工具;(4)持续的改进和知识管理工具[1]。PAT涉及广泛的技术范围,包括光谱学、成像、声学、统计分析和软件验证、现代微生物学方法、多变量数据分析等[10-15]。
PAT受到了美国食品药品监督管理局(food and drug administration,FDA)21世纪药品生产质量管理规范(good manufacturing practice of medical products,GMP)创新改革的动力支持,且在国际人用药品注册技术协调会(the international council for harmonisation of technical requirements for pharmaceuticals for human use,ICH)进程中得以持续发展[16-21]。见表1。2004年,FDA发布了《行业指南:PAT——用于规范创新药研发、生产及质量保证的框架》,鼓励将PAT引入到药品生产和质量控制中,加强对药品生产过程的控制和管理,提高生产制造的效率和有效性[1]。ICH Q6A质量标准——新原料药和制剂的检测和可接受标准指导原则允许利用如PAT等现代化的分析测试方法和控制策略制定放行标准和货架期标准[22]。

表1 ICH指导原则中对PAT的应用需求
尽管近年来部分企业已开展PAT的有效实践[23-29],但其应用仍面临资金、技术、设施设备、人才等多方面的限制[2, 30-32]。监管机构要平衡监管的可靠性和灵活性,重新对药品标准进行定义,明确工艺过程中测量和放行测试质量标准之间的相关性。工业界和监管机构对光谱技术及化学计量学模型的熟悉度与专业性及批准后变更的不确定性,也使PAT无法广泛实施。因此,各国药品监管部门和国际组织,如FDA、欧洲药品管理局(European Medicines Agency,EMA)、美国注射剂协会(Parenteral Drug Association,PDA)、ICH、美国材料与试验协会(American Society for Testing and Materials,ASTM)发布了一系列PAT指南性文件,阐述产品开发、技术转移、商业化生产等行为中应用PAT的重要性,为产品质量的一致性提供有效的解决方案[33-34]。各国药典也通过描述PAT的应用和益处,为工业界和监管机构提供技术支撑,共同促进PAT在技术、工艺和监管方面的进步,例如USP、EP、JP已在其关于合规性的凡例、分析检测技术和数据分析通则中考虑了PAT的应用,同时不断减少引入PAT的障碍。
2 各国药典中的PAT内容
2.1 EP中与PAT相关的通则
2.1.1EP PAT通则 EP允许并支持PAT的应用以促进如连续制造等创新方法的使用。PAT遵循了EP的凡例要求“在产品放行前进行药典规定的所有测试并不是制造商评估是否遵循药典的必要条件。一个物料可基于产品设计,结合其控制策略和从生产工艺验证研究中所生成的数据,证明其具备药典质量。可利用PAT和RTRT等增强的质量控制方法替代仅检测终产品的方法[35]。
2020年,EP收载了目前全球唯一的PAT药典通则,即编号为5.25的过程分析技术通则。5.25侧重于描述分析技术与生产过程的接口,作为加强对过程的理解和控制的一种手段。该通则主要包括六部分内容:目的、简介、分析技术与生产过程的对接方式(见图1)、不同对接方式的比较(见表2)、统计过程控制(statistical process control,SPC)和EP中支持PAT的其他通则。
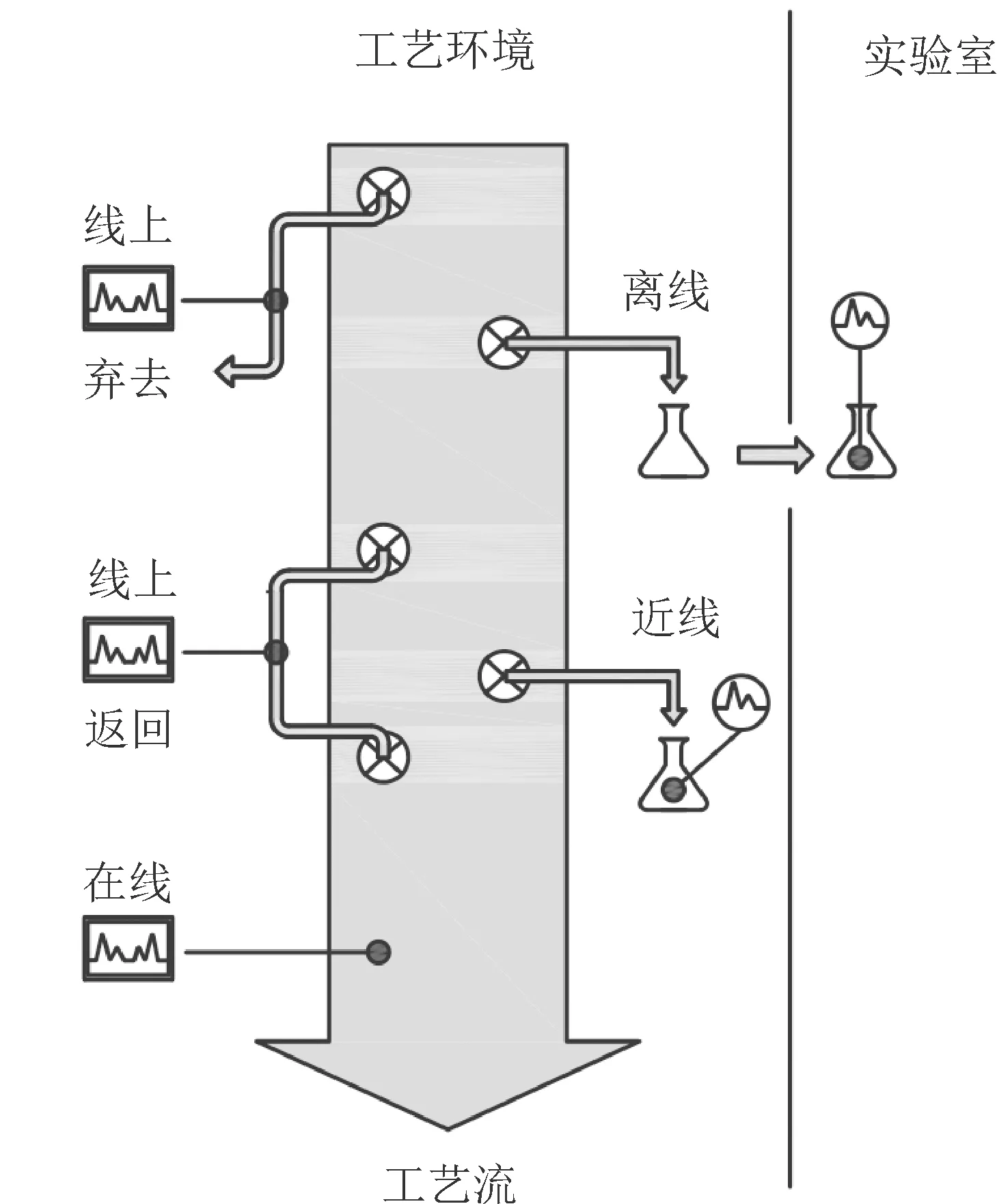
图1 分析技术与生产过程的接口模式
5.25强调,PAT中的分析一词是广义的,包括以综合方式进行并结合数据分析的化学、物理和微生物测量。5.25并不包括PAT传感器的具体说明,但提供了一种在PAT中集成分析技术的通用方法及应用PAT需要考虑的方面。5.25指出,在应用PAT时,必须考虑获取样品进行测试、分析样品和后续结果之间的时间延迟。可以通过基于传感器的连续测量系统,在特定单元操作期间直接与工艺流进行交互来缩短时间延迟。
分析技术与生产过程的接口模式,如离线(off-line)、近线、线上或在线是PAT应用的核心。使用线上和在线系统的测量是将分析技术转移到工艺流中,通常支持快速和自动化的过程调整,而离线和近线测量则将样品从工艺流转移到分析设备。需要根据检查的规模,确定测量的频率和时间。物料的物理属性可能会干扰测量系统的采集特性,例如在设计和使用时要充分考虑固体或悬浮液的散射特性,避免导致显著的光谱差异,确保充分描述工艺和物料。可构建定性模型,如过程轨迹或过程签名,用于表征过程可变性并突出异常的过程行为。需要证明PAT测量、模型和相关质量属性或性能特征之间的因果关系。尽管某些验证方法可能与传统质量控制方法不同,一般的验证原则也适用于线上或在线测量。对于精密度的评价,由于线上或在线方法的测量物料是在过程中快速变化或移动的(如快速干燥过程或反应监测),通常需要将线上或在线测量的结果与参考方法的结果进行比较[36]。
SPC包括一组数据分析方法,用于监控和控制基于过程变异性分析的过程(如CQAS)。根据由PAT仪器收集的实时数据,SPC可在必要时进行过程调整,以保持或达到所需状态,并确保过程保持在受控状态,如质量属性或过程变量的趋势分析。SPC还可用于测量过程可变性和过程能力(即生产符合要求的产品的能力),以增强对过程的理解,从而改进生命周期管理。可以使用多变量统计过程控制(multiva-riate statistical process control,MSPC)同时分析多个变量,考虑其潜在的相关性[36]。
2.1.2EP其他通则 EP中所收载的分析技术通则主要是为离线分析系统设计的方法标准。为推动和促进这些技术与PAT的结合使用,近年来EP在与PAT相关的多个常用技术与数据分析方法通则中增订相应内容,以支持5.25通则的应用(见表3)。如2021年EP 10.4版新增了5.28多变量统计过程控制指导原则,是第一部收载关于MSPC通则的药典,目的是提供数据分析工具,补充EP 5.21用于数据分析的化学计量学指导原则,帮助分析来自分析方法和制造过程的数据,为将MSPC应用于PAT提供指导[37]。5.28深入阐述了MSPC的原理和多变量控制图的开发和使用,并概述了多变量统计程序的理论背景[38]。
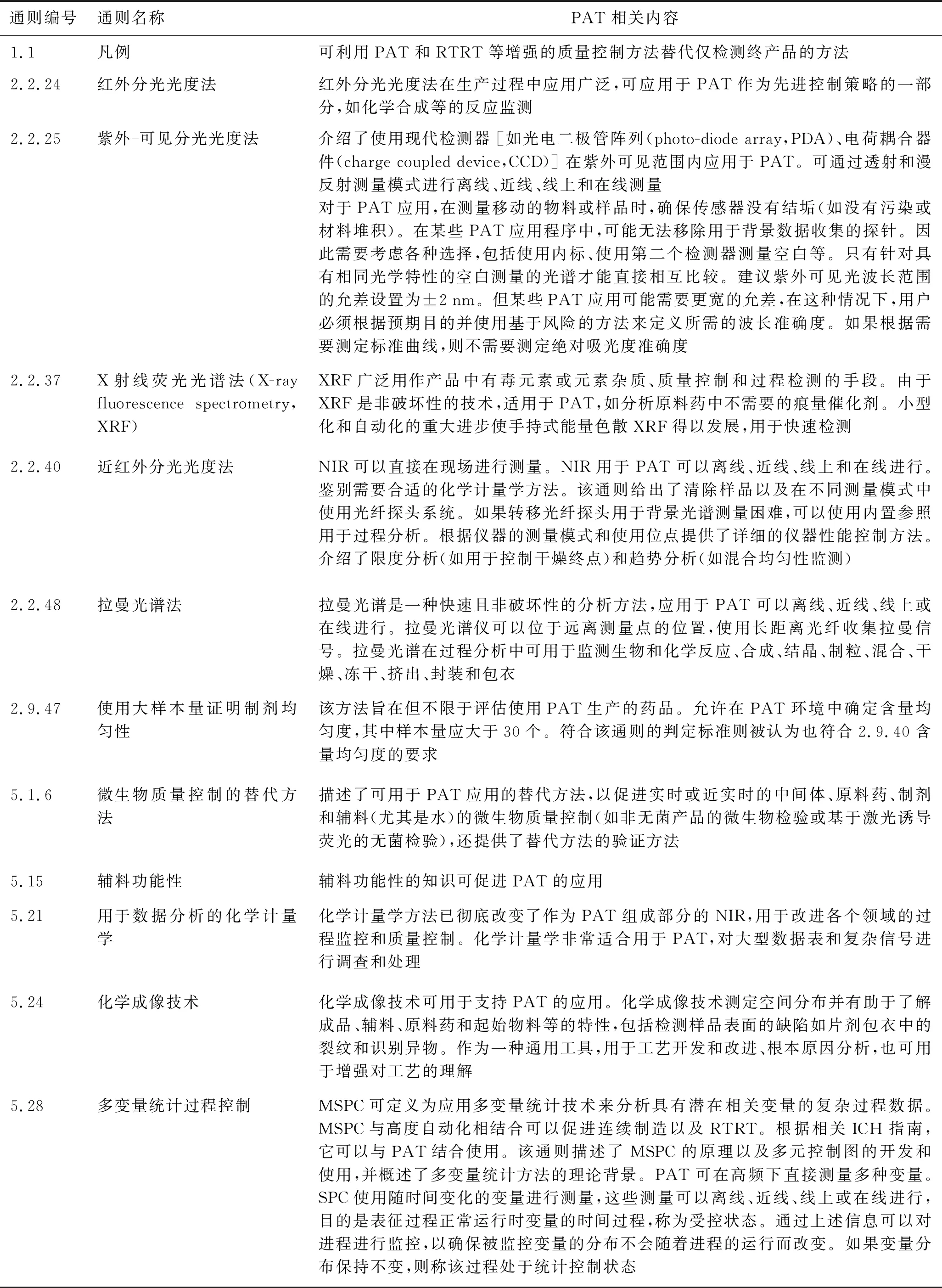
表3 EP中支持PAT的通则
EP在PAT领域开展的主要工作包括:1.审查凡例和通则:(1)修订凡例以考虑RTRT;(2)修订分析技术通则,如近红外分光光度法(near-infrared spectrophotometry,NIR),以适应从工作台到在线测量的变化;(3)增订支持性的分析技术新通则,如近红外成像、太赫兹光谱、声学、浸透率。2.探索样品量和判定标准之间的关系,如含量均匀度(uniformity of dosage units,UDU)。ICH Q8药品研发指导原则指出,与依据药典含量均匀度方法进行成品检测的传统方式相比,在生产过程中进行的含量均匀度检测(如使用质量变化和NIR检测)可实现RTRT,提供更高的质量保证水平[33]。利用PAT可以在线监控更大的样本量(n=100~10 000)。因此,EP 2.9.40含量均匀度通则中传统的n=20的判定标准,对于大样本量来说太严格而不再适用。EP 2.9.47使用大样本量证明制剂均匀性通则收载了2种适用于大样本量(n≥100)的含量均匀度检测方法,满足任何一种方法的要求都被认为符合EP 2.9.40含量均匀度通则[39]。
2.2 USP中与PAT相关的通则
连续制造的快速发展引起了USP对连续生产过程中所涉及的质量标准的关注。2005年起,USP开始增订、修订与PAT相关的近红外光谱、化学计量学和快速微生物分析方法等通则,保持这些通则与时代信息的一致性(见表4)[40]。2018年11月,USP发布了启动文件,阐述了USP对药品连续制造的观点,认为目前仍然迫切需要制定质量标准来促进连续制造的发展,如标准化物料特性的表征方法(如加强对原材料和中间体物理性质的理解和过程管理,见表5)、规范设备性能要求、标准化传感技术、标准化控制能力、规范产品/工艺开发方法等方面[41]。特别需要在新的和不熟悉的技术方面制定标准,包括实时PAT、先进的控制系统以及验证和处理系统的方法,因为这些系统产生的数据流可能达到工艺理解和统计评估的新水平。该启动文件提供了2个PAT应用于连续制造的示例,一个是通过在线光谱工具预测含量或均匀度,另一个是非光谱PAT的应用,即从进料器/工艺数据中预测产品的浓度。

表5(续) USP中支持物料特性表征的分析技术通则
光谱技术增强了连续制造方法的实施[42],而非光谱过程数据和相关模型也能以更短的时间获取和分析信息,同时比光谱数据更强大、更易解释。此外,适当地与其他数据聚合,非光谱信息可以提供更广泛、更完整的系统状态的表征[41]。
2.3 JP中与PAT相关的通则
JP在凡例、拉曼光谱法和电导率测定通则中提及了PAT的应用(见表6)。与EP类似,JP 6.02含量均匀度通则的判定标准基于抽样测试,从大批次中抽取小样本用于产品放行,对产品测试性能的质量评估取决于样本量的大小,样本量越大,评估越准确,但会导致资源的浪费,不适用于超过100的大样本量[43]。近年来,随着PAT的快速发展,大样本量的使用更为普遍,有必要制定基于大样本量的RTRT的含量均匀度新标准。因此,JP收载了G6过程分析技术RTRT中的含量均匀度标准,阐述了对RTRT中超过100个大样本量含量均匀度标准的考虑。G6指出,在制定标准限值时,应平衡保证质量的限值(可接受限值)和实际测试情况之间的关系。当标准过于严格时,尽管产品质量会提高,但实际产品的测试合格率低将导致供应短缺,成本将升高。为了确保产品质量,最合理的做法是比较消费者风险和生产者风险,并确定最合适的限值标准。G6提供了基于最小且最佳的样本量的严格标准,以避免不合格产品的放行[44]。
2.4 《中国药典》中与PAT相关的通则
2020年版《中国药典》中收载了0421拉曼光谱法和9104近红外分光光度法,并提及了它们在过程分析中的应用。9104近红外分光光度法中指出,近红外分光光度法具有快速、准确、对样品无破坏的检测特性,不仅能进行离线分析,还能直接进行在线过程控制。0421拉曼光谱法中指出,拉曼光谱可用于过程分析,如生物和化学反应,合成、结晶、制粒、混合、干燥、冻干、压片、装填胶囊和包衣[45-46]。此外,9201药品微生物检验替代方法验证指导原则为实时或近实时监控等非药典方法能否替代药典方法提供了指导[47]。
3 对增订、修订《中国药典》PAT相关通则的展望
随着科学与技术的进步,PAT已成为全球药品生产、质量管理和分析领域的前沿技术。我国“十三五”“十四五”医药工业发展规划和智能制造发展规划等文件的发布,使PAT的概念在我国药品监管机构和制药企业之间逐步被提及并日渐熟知。2021年10月18日,国家药品监督管理局药品审评中心发布了关于公开征求ICH指导原则《Q13:原料药和制剂的连续制造》意见的通知,2022年9月又发布了《化药口服固体制剂连续制造技术指导原则(征求意见稿)》[48-49],鼓励连续制造生产模式的发展,其中提出“PAT的应用可以获取生产运行期间工艺参数及物料(包括输入物料、中间过程物料、输出物料)质量属性的实时信息,用于实现瞬时扰动和工艺偏差的灵敏检出、主动工艺控制、物料分流以及实时放行检验”,意味着PAT将会成为药品生产过程智能化检测的必然方法。
一直以来,药典为新药研发和药品质量管理提供了先进和可持续发展的分析检测技术标准。如前所述,各国药典已在PAT领域提出了众多新工具、新方法和新标准。相比而言,《中国药典》中与PAT相关的内容较少,PAT配套技术标准的制定工作亟待开展。参考国外药典的经验,开展《中国药典》PAT相关标准的制定和修订,将不断完善我国在这一领域的监管制度,为制药企业提供PAT的指导依据[2,50]。一是针对常用的和近年来发展的过程分析仪器技术,如近红外光谱、拉曼光谱、高效液相色谱、核磁共振波谱、X射线荧光光谱、粉末X-射线衍射、太赫兹光谱、激光诱导击穿光谱、声发射、扫描电子显微镜及近红外光谱成像、拉曼光谱成像、太赫兹脉冲成像等,增订和修订《中国药典》相关标准,反映其原理、应用目的、检测方式(在线/线上/近线/离线)、系统构成(硬件、软件、分析模型)、影响因素和消除方式、验证项目/方法与标准等。二是针对制药原料、中间体、成品的质量属性和过程参数,增订和修订《中国药典》中与物料物理属性相关的分析方法标准,如粉体流动性、粉体细度、孔隙率和孔隙体积、粒度分布、含量均匀度、片剂破碎力、片剂压缩特性等。三是针对描述质量属性与过程参数间关联关系的数学模型等工具,增订《中国药典》用于数据分析的化学计量学指导原则。列举PAT方法开发中使用的模型种类,模型建立过程中常用的数据处理方法,各类模型建立流程及注意事项等。四是针对过程控制策略,增订多变量统计过程控制或其他相关指导原则,提供如通过控制图监控质量属性实现工艺性能的提升并减少关键参数变化的方法等。
综上所述,通过不断完善《中国药典》相关标准,将减少实施PAT的技术障碍,帮助和鼓励我国制药行业尽早应用PAT等新技术提高产品质量,推动制药行业向自动化、信息化和智能化的高质量发展,推进我国向制药强国战略目标不断迈进。
