不同种植条件与不同干燥方法对苦玄参各部位苦玄参苷IA和IB的影响
2022-11-11冯晓林
冯晓林
不同种植条件与不同干燥方法对苦玄参各部位苦玄参苷IA和IB的影响
冯晓林
(广西梧州制药(集团)股份有限公司,广西 梧州 543000)
目的:研究不同种植条件及不同干燥方法对苦玄参不同部位苦玄参苷IA、IB含量的影响。方法:采用高效液相色谱法测定各样品中苦玄参苷IA、IB的含量。结果:覆膜与不覆膜管理对不同部位苦玄参苷IA、IB有不同的影响,而施肥有利于苦玄参苷IA、IB的累积。不同干燥方法考察中,苦玄参苷IA、IB的含量从高到低均为叶>全草>果;对于苦玄参叶部位,沸水烫后60℃烘干苦玄参苷IA含量最高,50 ℃烘干苦玄参苷IB含量最高;100 ℃快速干燥和60 ℃干燥比较中,叶片中苦玄参苷IA含量大小为100℃>60℃,而苦玄参苷IB含量相差不大。结论:种植过程可采取定期施肥管理;苦玄参不同部位中苦玄参苷IA、IB含量不同,叶片中苦玄参苷IA、IB含量最高,且高温干燥有利于叶中苦玄参苷IA的保留。
种植条件;干燥方法;不同部位;苦玄参苷IA;苦玄参苷IB;含量测定
引言
本品为玄参科植物苦玄参(Lour)的干燥全草,系玄参科苦玄参属唯一一种植物,为一年生草本[1]。苦玄参性寒,味苦,能入肺、胃经,苦玄参苷IA、苦玄参苷IB作为苦玄参药材主要活性成分,其含量高低是评价药材质量的重要指标。苦玄参具清热凉血、解热泻火、解毒滋阴、消肿止痛等功效,可用于咽喉肿痛、鼻咽干燥、痄腮、胃热腹痛、毒蛇咬伤等症[2,3]。现有含苦玄参药材的中成药制剂有妇炎净胶囊、炎见宁片、清肺散结丸等,临床疗效反映较好[4,5]。苦玄参在我国主要分布于广东、广西和云南南部,在广西民间应用已经有二百多年的历史[6],是广西常用中药。近年来,关于苦玄参的研究多集中在有效成分动态积累以及化学成分的分离提取,而对药材种植方式、干燥方法研究相对较少[7-13]。本实验通过考查不同种植条件与不同干燥方法对苦玄参不同部位苦中玄参苷IA、IB含量的影响,为保证临床使用疗效、确定苦玄参较优的种植条件与干燥方法提供研究思路。
1 材料
1.1 试药
苦玄参苷IA对照品(厂家:中国食品药品检定研究院,批号:111745-200501)、苦玄参苷IB对照品(批号:K-016-170426);甲醇(厂家:西陇科学股份有限公司,批号:180701,纯度:分析纯);乙腈(厂家:北京迪马科技有限公司,批号:R141579,纯度:色谱纯)。苦玄参药材采自广西壮族自治区苍梧县岭脚镇武烈村苦玄参种植基地。
1.2 仪器
Thermo U3000高效液相色谱仪(赛默飞世尔科技有限公司),XPE204电子分析天平(梅特勒-托利多(上海)有限公司),HH-ZK8恒温水浴锅(巩义市予华仪器有限责任公司),FW80粉碎机(天津泰斯特仪器有限公司),GZX-9140MBE鼓风干燥箱(上海博迅实业有限公司医疗设备厂),HNY-500型超声波清洗器(广州市华南超声设备有限公司)。
2 方法与结果
2.1 种植方式
于种植基地分别选取5个不同地块,进行施肥与未施肥、覆膜与不覆膜管理,种植方式详见表1。于不同地块分别随机采收适量苦玄参药材,取部分样品将茎、叶、果分开,保存待用,剩余样品全草保存待用。

表1 不同地块种植方式
2.2 干燥方法
2.2.150℃烘干
取新鲜苦玄参药材茎、叶、果及全草置不同托盘内,剪成2 cm的长段,于50℃烘箱中进行干燥,干燥过程中上下翻动以促进药材烘干,干燥时长约为13 h,各部位及全草分别用密封袋包装,保存待用。
2.2.260℃烘干
取新鲜苦玄参药材茎、叶、果及全草置不同托盘内,剪成2 cm的长段,于60℃烘箱中进行干燥,干燥过程中上下翻动以促进药材烘干,干燥时长约为12 h,各部位及全草分别用密封袋包装,保存待用。
2.2.370℃烘干
取新鲜苦玄参药材茎、叶、果及全草置不同托盘内,剪成2 cm的长段,于70℃烘箱中进行干燥,干燥过程中上下翻动以促进药材烘干,干燥时长约为5.5 h,各部位及全草分别用密封袋包装,保存待用。
2.2.4自然晒干
取新鲜苦玄参药材茎、叶、果及全草,剪成2 cm的长段,平铺于楼顶上进行晒干,干燥过程中上下翻动以促进药材干燥,干燥时长约为21.5 h,各部位及全草分别用密封袋包装,保存待用。
2.2.5自然阴干
取新鲜苦玄参药材茎、叶、果及全草,剪成2 cm的长段,置实验室内阴凉通风处阴干,干燥过程中上下翻动以促进药材干燥,干燥时长约为15 d,各部位及全草分别用密封袋包装,保存待用。
2.2.6沸水烫后60℃烘干
取新鲜苦玄参茎、叶、果、及全草,在沸水中烫约2 min,捞起后沥干水分,剪成2 cm的长段,置于托盘内,在60℃烘箱中进行干燥,干燥时长约为11.5 h,各部位及全草分别用密封袋包装,保存待用。
2.2.760℃烘干和100℃快速干燥
将新鲜苦玄参药材茎、叶、果及全草均分为2份并置托盘内,分别置60℃烘箱干燥4 h和置100℃烘箱快速干燥1 h,各部位及全草分别用密封袋包装,保存待用。
2.3 苦玄参苷IA、IB的含量测定
2.3.1 对照品溶液的制备
分别精密称取苦玄参苷IA对照品、苦玄参苷IB对照品适量,置量瓶内,加甲醇溶解并稀释至刻度,摇匀,制成每1 mL含苦玄参苷IA 0.1001 mg、含苦玄参苷IB 0.0997 mg的混合对照品溶液,用微孔滤膜(0.45 μm)过滤,即得。
2.3.2供试品溶液的制备
分别取干燥的苦玄参茎、叶、果、全草,粉碎为过3号筛的细粉。各样品平行称取2份,每份约1 g,精密称定,置100 mL具塞锥形瓶中,精密加入60%甲醇25 mL,密塞,称定重量,加热回流30 min,放冷至室温,再称定重量,用60%甲醇补足减失的重量,摇匀,微孔滤膜滤过(0.45 μm),取续滤液,即得。
2.3.3色谱条件
参照《中国药典》(2015年版)“第一部苦玄参药材含量测定方法”,色谱柱ODS-3(4.6*250 mm,5 μm S/N: 1A7187053),流动相乙腈-水(35∶65),流速1.0 mL·min-1,检测波长264 nm,柱温35℃,进样量10 μL。色谱图见图1。
1.苦玄参苷IB 2.苦玄参苷IA A.苦玄参全草供试品 B.苦玄参叶供试品 C.苦玄参果供试品 D.苦玄参茎供试品 E.苦玄参苷IA、IB混合对照品
图1苦玄参茎、叶、果及全草的HPLC
2.3.4 不同种植方式含量测定
取不同种植方式下新鲜苦玄参药材,置60℃烘箱烘干,按“2.3.2”项方法进行提取,按“2.3.3”项色谱条件进行测定,记录苦玄参苷IA、苦玄参苷IB的峰面积,计算含量,结果见表2。
由表2和图2、图3可知,在覆膜种植条件下,地块5(有地膜,刚施第3次肥)苦玄参茎与叶中苦玄参苷IA含量、茎中苦玄参苷IB含量均相对较高;对于部位果,则是地块4(有地膜,施肥3次)苦玄参苷IA、IB含量最高。在相同未施肥条件下,对于部位茎而言,地块2(有地膜,未施肥)苦玄参苷IA、IB含量均高于地块1(无地膜,未施肥);对于部位叶和果,苦玄参苷IA含量为地块1(无地膜,未施肥)高于地块2(有地膜,未施肥),苦玄参苷IB含量则为地块2(有地膜,未施肥)高于地块1(无地膜,未施肥)。
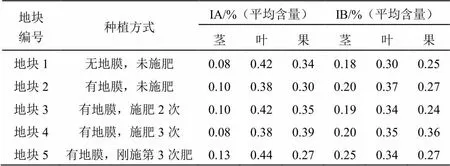
表2 不同种植方式苦玄参含量测定结果
图2 不同种植方式比较(IA)
图3 不同种植方式比较(IB)
2.3.5 不同干燥方法含量测定
取采集自同一地块的苦玄参药材按“2.2”项干燥方法进行干燥,将不同干燥方法处理的样品按照“2.3.2”项方法进行提取,按2.3.3项色谱条件进行测定,计算各样品中苦玄参苷IA、IB的含量。
结果显示,在不同干燥方法下,苦玄参苷IA的含量大小为:叶>全草>果>茎,苦玄参苷IB的含量大小为:叶>全草>茎≈果,与其它部位相较,苦玄参叶中IA、IB含量均为最高。不同干燥方法对茎、果、全草中苦玄参苷IA、IB含量影响相对较小(表3、图4、图5),而对于苦玄参叶部位,干燥方法6(沸水烫后60℃烘干)中的苦玄参苷IA含量最高,干燥方法1(50℃烘干)中的苦玄参苷IB含量最高。因此,实验进一步比较在100 ℃快速干燥(1 h)和60 ℃干燥(4 h)下苦玄参不同部位苦玄参苷IA、IB的含量,结果显示,苦玄参叶中苦玄参苷IA含量大小为100℃>60℃,其他部位在100℃快速干燥(1 h)和60℃干燥(4 h)下苦玄参苷IA、IB的含量差异均较小(表4、图6、图7)。
2.4 不同提取方式和不同提取溶剂考察
2.4.1 提取方法考察
用超声提取法和回流提取法考察成分是否提取完全,结果表明回流提取法中苦玄参苷IA含量为0.53%、苦玄参苷IB含量为0.40%,超声提取法中苦玄参苷IA含量为0.49%、苦玄参苷IB含量为0.40%,回流提取苦玄参苷IB含量无明显差异,但苦玄参苷IA的含量更高,因此确定回流提取法使得有效成分提取更完全。
2.4.2 提取溶剂考察
分别用不同提取溶剂(水、20%甲醇、40%甲醇、50%甲醇、60%甲醇、70%甲醇、80%甲醇、甲醇)考察成分提取是否完全,结果在上述不同提取溶剂中苦玄参苷IA含量分别为0.11%、0.32%、0.48%、0.46%、0.51%、0.48%、0.49%、0.40%,苦玄参苷IB含量分别为0.18%、0.32%、0.52%、0.36%、0.36%、0.37%、0.35%、0.26%,采用60%甲醇提取苦玄参药材,苦玄参苷IA的含量最高,因此确定最佳的提取溶剂为60%甲醇。

表3 6种不同干燥方法苦玄参含量测定结果

表4 60℃烘干和100℃快速烘干苦玄参含量比较
图46种不同干燥方法比较(IA)
图56种不同干燥方法比较(IB)
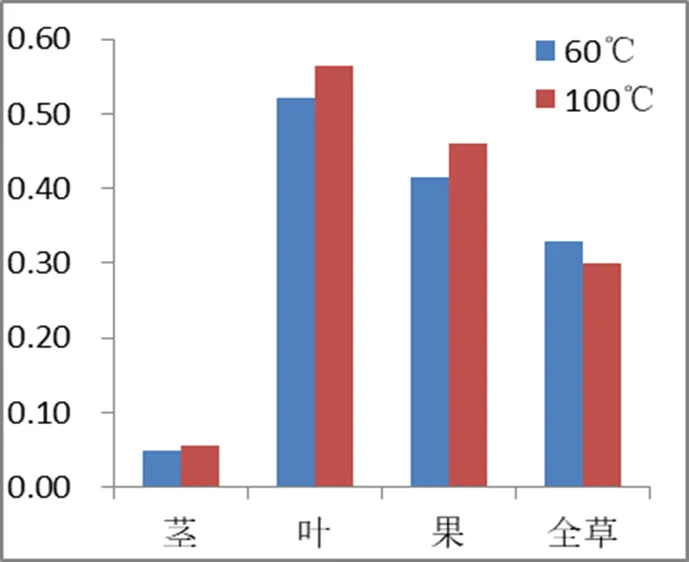
图6 60℃和100℃两种干燥方法比较(IA)
图760℃和100℃两种干燥方法比较(IB)
3 结束语
根据不同种植方式中苦玄参苷含量测定结果可知,覆膜种植有利于苦玄参茎中苦玄参苷IA、IB的积累,并有利于叶和果中苦玄参苷IB的积累;而不覆膜种植则有利于苦玄参叶、果中苦玄参苷IA的积累;施加肥料可使苦玄参苷IA、IB含量增加,有利于其成分累积。不同部位苦玄参苷含量比较,对于同一种干燥方法而言,苦玄参苷IA含量由小到大依次为茎<果<全草<叶,而苦玄参苷IB含量由小到大依次为茎≈果<全草<叶。不同干燥方法比较中,不同的干燥方法对茎、果、全草中苦玄参苷IA、IB含量影响相对较小,而在苦玄参叶部位,干燥方法6(沸水烫后60℃烘干)中的苦玄参苷IA含量最高,干燥方法1(50℃烘干)中的苦玄参苷IB含量最高,且在进一步比较试验结果中显示,苦玄参苷IA含量100℃>60℃,苦玄参苷IB含量在100℃和60℃下相差不大。由此推测,在苦玄参叶部位中,高温有利于苦玄参苷IA的保留,原因可能为高温可达到“杀酶保苷”的作用,而水解苦玄参苷IA的酶类存在于叶部位,因此高温较其他干燥方法对茎、果、全草中苦玄参苷IA影响较小,而对叶则能使苦玄参苷IA得到较好保留。《中国药典》对苦玄参的要求是取全草,秋季采收,晒干。但本实验初步发现苦玄参的指标性成分苦玄参苷IA有可能为酶破解的苷类,在叶部位的含量最高,且高温能达到“杀酶保苷”的作用,为验证此结论,下一步将研究不同产地苦玄参在高温和低温条件下苦玄参苷IA的含量变化及考察不同干燥方法处理后存放过程中指标性成分的下降程度和速度变化,为苦玄参药材的干燥方法提供参考,为提高中药材疗效和保质期提供一些思路。
[1] 宁德生. 苦玄参苷类成分的积累动态研究[J]. 广西植物,2012,32(1): 134-137.
[2] 李松. 清热解毒的苦玄参[J]. 首都食品与医药,2016,23(19): 60.
[3] 李玲. HPLC法测定不同产地苦玄参中3种成分的含量[J]. 中药材,2016,39(2): 355-357.
[4] 瞿京红. 利咽清火含片中苦玄参苷IA的含量测定[J]. 中医药导报,2016,22(1): 48-50.
[5] 唐秀玲. HPLC法测定妇炎净胶囊中苦玄参苷IA的含量[J]. 中国药师,2011,14(3): 429-431.
[6] 谢阳姣. 苦玄参育种材料遗传多样性SSR分析[J]. 南方农业学报,2017,48(1): 20-25.
[7] 唐德智. 高效液相色谱波长切换法测定万通炎康片中异嗪皮啶、迷迭香酸、苦玄参苷ⅠA和苦玄参苷IB的含量[J]. 中南药学,2016,14(7): 763-767.
[8] 丘琴. 苦玄参种子石油醚部位化学成分研究[J]. 中药材,2013,36(2): 230-232.
[9] 季新宇. 玄参化学成分研究[J]. 天然产物研究与开发,2014,26(11): 1775-1779,1848.
[10] 张新建. RP-HPLC法测定清炎滴丸中苦玄参昔IA的含量[J]. 中华中医药学刊,2014,32(10): 2425-2427.
[11] 潘翠柳. 苦玄参生药学与质量分析的研究进展[J]. 广州化工,2016,44(14): 10-11.
[12] 方兔慧. 苦玄参近年研究的进展[J]. 中国民族民间医药,2011,20(24): 62.
[13] 陈勇. 苦玄参药材有效成分含量积累动态的研究[J]. 时珍国医国药,2010,21(2): 371-372.
Effects of Different Planting Conditions and Different Drying Methods on Picfeltarraenin IA and IB in Different Parts ofLour
Objective: To study the effects of different planting conditions and different drying methods on the contents of picfeltarraenin IA and IB in different parts ofLour. Methods: HPLC was used to determine the content of picfeltarraenin IA and IB in each sample. Results: The effects of film mulching and non-film mulching on picfeltarraenin IA and IB in different parts were different, and fertilization was beneficial to the accumulation of picfeltarraenin IA and IB. In different drying methods, the contents of picfeltarraenin IA and IB from high to low were leaf>whole grass>fruit. Picfeltarraenin IA from the leaves ofLour, blanch with boiling water and drying at 60℃ has the highest content. Picfeltarraenin IB from the leaves ofLour, drying at 50℃ has the highest content. In the comparison of 100℃ rapid drying and 60℃ drying, the content of picfeltarraenin IA in leaves was 100℃>60℃, while the content of picfeltarraenin IB had little difference. Conclusion: Regular fertilization management can be adopted in planting process. The contents of picfeltarraenin IA and IB in different parts ofLour were different, the contents of picfeltarraenin IA and IB in leaves were the highest, and high temperature drying was beneficial to the retention of picfeltarraenin IA in leaves.
planting conditions; drying methods; different parts; picfeltarraenin IA; picfeltarraenin IB; content determination
R282
A
1008-1151(2022)10-0056-04
2022-08-19
冯晓林(1997-),女,广西贵港人,广西梧州制药(集团)股份有限公司药材研究专员,从事中药相关研究工作。
