脑小血管病研究的神经影像学标准STRIVE-2
——自2013年以来的新进展
2023-11-14叶瑾怡王赞龚宇田郭蕾果彤胡琨陆瑶单舒乙王玲悦芳芳朱婧涵郑欣雅陈玮琪王伊龙第一作者
叶瑾怡,王赞,龚宇田,郭蕾,果彤,胡琨,陆瑶,单舒乙,王玲,悦芳芳,朱婧涵,郑欣雅,陈玮琪,2,王伊龙,2,3,4,5,6,7(*第一作者)
1 背景
脑小血管病(small vessel disease,SVD)可导致25%的缺血性卒中,且是老年人颅内出血、血管性痴呆发生的主要原因,与运动障碍、步态异常、精神行为和情绪障碍等症状相关[1]。
2013年发表的脑小血管病国际影像标准1(standards for reporting vascular changes on neuroimaging 1,STRIVE-1)旨在明确SVD特征的影像学定义,鼓励采用统一的术语,从而更好地研究和理解SVD的病因、症状及预后,推进SVD相关预防、诊治策略的制定。STRIVE-1主要围绕近期皮质下小梗死(recent small subcortical infarcts,RSSI)、假定血管源性腔隙、假定血管源性脑白质高信号(white matter hyperintensities,WMH)、血管周围间隙(perivascular spaces,PVS)、脑微出血(cerebral microbleeds,CMB)和脑萎缩。
自2013年以来,对于SVD影像特征的理解取得了较大的进展,例如:发现了SVD影像特征随时间呈动态变化且存在相互关联,探索了新的SVD影像特征,以及优化了脑结构与血管功能损伤的MRI标志物。因此,STRIVE-1研究人员再次召开会议,回顾2013年以来该领域的研究进展,重新思考并对STRIVE-1提出的术语进行必要更新,同时更新了2013年SVD影像特征报告标准并提出新的建议。STRIVE-2重点关注SVD神经影像学特征及其研究用途,而非SVD的临床特征和临床管理。本文还概述了亟须标准化的新兴影像学特征和关键定量成像方法,以便于这些技术在日后研究中被更广泛地应用。
2 STRIVE-1术语的采用
STRIVE-1提出了描述SVD影像学特征的术语,并避免对其与SVD病理、病理生理学及临床关联做出推断假设。最佳术语应该具有特异性,简短且与既往描述准确的用语存在关联,同时不存在假想推断。
系统文献检索结果提示,STRIVE-1推荐的WMH、PVS、CMB等术语已经替代了大部分不同用语,但RSSI、腔隙和脑萎缩等术语仍使用较少。因此,研究人员采用STRIVE-1中相同的审阅步骤,重新评估上述术语,以确定是否有更好、更直观的术语,从而改进报告标准。
3 方法
STRIVE-2共召集了50位多种专业领域和不同地区的专家(包括参与STRIVE-1制定的部分专家以及新的专家)。所有专家被分成10个工作组,每个工作组由1位组长领导,撰写基于证据的相关内容和建议,通过小组讨论后达成一致,邀请外部顾问审查草案,并对有争议的问题进行讨论。
工作组通过系统检索文献评估STRIVE-1术语使用的一致性以及该领域的新发现,同时调查STRIVE-2项目组目前的临床和研究方案。正如STRIVE-1规定,术语及其定义应当反映影像学特征,而非对其病理改变或机制做出推断假设,尤其是当相关病理机制尚未被充分阐明时,以避免对未来SVD研究产生影响。也就是说,应仅描述客观所见,而非主观猜想。在形成最终共识前,工作组采用了德尔菲原则,即在工作组内先进行广泛、透明的讨论,并在两次研讨会上进行全组讨论,同时对存在争议的内容进行匿名在线调查。STRIVE-2在EQUATOR网站(网址:https://www.equator-network.org)上更新STRIVE-1的内容。同时,为了更好地理解和应用STRIVE-2,工作组详细地描述了SVD特征的不常见表现、警示征象、时间动态演变过程和不同特征之间的区分等细节。
STRIVE-2是基于STRIVE-1的进一步扩展,重点关注SVD研究领域的新进展,并避免对既往内容的重复。因此,应结合STRIVE-1阅读和应用STRIVE-2。
4 STRIVE-1定义的影像学特征更新
4.1 近期皮质下小梗死
RSSI被描述为“单个穿支动脉供血区域近期发生梗死的神经影像学证据,其影像学特征和临床症状与几周内发生的病变相一致”。STRIVE-1提出的所有术语中,RSSI是应用最少的。在RSSI的众多名称中,常被使用的是“急性腔隙性梗死”。STRIVE-2试图寻求一个更直观的术语,但经过讨论和对6个选项的投票,“近期皮质下小梗死”仍为首选术语。“近期”一词优于“急性”,意味着发生在“前几周内”。选择该名词的原因与STRIVE-1相同。此外,由于RSSI的病理机制尚不明确,应谨慎使用“栓塞”一词。
STRIVE-1界定了单个穿支动脉区域的尺寸标准,即病变最大轴向直径为20 mm。RSSI与其他SVD特征存在关联,表明存在小血管异常,但并非所有RSSI都是穿支动脉病变(图1A)。RSSI与相应的临床症状明显相关,如局灶性神经功能缺损。虽然RSSI这一术语偏离了仅使用影像学特征来进行定义的STRIVE原则,但也明显改善了这一特征的定义清晰度。该术语不适用于所谓的“隐匿性”病变,这些病变或者无临床症状,或者与“非典型的神经行为症状/体征”相关,或者随着时间的推移导致更细微的、渐进性的神经功能恶化(图1B)。目前尚不清楚这些隐匿病变发生的机制,因此这些病变尚不被视为SVD的核心特征。
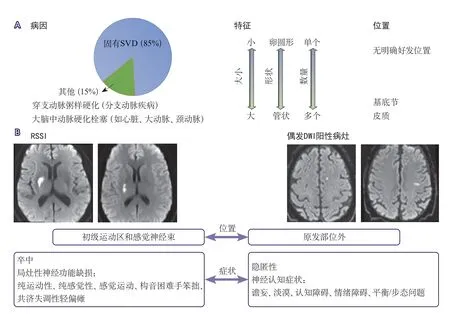
图1 神经影像学特征区分血管内源性因素与其他因素所致的SVD以及区分RSSI与偶发DWI阳性病灶Figure 1 Neuroimaging features differentiating intrinsic SVD from other causes and RSSI from incidental DWI+ lesions
自STRIVE-1提出以来,研究发现RSSI结局变异性很大,例如:完全消失、直径<3 mm的腔隙、空腔、伴有铁沉积(T2WI序列呈低信号)的腔隙,或变成非常小的含铁血黄素沉积渗出(“斑点征”,T2*WI序列高信号)(图2)。RSSI周围的白质纤维束退行性变可能导致邻近区域出现WMH(如果WMH位于RSSI上方则呈“帽状”,如果位于RSSI下方则呈“束状”)。导致RSSI结局变异性的原因尚不清楚,可能与初始RSSI病灶大小、组织损伤、炎症反应、合并症、病灶位置、微循环变化或个体易感性等有关。

图2 近期皮质下小梗死和偶发DWI阳性病灶短期(如数天/数周)到长期(如数月/数年)的演变过程Figure 2 Range of recent (ie,past few weeks) to long-term (ie,months to years) appearances of recent small subcortical infarcts and incidental DWI+ lesions
4.2 假定血管源性的腔隙
STRIVE-1中“假定血管源性的腔隙”定义为可由多种原因引起的、圆形或卵圆形、皮质下充满液体(或脑脊液样)的空腔。与脑内其他部位相比,位于半卵圆中心和基底节区的腔隙可能更大。腔隙的大小一般为直径3~15 mm。目前可以明确的是,直径<3 mm的腔隙可能是RSSI结局(图2),然而部分PVS的直径也可能>3 mm。另外,源于RSSI的腔隙周围也可能没有T2WI序列高信号。因此,仅凭大小或边缘不可能将腔隙从PVS中完全区分出来,还需考虑病灶的形状、共存的PVS及周围组织信号等特点。
“腔隙”一词的使用仍然是不一致的,但仍鼓励采用“腔隙”这一术语描述空腔样病灶。如果是由血管损伤引起,在“腔隙”前增加“假定血管源性”这一前缀。通常“腔隙”不应与“梗死”直接联系,除非确定其是由小的皮质下梗死引起的,因为腔隙也可由出血引起,出现于正常组织或WMH内部及其边缘。
在没有卒中的人群中,腔隙至少可使卒中的未来发生风险增加1倍。腔隙也会增加卒中患者长期预后不良的风险。
T1WI、T2WI和FLAIR序列能直观地评估腔隙,包括其数量和位置。随着自动计算方法的发展,还可以计算空腔的体积。然而,腔隙的检测需要严格的影像学标准和可验证的方法。
4.3 假定血管源性的脑白质高信号
WMH是目前研究最多的SVD特征,在T2WI,尤其是FLAIR序列上呈高信号,通常半球之间对称分布(图3)。“假定血管源性WMH”一词在STRIVE-1中被提出,并已被广泛采纳,应该鼓励使用这一术语,避免使用“缺血性WMH”等术语。“皮质下高信号”一词用于描述深部灰质或脑干区域的病变,目前仍然被广泛使用。
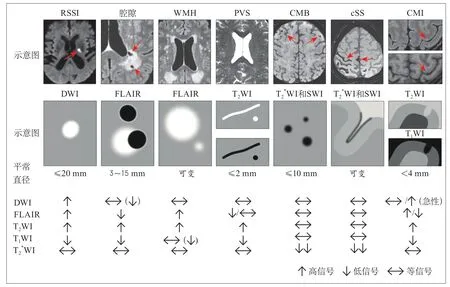
图3 脑小血管病相关病变的MRI特征Figure 3 MRI features of lesions related to small vessel disease
WMH与未来卒中发生风险、卒中严重程度、认知功能下降和死亡、步态不稳和神经精神症状等相关,且损害包括记忆在内的所有主要认知域。WMH通常随着年龄的增长和时间的延长而增加,但“健康人群”中按年龄分层报道的WMH程度相差很大,其中原因尚不清楚。因此,目前尚无法提供可靠的、按年龄分层的WMH标准。
通过定量成像方法可以检测到WMH周围看似正常的组织也已经存在损伤。WMH也可能减少,这可能反映了在永久损伤发生之前多余的组织间液消散。
横断面研究发现,WMH与脑血管反应性(cerebrovascular reactivity,CVR)受损、血脑屏障通透性增加、血管搏动指数增加、静脉胶原增生、静息状态下脑血流量减少等有关,但WMH与脑血流量之间是否存在纵向关联尚不清楚。
虽然已有许多半自动和自动化方法可用于评估WMH,但这些方法的可重复性及方法间的可比性仍然缺乏深入探讨。基于深度学习的算法目前正在开发中,也需要进一步验证STRIVE-1以及统一血管性病变对神经退行性疾病影响的影像评估方法(harmonizing brain imaging methods for vascular contributions to neurodegeneration,HARNESS)倡议中建议的,且经过充分验证的视觉评分方法仍然是可使用的。
4.4 假定血管源性的血管周围间隙
PVS是充满液体的圆形/卵圆形或线性间隙,通常围绕白质或深部灰质区域的小穿支血管。STRIVE-1提出的“血管周围间隙”一词是指MRI上可见的PVS(无“扩大的”前缀),已被广泛采用。在头颅MRI上,PVS信号强度与脑脊液相似。除非位于WMH内,多数PVS在T2WI序列上周边没有高信号的环。PVS通常最大轴向直径<3 mm。大多数PVS分布于基底节区和半卵圆中心,但应与基底神经节中孤立发育的血管周围内陷相鉴别。T2WI和SWI序列以及7.0T MRI显示的PVS主要分布在小动脉周围。
PVS具有高度遗传性,其数量随着年龄增高、血管危险因素增加而增多,并且这些关联性与PVS分布位置的不同而不同。因此,PVS潜在的病理生理学机制可能因其解剖分布位置而不同。在脑淀粉样血管病(cerebral amyloid angiopathy,CAA)波士顿诊断标准2.0中,存在半卵圆中心高负荷PVS和单一仅限于脑叶的出血灶[如脑内出血、CMB或脑皮质表面铁沉积(cortical superficial siderosis,cSS)],提示可能为CAA。虽然少数PVS可能是生理性的,但在广泛的年龄范围内,较大的PVS负荷与常见的神经系统疾病(如卒中、CAA、阿尔茨海默病)有关。在MRI上,PVS可能比腔隙或CMB更早出现,且先于WMH。PVS可以反映脑组织间液和代谢产物的清除能力受损情况。这个过程主要发生在睡眠期间。
实践证明,PVS可通过视觉评分量表进行量化评估。目前许多计算方法被应用于量化PVS,并可更敏感地提示PVS与WMH、视网膜血管直径(与颅内血管相比,视网膜动脉更小、静脉更宽,可以反映颅内小穿支动脉和静脉的损害情况)、遗传变异(反映相关血管功能障碍机制)之间的关联性。推荐使用高分辨率MRI T2WI序列检测PVS,当然也可以采用T1WI序列检查。
4.5 脑微出血
CMB在STRIVE-1中被定义为MRI T2WI或SWI序列上呈低信号的小病变,通常直径为2~5 mm。最初在STRIVE-1中提出的“脑微出血”这一术语现已被广泛采用。
MRI指导下的神经病理学检查已经证实,大多数CMB与微出血相对应。CMB可以发生在不同的脑解剖位置,例如:CAA患者的CMB通常位于灰质及近皮质的白质区域,小动脉硬化症患者的CMB常位于深部脑结构(包括深部灰质和白质、脑干)。这些病变在区域/病理学方面有重叠,提示可能存在共同的病理生理机制,如血管壁增厚、血管重塑,以及可能由淀粉样蛋白沉积、动脉硬化性血管病变或两者共同诱发的血脑屏障功能障碍。老年患者(>65岁)如仅脑叶存在CMB则高度提示存在CAA,但也可能发生于其他病理状态。深部-脑叶混合型CMB可能与小动脉硬化有关。
微出血国际协作网络评分可以预测缺血性卒中患者抗栓治疗期间发生脑出血和缺血性卒中的风险。不过,存在CMB的患者缺血性卒中复发风险高于脑出血的风险,提示CMB不应影响抗血小板或抗凝药物在卒中二级预防中的使用。随机试验数据也提示,CMB不会改变抗栓治疗对CMB形成或临床结局的影响,但目前证据尚有限,需要更多的临床研究来验证。若将cSS这一影像标志纳入CAA的预测模型,则会发现CMB对预测未来脑叶出血事件发生的价值有限。
通常使用视觉评分评估CMB。由于CMB微小、分布稀疏,且血管、钙化或囊尾蚴病等病变均可能出现类似CMB的影像表现,因此很难通过计算方法进行自动评估。CT可以帮助区分真正的CMB和钙化囊虫以及其他MRI上表现类似的病变。正在开发的计算方法仍需要进一步验证。
4.6 脑皮质表面铁沉积
cSS在STRIVE-1中被定义为慢性出血的产物存在或覆盖于脑皮质表面的神经影像学表现。
cSS可能由凸面蛛网膜下腔出血、血管畸形引起的脑皮质出血、脑梗死后出血转化或脑创伤导致。老年患者中大部分cSS是由晚期软脑膜血管CAA引起的凸面蛛网膜下腔出血所致,有时伴随继发性的皮质缺血性损伤。
在T2WI梯度回波或其他对血液检测敏感的MRI序列中,cSS显示为皮质线性低信号。cSS(包括小脑区域)是晚期CAA准确诊断的生物标志物,已被纳入到CAA波士顿诊断标准2.0版本中。
在CAA、急性凸面蛛网膜下腔出血或cSS(偶发于CMB)患者中可以观察到短暂的局灶性神经功能缺损症状,最常见的是单侧、反复、刻板、播散性的躯体感觉障碍,这种临床表现与凸面蛛网膜下腔出血、cSS(或CMB)的解剖学位置有关。
cSS是CAA未来临床事件发生的强预测因素,可以预测CAA患者未来脑出血风险、临床功能下降和脑出血后痴呆的风险。
4.7 脑出血及其他出血标志物
85%的脑出血是由SVD引起的。由于“原发性脑出血”这一定义不明确,且为了避免存在脑出血原因的不确定性,STRIVE-1建议采用术语“假定SVD源性自发性脑出血”取代“原发性脑出血”。
SVD所致的脑出血包括穿支动脉(小动脉硬化性)血管病变和CAA。由于CAA与脑叶出血相关,改进和标准化区分深部与脑叶脑出血的评分工具[例如:脑出血解剖评级工具(cerebral haemorrhage anatomical rating instrument,CHARTS)]可能帮助识别CAA高出血风险患者。爱丁堡CAA标准中纳入了两个基于CT的生物标志物(蛛网膜下腔出血和“指状突起”)及APOE基因型,这一标准可能有助于诊断CAA相关的急性期脑出血。基于CT的爱丁堡CAA标准和基于MRI的CAA波士顿诊断标准2.0在诊断散发性或遗传性CAA所致的急性脑出血方面具有高度的一致性。
4.8 脑萎缩
STRIVE-1定义“脑萎缩”为与特定的肉眼可见的局灶性脑损伤(如脑创伤或脑梗死)无关的脑组织体积缩小。理想的脑萎缩评定需纵向多次测量判定为脑组织体积缩小,而基于横断面判定脑萎缩需要以颅脑体积作为参照,多尺度验证,并采用局部或全脑体积的计算标准。推荐使用“脑萎缩”而不是“脑体积”这一概念来表述SVD相关的脑组织体积缩小。
脑萎缩并非SVD的特异性标志,与SVD共病的神经退行性疾病是导致脑萎缩的主要原因。然而,脑萎缩在SVD患者中发生较明显,且对SVD患者的预后及SVD进展监测有一定的价值。自STRIVE-1发布以来,SVD相关脑萎缩的研究有所增加,2014—2021年发表的相关论文数量达到了STRIVE-1发布之前7年内的3倍。SVD可导致皮质下萎缩(如脑室扩大)和皮质萎缩(如皮质变薄、脑沟增宽)。其潜在机制包括继发性纤维束损伤、局灶性皮质萎缩以及较小病灶(如皮质微梗死)的累积等。SVD导致的局部脑萎缩(包括海马萎缩)与包括阿尔茨海默病在内的神经退行性疾病进程有所重叠。不过,SVD相关脑萎缩的空间模式仍有待阐明。由于脑萎缩并非由SVD特定引起,所以考虑脑萎缩的原因时还应考虑其他共存疾病的病理机制。
随着自动化方法的应用越来越广泛,脑萎缩的测量方法差异性也很大,仍可使用视觉评分来评估脑萎缩。局灶性肉眼可见的脑组织病灶(包括血管性病变)可能干扰对脑萎缩的测量,目前对如何处理局灶性病灶仍未有统一的意见。由于SVD会降低灰质/白质的对比度,以及广泛的SVD特征会使皮质厚度测量很容易出现错误,因此,皮质厚度的测量需要大量后处理。为了提高测量的一致性和避免后处理等问题,急性病灶应待MRI评估稳定后再进行脑萎缩的定量测量。对于严重SVD患者的大数据集处理,需要制定特定的质量控制程序(表1,表2)。

表1 脑小血管病神经影像学特征的拟图像采集标准Table 1 Pseudo-image acquisition criteria for neuroimaging features of small vascular diseases

表2 按特征区别的脑小血管病的图像分析方法Table 2 Image analysis approaches for small vessel disease by feature
5 STRIVE-1定义的影像学特征更新
5.1 SVD综合评分
5.1.1 背景
开发基于影像的量表以评价SVD累积负荷是STRIVE-1的挑战之一,其主要目的是预测SVD患者结局,并方便在临床试验中进行受试者的选择和分层研究。
目前用于评价SVD负荷的视觉评分量表绝大多数是基于MRI影像的,其中使用最早、最广泛的是“SVD总分”,其包括WMH、腔隙、PVS和CMB,具有良好的结构效度。也有量表在“SVD总分”基础上进行了修改,如特定用于评估CAA或基于CT影像进行评估。
STRIVE-2工作组一致认为,这些量表处于发展阶段,仍需后续研究以提高其普适性。SVD综合评分可能对统计研究结果或指导临床有所帮助,但组合评分相对于单个SVD特征评分的真正优势,以及适用的最佳时机尚不清楚。
5.1.2 术语
STRIVE-2工作组共检索到1755篇相关论文,其中748篇研究了多个SVD标志物,198篇将不同的SVD标志物进行组合评估。最常使用的术语是“脑小血管病(cerebral small vessel disease,CSVD)”(73篇)、“CSVD标志物(CSVD markers)”(34篇)及“CSVD负荷(CSVD burden)”(26篇),其中29篇使用了附加限定词“总的(total)”。49篇文献将SVD标志物与阿尔茨海默病相关标志物(如淀粉样蛋白和tau蛋白负荷)相结合,30篇文献将其与脑萎缩进行了组合(称为“脑健康指数”)。工作组提出“SVD综合评分”这一术语,以避免使用“总的”一词,因为不存在真正完全的评分;同时避免使用如“负担”或“负荷”之类的词语表达,以避免情感性暗示。
5.1.3 定义
工作组将SVD综合评分定义为“将任何公认的SVD影像学标志物组合为单个指数、分数或单一的结构形式”,支持纳入STRIVE-1中已经定义的影像标志物。对于多项研究之间的比较,鼓励使用经过验证的量表和量化工具,并强调纳入新的影像学标志物和方法的重要性。采用自动计算方法测算WMH体积、腔隙、PVS、CMB或弥散指标很有前景,但仍需进一步验证。
工作组讨论了是否将临床和功能评价指标纳入SVD评分系统。由于纳入非影像学指标的研究之间结果异质性较大,最终达成应聚焦于神经影像学标志物的一致意见。
建议参考经过验证的评分,如简单的定性视觉评分标准。其不仅较为直观,且临床适用性也高。纳入量化指标的评分可能会提供更敏感的风险预估,但可能不适用于研究环境之外。新的评分需要在不同人群中进行仔细验证和测试,并根据其预期用途(如作为疾病预后标志)进行适当调整。
5.2 脑皮质微梗死
5.2.1 背景
脑皮质微梗死(cortical cerebral microinfarct,CMI)最初被描述为“组织病理学上肉眼不可见的小缺血性病变”。CMI通常在显微镜下的神经病理检查中被观察到,主要发生在皮质,并被认为是衰老的人脑中最广泛的梗死形式,可见于16%~42%的尸检病理。CMI并不是SVD的特异性病变,也可由心脏或动脉来源的微栓塞所导致。自STRIVE-1提出以来,得益于超高场MRI和组织病理学的帮助,在体状态下微梗死的分级标准已经被提出。CMI与认知功能下降相关。较大的CMI(直径0.5~4 mm)可以被常规MRI(包括3D T1WI和FLAIR序列)检测到,且在DWI序列上表现为高信号。超高场MRI虽然提高了检测小CMI病灶的敏感性,但仍然只能观察到神经病理所证实的病灶中的一小部分。
5.2.2 术语
工作组筛选到64篇摘要中提到“脑皮层微梗死(cortical cerebral microinfarct)”“皮层微梗死(cortical microinfarction)”“脑微梗死(cerebral microinfarct)”“慢性微梗死(chronic microinfarct)”等术语,建议统一采用“脑皮层微梗死(cortical cerebral microinfarct,CMI)”这一术语。
5.2.3 定义
由于与WMH和PVS难以区分,CMI检出仅限于皮质灰质区域。陈旧性CMI在T1WI上呈低信号、T2WI/FLAIR上呈高信号、T2WI上呈等信号的楔形形态。根据仅有的MRI影像学-神经病理学关联研究结果,实际操作中曾将CMI的直径大小上限定义为4 mm。
5.2.4 未来发展方向
希望明确CMI大小上限、制定可检测皮质下和小脑部位CMI的可靠诊断标准,同时提高MRI对亚急性期CMI的识别能力。
6 新增加的SVD特征
6.1 偶发DWI阳性病灶
6.1.1 背景
越来越多的在DWI序列呈阳性的皮质下小病灶及皮质微小病灶被识别出来,其发生大多是隐匿的,不伴有局灶性神经功能缺损症状。发生于皮质下的偶发DWI阳性病灶(incidental DWI+lesion)可能与RSSI存在重叠,也与近期发生于皮质的、直径<5 mm的CMI有重叠(图1,图2)。偶发DWI阳性病灶结局多变,包括可能消失、演变为WMH、腔隙或陈旧性CMI(图2)。在重度SVD(如皮质下梗死伴白质脑病的常染色体显性遗传性脑动脉病、脑出血)中此类病灶最常见,提示存在潜在的小血管病变。然而,与RSSI一样,偶发DWI阳性病灶也可能由心源性栓塞、动脉粥样硬化性栓塞或血压下降引起的血流动力学改变所致。
6.1.2 术语
常用术语包括偶发急性梗死、DWI病灶或DWI阳性病灶、DWI高信号、隐匿性脑梗死等。由于其起源、性质和临床意义尚不清楚,经过多次讨论和投票,工作组建议将“偶发DWI阳性病灶”定义为偶然发现的、轴面直径≤20 mm的DWI高信号病灶。偶然发现通常是指在没有新的局灶性神经缺损的情况下行MRI扫描检测到DWI高信号病灶,或所检测到的病灶位置与近期出现的临床症状均无关。
6.1.3 定义
偶发DWI阳性病灶在DWI上表现为小的高信号病灶,相应区域ADC序列上表现为低信号或等信号。需要注意的是,这些病变也可在FLAIR或T2WI序列上表现为高信号,或T1WI序列上表现为低信号。偶发DWI阳性病变若伴T1WI序列高信号,则提示存在急性期出血(原发性出血或脑梗死后出血性转化),因此,应联合DWI与其他主要序列对病灶进行评估。如果及早进行MRI扫描,其他偶发病变(如腔隙或WMH)在急性期阶段就属于DWI阳性病灶。因此,增加DWI序列的使用可以突出显示新近发生的隐匿性病灶。
目前主要通过视觉评估偶发DWI阳性病灶,自动计算方法正在开发中。
6.1.4 未来方向
近年来,越来越多的研究关注这一特征。STRIVE-2工作组一致认为,在将偶发DWI阳性病灶发展为既定SVD标志物之前,仍需要研究了解其病因、病理机制、相关临床症状以及与RSSI的重叠等未知因素。
7 脑结构与功能成像的定量标志物
7.1 SVD中脑损伤的结构影像学定量标志物
7.1.1 背景
目前已有一些定量成像方法被应用于描述SVD的脑影像学特征(表1)。
7.1.2 弥散成像
DWI包括图像采集、数据处理及建模。DWI可用于检测急性缺血性病灶,多个方向DWI数据采集及弥散建模建立有助于展现脑组织的微观结构。弥散张量成像(diffusion tensor imaging,DTI)是一种被应用于捕捉水分子弥散各向异性的成像模型。与传统SVD影像标志相比,骨架化平均弥散率峰值宽度(peak width of skeletonised mean diffusivity,PSMD)技术方法可以更好地检测脑组织微观结构损害与临床症状之间的关联。弥散度量可以进行自动化计算,并应用于多中心研究。通过双张量模型计算的游离水比例也有相似的潜力。不过,目前SVD研究尚未明确纤维追踪及结构连接组学指标是否更优于简单的弥散度量指标。
由于弥散成像与扫描参数、MRI场强和设备型号等有关,因此,研究应对此类信息进行描述。
虽然DWI指标对SVD脑损伤检测很敏感,但特异性一般。在记忆障碍门诊患者中,SVD对DWI指标的影响似乎远远超过阿尔茨海默病。进行体素内特定的纤维束群分析,可能会进一步提高检测的特异性。工作组建议客观报告DWI指标改变结果,从而避免推断其所反应的特定病理过程。
7.1.3 脑组织磁敏感图
脑组织磁敏感改变可以反映铁或其他矿物质的沉积情况,而这与多种脑部疾病(如血管性痴呆、阿尔茨海默病)病理学改变有关。目前已建立的T2WI和SWI序列等测量方法均为半定量测量技术。而R2*弛豫、定量磁敏感图(quantitative susceptibility mapping,QSM)这些定量测量技术则具有较大的应用前景。
7.1.4 未来方向
需要进行研究以确定弥散度量或其他定量测量相对于传统MRI的附加价值。
7.2 SVD中脑血管功能标志物
上面所讨论的SVD特征主要反映脑血管疾病所引起的脑组织结构改变,反映脑血管功能的标志物为评估SVD变化提供了互补性的可靠测量方法。
7.2.1 脑血流灌注成像
脑组织血流灌注是指每分钟每单位脑组织的血流体积[即脑血流量(cerebral blood flow,CBF)],而CVR是指接受刺激后脑组织灌注的变化。通过静脉注射造影剂后进行动态磁敏感对照(dynamic susceptibility contrast,DSC)及动态对比增强(dynamic contrast enhanced,DCE)成像,可反映静息状态下脑组织血流灌注和血脑屏障功能。动脉自旋标记(arterial spin-labelling,ASL)灌注成像则是利用磁标记的动脉血为内源性对比剂来定量测定静息状态下脑组织血流灌注。
横断面研究发现,WMH区域CBF和CVR降低,且较低的CBF与较严重的WMH有关,更重要的是,表观正常的脑白质区域也存在CBF降低。目前该领域纵向研究很少。
相位对比MRI技术可以应用于评估颅内大动脉或静脉窦的血流速度和搏动指数、估算全脑血流供应和CBF。搏动指数不仅可以反映测量位置血管的“僵硬度”,也可以反映心输出量、上下游血管和组织的顺应性。较多的横断面研究表明SVD患者脑血管搏动指数增高,纵向研究进一步发现,SVD加重可能早于血管搏动指数的增加。
7.2.2 血脑屏障成像
2013年以来的研究证据表明,血脑屏障功能障碍是SVD早期的病理生理机制,但缺乏疾病特异性。最近的MRI技术通过测定钆造影剂从血管中泄漏后随时间推移在组织中的分布情况来评价血脑屏障功能障碍。研究已经证实血脑屏障破坏与WMH、认知障碍、脑组织局部血流低灌注以及反映脑组织退行性变性的弥散系数增加等有关。
8 SVD脑影像数据采集和分析标准
8.1 图像采集
建议SVD患者首选MRI而不是CT进行脑影像数据采集,表1对MRI采集方法进行了总结。有些联盟已经提出了一些标准化的图像采集方案。
目前,3.0T MRI已基本替代1.5T MRI被用于进行影像采集。更高场强的MRI(尤其7.0T)能够提高对CMI和穿支动脉的可视化程度,但其实用性仍然有限。
三维容积MRI技术已被广泛应用于科学研究,也逐渐被应用于临床实践中。各向同性1 mm体素是目前结构成像常用的空间分辨率,对于定量分析十分重要。多层同时成像或多波段成像方法能够减少许多二维MRI方法的影像采集时间并提高分辨率。
SVD影像采集临床方案仍然主要集中在T1WI、T2WI、FLAIR、DWI及磁敏感成像上。
8.2 图像分析
计算机图像分析方法被开发于分析各种SVD病变类型,且已取得了实质性进展。HARNESS及血管导致认知障碍和痴呆症的生物标志物(biomarkers for vascular contributions to cognitive impairment and dementia,Mark VCID)等国际联盟已经提出了实施影像分析的框架,涵盖了技术验证(如多次扫描的可重复性、不同扫描设备间的可重复性)和临床验证(如原理验证、有效性验证),系统验证工作也正在进行中。
8.2.1 候选影像生物标志物的技术验证
许多半自动及自动图像分析方法已被应用于分析几乎所有的SVD特征类型。其中,有些方法在特定的条件设定下可以呈现出良好的可靠性(表2),然而在多中心采集的或不同扫描参数获取的图像数据分析中未表现出良好的可靠性。技术上真正的验证要求检验多次扫描的重测信度(多次扫描)、多中心不同扫描设备之间的可重复性以及不同中心的评定者信度。
在数据集中“真值(ground-truth)”标注WMH、腔隙、PVS和CMB有助于计算算法的开发和验证,而这需要在涵盖各种SVD特征的大型数据集中进行广泛测验以检测计算方法的效能。
8.2.2 机器学习/人工智能方法的应用
机器学习应该能够改进SVD的量化评定,但目前能否恰当地标注数据集中的SVD特征,较好地处理真实世界中影像采集和影像质量控制的差异性,以及能否反映各种病理生理学过程的广泛变化仍然是该领域具有挑战性的问题。基于人工智能辅助量化评估SVD特征,并应用于预测SVD患者临床功能、认知结局,能够加深我们了解SVD对卒中发生的影响。
8.2.3 临床试验中采用的SVD评定指标
近期一些已经完成的临床试验[如强化与标准动态血压控制对老年人脑血管结局的影响(effects of intensive versus standard ambulatory blood pressure control on cerebrovascular outcomes in older people,INFINITY)研究和强化血压控制与标准血压控制对可能痴呆的影响(systolic blood pressure intervention trial-systolic blood pressure trial memory and cognition in decreased hypertension,SPRINT-MIND)研究]将SVD特征作为结局指标,并发现强化降压可轻度延缓WMH的进展。不过,目前许多临床研究采用SVD特征作为研究结局,但结果均为中性。
将影像指标作为研究结局的潜在优势包括可以减少临床研究样本量及解释影像-生物学之间的关联性。有观察性研究表明,WMH体积和弥散指标(如PSMD)的纵向变化较某些临床终点结局指标具有更好的统计效度。而将影像指标作为研究结局亦存在一定的局限性,如数据缺失、招募缓慢、试验成本增加、普适性低等;此外,SVD特征不能取代临床结局,除非其作为替代终点已得到充分的验证。SVD临床试验最理想的结局指标仍有待确认。
由于SVD负荷是一个强有力的结局预测指标,因此,在临床试验中,应当通过对所感兴趣的SVD特征和其他人口统计学或预后等变量进行分层,以实现基线期SVD严重程度的随机化平衡。
HARNESS和脑血管病临床试验框架(framework for clinical trials in cerebral small vessel disease,FINESSE)已经提出了SVD影像特征应用于临床实验的系统性研究框架,感兴趣的读者可以参考。
8.2.4 脑血管功能的影像学报告标准
工作组对STRIVE-1中提出的报告标准进行了更新,已发布在EQUATOR网站(网址:https://www.equator-network.org),鼓励研究者在未来的研究中使用工作组所建议的术语和定义。遵循建议中报告标准将会增加未来研究的可比性,从而有利于进行Meta分析和大规模的数据分析。
9 展望和挑战
不断涌现的SVD标志物和评估方法可能有助于对SVD特征进行量化及与混合性疾病中其他病理特征相鉴别,从而可以更高效、更一致地评估SVD的严重程度和进展情况。近期研究方向主要包括区分出由血管内源性因素所引起的RSSI、确定导致RSSI和DWI阳性SVD病灶的小血管病变机理、阐明导致SVD(如WMH)发生发展的病理机制、确定SVD特征引起的继发性脑损伤的危险因素,以及明确预防延缓(甚至逆转)SVD进展的干预措施。低收入及中等收入国家SVD发生率高,而这些国家的SVD研究将促进对SVD的病理机理和疾病修饰因子的理解。
先进的成像技术可以提高对SVD病理生理学和临床表型的认识,但存在一定的局限性,例如:普及性低、扫描时间增加(影响患者的舒适度、依从性或参与意愿)、数据容易缺失,且通用性会受到限制。影像相关的研究需要平衡成像技术的实用性和完美性。与现有标志物相比,新的方法应被证明在预期用途方面具有明显优势。
10 结论
自STRIVE-1被提出后的10年间,许多新增加的SVD特征、结构和功能影像生物标志物,加速了对SVD病理生理学和神经退行性疾病中血管源性机制的理解,为SVD预防和治疗带来了更多机会。我们鼓励在SVD和神经退行性疾病研究中使用这些判定标准,这将有助于实现临床转化。目前的挑战在于保持统一规范的方法学标准,以确保发现真正有用的信息并在科研和临床应用中得到广泛使用。
在经过严格的分析并得到专家们的一致同意后,STRIVE-2得以制定。STRIVE-2制定主要依据2013年以后的研究成果,但对于一些快速发展的领域,目前依据尚不足。例如:一些最新描述的影像学特征(如淀粉样蛋白或tau蛋白-PET)没有被纳入到STRIVE-2中。该领域发展迅速,且不同病理常同时存在且可能相互作用,这就强调了需要进行更多的研究探讨疾病病理之间的交互作用。因此,需要进行更多的研究工作发现强有力的证据,以弥合对SVD病理生理学的理解差距。在研究较少的人群和地区进行研究,将能够提供一些具有代表性的信息,可以促进对SVD病理生理更为全面的理解。

附表 脑小血管病神经影像特征的定义及术语表Attached table: Definition and glossary of neuroimaging features of cerebral small vascular disease
