梭鱼草叶片抗氧化酶、抗坏血酸-谷胱甘肽循环与乙二醛酶系统对铅胁迫的响应
2023-11-14辛建攀马思思田如男
辛建攀,马思思,田如男
(南京林业大学 风景园林学院,南京 210037)
城镇化进程的不断加快、工农业废水及生活污水的不合理排放等人类活动导致水环境重金属污染问题日益突出。在面向生态文明建设的国家重大需求下,重金属污染环境绿色修复是环境治理与修复领域的技术前沿和重点发展方向[1],而植物修复技术被认为是解决环境重金属污染问题的一种有前途的绿色技术。近年来,越来越多的观赏植物如芦竹(Arundodonax)[2]、马蔺(Irislacteavar.chinensis)[3]和美人蕉(Cannaindica)[4]已经成为修复植物材料的重要来源。观赏植物在重金属污染水体中生长,不但能够美化环境,而且还可以富集重金属,有利于实现“边修复、边美化”的双重目标。
梭鱼草(Pontderiacordata)是一种多年生大型湿地观赏植物,地下根状茎粗壮、根系发达、生物量大;顶生穗状花序,小花蓝紫色,具有较高的园林观赏价值。本课题组前期研究表明,该植物是一种重金属耐性植物,能够将多数重金属离子固定在根系,可作为重金属污染湿地修复的候选植物材料[5-6]。与根系相比,植物叶片对重金属胁迫更为敏感[7]。研究表明,重金属胁迫能够降低植物叶片面积与厚度,同时诱导叶片细胞中过量积累活性氧自由基(ROS),加剧膜质过氧化作用,妨碍叶绿素生物合成,使叶片出现褪绿、枯萎等毒害症状[5-6,8-9],这会在一定程度上降低湿地植物的园林观赏价值。同时,叶片生理代谢活动受阻也会妨碍湿地植物根系对金属离子的吸收和转运[6]。因此,了解湿地植物叶片对重金属胁迫的耐性机制对于重金属污染水体的植物修复和景观重建具有重要意义。
为了缓解ROS引起的氧化损伤,植物进化出了一套抗氧化防御系统。其中,酶类抗氧化系统主要由超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等组成。非酶类抗氧化系统主要有抗坏血酸(AsA)、类胡萝卜素(Car)、谷胱甘肽(GSH)及植物螯合肽(PCs)等。在重金属胁迫条件下,这些物质直接或间接参与植物叶片细胞中ROS的清除,并能够改善植物叶片细胞生理功能,从而增强植物叶片抗逆能力[10-11]。甲基乙二醛(MG)是植物光合作用、糖酵解、脂质过氧化及蛋白质糖基化的副产物,具有细胞毒性,通过氧化胁迫以破坏细胞超微结构[12-13]。乙二醛酶系统是植物体内重要的脱毒系统之一,主要由乙二醛酶Ⅰ(Gly I)和乙二醛酶Ⅱ(Gly Ⅱ)组成,不但能够有效清除MG,而且可以调控GSH再生,维持细胞氧化还原平衡,在植物适应重金属胁迫中具有关键作用[14]。因此,本研究以梭鱼草为试验材料,分析铅(Pb2+)胁迫下梭鱼草叶片丙二醛含量、抗氧化酶活性、抗氧化剂含量及乙二醛酶系统活性的变化规律,以明确其叶片细胞应对Pb2+胁迫的生理机制,从而为重金属污染湿地的“边修复、边美化”治理提供理论基础。
1 材料和方法
1.1 供试材料与处理
试验在南京林业大学国家级园林实验教学示范中心温室内完成。于5月份选取长势一致、生长状况良好的梭鱼草植株(株高40~50 cm),清洗干净后于2 L 1/2 Hoagland营养液的塑料桶中进行为期7 d的适应性培养,期间实时补充营养液至初始体积。待适应性培养结束后,将植株转移至Pb2+浓度为0(CK),5.0,10.0,15.0 mg/L的1/2 Hoagland营养液中,每5 d对其进行更换。每一浓度水平各处理12株,重复3次。标记处理前为第0 天,并于第14,21 天时取叶片鲜样用于测定各项生理指标。
1.2 测定指标与方法
1.2.1 丙二醛和叶绿素含量
丙二醛(MDA)含量参照郝建军等[15]的方法测定;叶绿素含量参照李合生[16]的方法测定。
1.2.2 抗氧化酶活性
取0.3 g新鲜叶片于50 mmol/L预冷的磷酸缓冲液(PBS)(pH 7.8,含1%的PVP)中研磨成匀浆,在4 ℃、12 000g下离心20 min,上清液即为待测酶液。超氧化物歧化酶(SOD)活性参照王晶英等[17]的方法测定,过氧化氢酶(CAT)活性参照陈建军等[18]的方法测定。
另取0.3 g新鲜叶片置于50 mmol/L Tris-HCl[pH 7.0,含20%(W/V)甘油、1.0 mmol/L 抗坏血酸(ASA)、1.0 mmol/L DTT、1.0 mmol/L乙二胺四乙酸、1.0 mmol/L 还原型谷胱甘肽(GSH)、5.0 mmol/L MgCl2]提取液中,冰浴研磨,以4 ℃、10 000g离心20 min[19],上清液即为待测酶液。抗坏血酸过氧化物酶(APX)活性的测定参照Nakano等[20]的方法并略作修改;脱氢抗坏血酸还原酶(DHAR)活性的测定参照Nakano等[15]的方法;谷胱甘肽还原酶(GR)活性的测定参照Halliwell等[21]的方法。
1.2.3 非酶抗氧化剂含量
非蛋白巯基总肽(NPT)含量的测定参照Rama等[22]的方法,GSH含量的测定参照陈建勋和王晓峰[18]的方法,植物螯合肽(PCs)含量为NPT含量与GSH含量的差值[23];AsA含量的测定参照Kampfenkel等[24]的方法,脱氢抗坏血酸(DHA)含量为总AsA含量与AsA含量的差值。
1.2.4 乙二醛酶系统活性
甲基乙二醛(MG)含量的测定参照Wild等[25]的方法;乙二醛酶I(GlyI)活性的测定参照Hossain等[26]的方法;乙二醛酶Ⅱ(GlyⅡ)活性的测定参照Principato等[27]的方法。
1.3 数据处理
使用XLSX 2020软件(WPS office,China)进行数据处理和制图;采用SPSS 19.0软件对数据进行方差分析,用LSD法和Duncan法进行多重比较。
2 结果与分析
2.1 铅胁迫对梭鱼草叶片MDA和叶绿素含量的影响
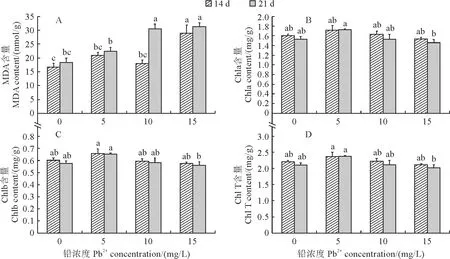
图1,A显示,在胁迫处理第14天时,与对照(0 mg/L Pb2+)相比,梭鱼草叶片MDA含量在5.0,10.0 mg/L Pb2+处理下均无显著变化,仅在15.0 mg/L Pb2+处理下显著增加73.78%;在处理第21天时,与对照相比,梭鱼草叶片MDA含量在5.0 mg/L Pb2+处理下也无显著变化,在10.0,15.0 mg/L Pb2+处理下分别显著增加65.65%和69.64%。然而,第21天梭鱼草叶片MDA含量仅在10 mg/L Pb2+处理下显著高于第14 天。
不同小写字母表示处理浓度及时间之间在0.05水平有显著差异。下同。
同时,如图1,B-D所示,梭鱼草叶片叶绿素a(Chl a)、叶绿素b(Chl b)和总叶绿素(Chl T)含量在胁迫处理第14天和第21天时均随着Pb2+胁迫浓度的增加先升后降,并均在5.0 mg/L Pb2+处理时达到最大值。其中,在处理第14天时,叶绿素含量在各胁迫处理间及其与同期对照间均无显著差异;在处理第21天时,Chl a、Chl b和Chl T含量在各胁迫处理下仍与同期对照无显著差异,但在15.0 mg/L Pb2+处理下均显著低于5.0 mg/L Pb2+处理。另外,在相同浓度Pb2+处理下,叶绿素含量在第14天与第21天之间均无显著差异。以上结果说明,梭鱼草叶片对5 mg/L Pb2+处理具有较强的耐受性,而当Pb2+浓度继续增加时,梭鱼草叶片会表现出明显的毒害作用。
2.2 铅胁迫对梭鱼草叶片抗氧化酶活性的影响
首先,图2,A、D、F显示,在第14 天时,与对照相比,梭鱼草叶片CAT、APX和DHAR活性在各浓度铅胁迫处理下均无显著变化;在处理第21 天时,与对照相比,梭鱼草叶片CAT和APX活性在5.0,10.0 mg/L Pb2+处理下仍无显著变化,CAT活性在15.0 mg/L Pb2+处理下显著下降31.75%,而其APX活性此时显著增加1.19倍;叶片DHAR活性在各浓度铅胁迫处理下均比对照显著下降。在相同浓度Pb2+处理下,叶片CAT、APX活性在第14 天与第21 天之间均无显著差异,而其DHAR活性在处理第21 天比第14天显著下降31.15%~62.29%。
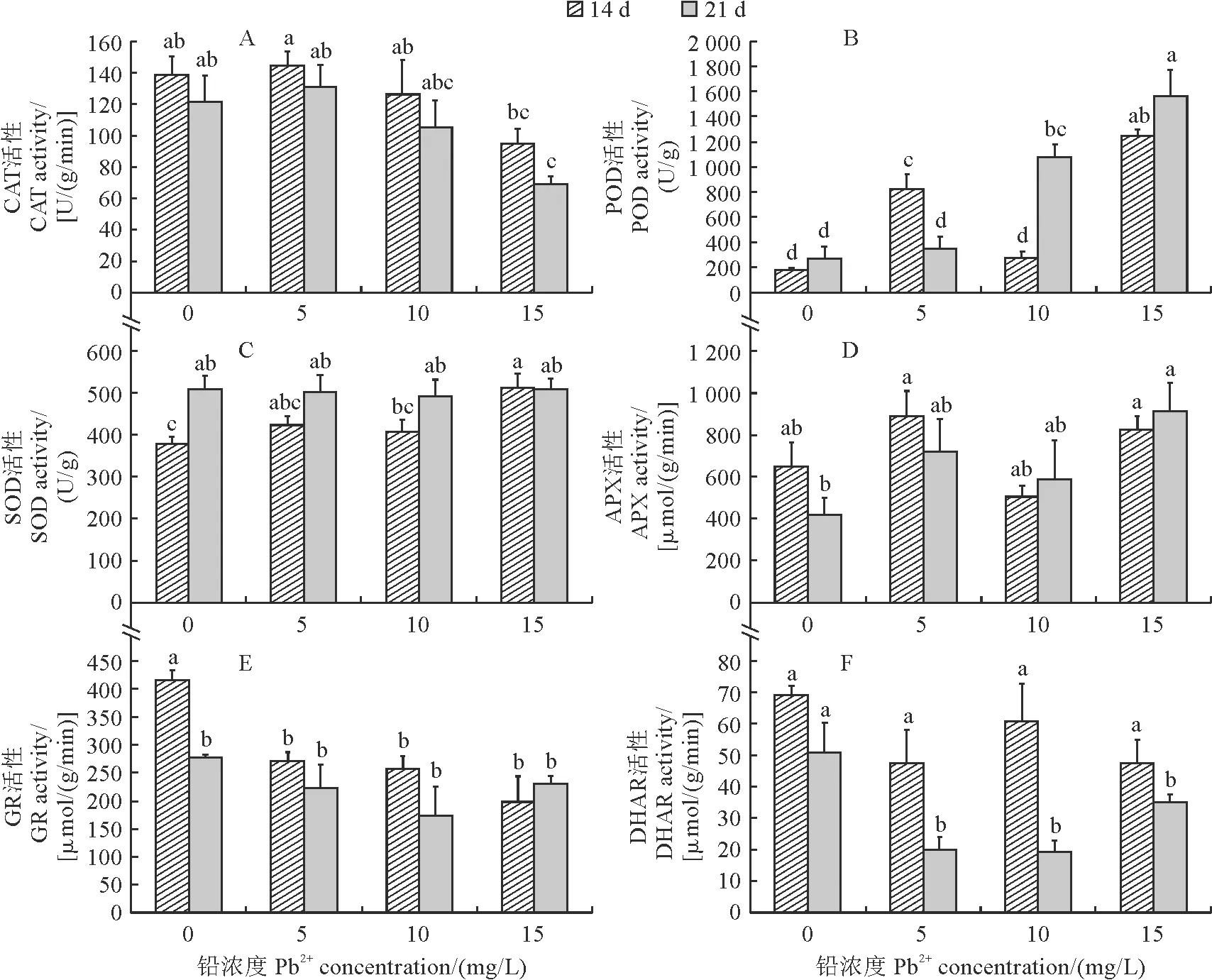
图2 不同浓度Pb2+处理下梭鱼草叶片抗氧化酶活性的变化
其次,图2,B,C显示,在胁迫处理第14 天时,梭鱼草叶片POD和SOD活性均比对照不同程度提高,并均在15.0 mg/L Pb2+处理时达到最大值,且与对照和其他处理差异显著,但在5.0,10.0 mg/L Pb2+处理之间均无显著差异。在胁迫处理第21 天时,梭鱼草叶片POD和SOD活性均随处理浓度增加呈逐渐上升趋势,并在15.0 mg/L Pb2+处理下达到最大值;SOD活性在各处理及对照间均无显著差异,叶片POD活性在5.0 mg/L Pb2+处理下与对照无显著差异,在10.0,15.0 mg/L Pb2+处理下比对照分别显著增加3.03,4.85倍。在相同浓度Pb2+处理下,各浓度处理SOD活性在第14天与第21天之间均无显著差异(对照除外);与第14天相比,第21天的POD活性在5.0 mg/L Pb2+处理下显著下降58.01%,而在10 mg/L Pb2+处理显著增加2.94倍,在其余处理下无显著差异。
此外,图2,E显示,在胁迫处理第14 天时,梭鱼草叶片GR活性随着胁迫浓度呈下降趋势,并在15.0 mg/L Pb2+处理下达到最小值,而在5.0,10.0,15.0 mg/L 3个Pb2+处理之间均无显著差异,但三者均比对照显著降低;在胁迫处理第21天时,各浓度Pb2+处理下梭鱼草叶片GR活性均与对照相比无显著差异。在相同浓度Pb2+处理下,梭鱼草叶片GR活性在第14天与第21天之间无显著差异(对照除外)。以上结果说明,高浓度(15.0 mg/L)Pb2+处理下,POD、SOD、APX在缓解梭鱼草叶片细胞氧化损伤中发挥了重要作用。
2.3 铅胁迫对梭鱼草叶片抗氧化物质含量的影响
首先,图3,A、E显示,随着铅胁迫浓度的增加,梭鱼草叶片AsA和PCs含量均呈逐渐上升趋势,并均在15.0 mg/L Pb2+处理下达到最大值。其中,在胁迫处理第14天和第21天时,叶片AsA和PCs含量在5.0,10.0 mg/L Pb2+处理下均与对照之间均无显著差异,AsA含量在15.0 mg/L Pb2+处理下分别比对照显著增加145.81%和161.00%,PCs含量则分别显著增加135.08%和456.13%;在相同浓度Pb2+处理下,AsA含量在处理第14天与第21天之间均无显著差异,PCs含量在15.0 mg/L Pb2+处理第21天时比第14天显著增加62.21%,在其余浓度处理下两时期间无显著差异。
同时,从图3,C、D来看,在处理第14 天时,叶片GSH和NPT含量在5.0,10.0 mg/L Pb2+处理下与对照之间均无显著差异,在15.0 mg/L Pb2+处理下分别比对照显著增加73.89%、92.48%;在胁迫处理第21 天时,梭鱼草叶片GSH、NPT含量在5.0 mg/L Pb2+处理下仍与对照之间均无显著差异,在10.0,15.0mg/L Pb2+处理下均比对照显著增加;在相同浓度Pb2+处理下,第21天叶片GSH、NPT含量仅在15.0 mg/L Pb2+处理时比第14 天显著增加,增幅分别为32.51%和43.53%。
另外,由图3,B可知,在胁迫处理第14天时,梭鱼草叶片DHA含量随着Pb2+浓度的增加先降后升,并在10.0 mg/L Pb2+处理下达到最小值,但各胁迫浓度间均无显著差异,且仅10.0 mg/L Pb2+处理与对照有显著差异,降幅为33.68%;在胁迫处理第21天时,梭鱼草叶片DHA含量随着胁迫浓度增加呈逐渐下降趋势,但各浓度处理均与对照之间均无显著差异;在相同浓度Pb2+处理下,梭鱼草叶片DHA含量在第14天与第21天之间均无显著差异。以上结果说明,梭鱼草叶片AsA和非蛋白巯基在其应对高浓度Pb2+胁迫中发挥了重要的解毒作用。
2.4 铅胁迫对梭鱼草叶片MG含量及Gly Ⅰ、Gly Ⅱ活性的影响
首先,图4,A显示,在胁迫处理第14天时,梭鱼草叶片MG含量在5.0,10.0,15.0 mg/L Pb2+处理下均与对照无显著差异;在胁迫处理第21天时,梭鱼草叶片MG含量随着胁迫浓度增加呈逐渐上升趋势,并在15.0 mg/L Pb2+处理下达到最大值,各处理比对照显著增加31.41%~71.73%;在相同浓度Pb2+处理下,各浓度Pb2+处理第21 天时叶片MG含量均比第14天显著增加,增幅在74.99%~78.07%之间。
其次,从图4,B可知,在胁迫处理第14天和第21天时,与对照相比,梭鱼草叶片GlyI活性在5.0,10.0 mg/L Pb2+处理下均无显著变化,在15.0 mg/L Pb2+处理下分别比对照显著增加135.38%和117.91%;在相同浓度Pb2+处理下,GlyI活性在第14天与第21天之间均无显著差异。
另外,从图4,C来看,在胁迫处理第14 天时,梭鱼草叶片GlyⅡ活性先降后升,在5.0,10.0 mg/L Pb2+处理下分别比对照显著降低38.91%和58.82%,在15.0 mg/L Pb2+处理下与对照无显著差异;在胁迫处理第21天时,各浓度Pb2+处理下梭鱼草叶片GlyⅡ活性均显著低于对照,但各浓度Pb2+处理之间均无显著差异;在相同浓度Pb2+处理下,GlyⅡ活性在第14天与第21天之间均无显著差异。以上结果说明,梭鱼草叶片乙二醛酶系统无法缓解高浓度Pb2+胁迫诱发的羰基胁迫。
3 讨 论
本研究中,在5.0 mg/L Pb2+处理第14天和第21天时,梭鱼草叶片MDA、叶绿素和非酶抗氧化剂含量及抗氧化酶活性均无显著变化,在较低浓度重金属处理下的玉蝉花(Irisensata)[23]和鱼腥草(Houttuyniacasdata)[29]上也得到了相似结果。此时,梭鱼草植株可以正常生长,且叶片形态基本正常,意味着梭鱼草叶片细胞中Pb2+并未过量积累。这可能是因为多数Pb2+被固定在根系,抑制了Pb2+由根系向叶片的转运[30]。同时,也有研究认为,当介质中Pb2+浓度较低时,多数Pb2+被固定于叶片细胞壁和液泡中,这将有利于降低细胞器中自由态Pb2+浓度,从而避免Pb2+胁迫诱导的ROS过量积累[31]。
作为一种非营养型金属离子,Pb2+在植物细胞中过量积累会诱发细胞膜中不饱和脂肪酸的脂质过氧化,导致MDA大量积累。MDA是表征逆境条件下植物受害程度的重要指标,其含量高低反映了细胞膜脂的过氧化程度。在本研究中,15.0 mg/L Pb2+处理使梭鱼草叶片MDA含量显著增加,与重金属胁迫下卷毛委陵菜(Potentillasericea)[32]和多年生黑麦草(Loliumperenne)[33]叶片中MDA含量的变化规律相一致,表明此时梭鱼草叶片细胞脂膜结构与功能已受到较严重破坏,从而会妨碍其正常的生理代谢活动。另外,有研究表明,重金属胁迫诱导的膜脂过氧化作用会降低植物叶绿素含量[34],这在本研究中也到了证明。本研究发现,15.0 mg/L Pb2+处理第21 天时梭鱼草叶片Chl a含量显著下降。相似结果在重金属胁迫下的烟草(Nicotianatabacum)[35]和草地早熟禾(Poapratensis)[36]等多种植物中也有报道。这可能是因为Pb2+一方面能够取代叶绿体中Mg2+、Mn2+等离子,从而抑制叶绿素生物合成过程[37];另一方面Pb2+能直接诱导光合色素降解,破坏叶绿体结构[38]。
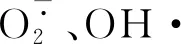
乙二醛酶系统主要由Gly Ⅰ、Gly Ⅱ组成,两者共同催化MG解毒。MG是一种细胞毒性化合物,重金属胁迫能够诱发细胞MG过量积累,产生羰基胁迫,从而导致蛋白质和核酸等生物大分子受损,加速脂质过氧化作用[46]。研究表明,植物在逆境条件下可以通过上调Gly Ⅰ、Gly Ⅱ活性以提高MG的解毒能力[47]。本研究中,不同浓度Pb2+处理第21 天时,梭鱼草叶片细胞MG含量明显增加,这与重金属胁迫下番茄的表现[48]相似,这意味着此时梭鱼草叶片细胞遭受了过量Pb2+诱发的氧化胁迫,可由MDA含量的增加得到印证;同时,虽然15.0 mg/L Pb2+处理至第21 天时Gly Ⅰ活性显著增加,但是Gly Ⅱ活性却明显下降。这种结果在重金属胁迫下的菜心(Brassicaparachinensis)[49]上也得到了证实,表明乙二醛酶系统此时已经不能有效减缓羰基胁迫诱导的脂质过氧化作用。
4 结 论
在低浓度(5.0 mg/L)Pb2+处理下,梭鱼草表现出良好的铅胁迫耐受性,叶片细胞未发生明显膜脂过氧化,叶绿素含量与抗氧化系统活性相对稳定。在较高浓度Pb2+胁迫处理下,梭鱼草叶片细胞抗氧化酶(POD、SOD、APX)活性被激活,抗氧化剂(AsA)与非蛋白巯基化合物(GSH、PCs和NPT)大量合成以螯合细胞中过量Pb2+,在减缓叶片细胞氧化损伤中发挥了重要的解毒作用,而此时Gly I与Gly Ⅱ活性无法协调以完成对MG的解毒作用。
