梭鱼TLR18基因克隆及表达分析
2020-10-05王思思张启焕邢晓平王资生齐志涛
王思思,徐 杨,张启焕,邢晓平,王资生,高 谦,齐志涛
(1.江苏科技大学生物技术学院,镇江 212003;2.盐城工学院海洋与生物工程学院,江苏盐城 224051;3.上海海洋大学水产与生命学院,上海 201306)
Toll样受体(Toll like receptor,TLRs)是机体重要的模式识别受体(pattern recognition receptors,PRRs),能够识别多种病原相关分子模式(pathogen associated molecular pattern,PAMPs),并通过下游信号通路激活相关基因表达而清除病原微生物[1]。TLRs属于I型跨膜蛋白家族,含有3个保守的结构域,分别为胞外N端亮氨酸重复结构域(leucine rich repeat,LRR)、跨膜区、胞内Toll/白细胞介素 1受体结构域(Toll/interleukin 1 receptor,TIR)。LRR结构域主要参与PAMPs识别,而TIR结构域则参与下游信号通路激活[2]。
目前,在哺乳类动物中发现了13个TLRs(TLR1~TLR13)。在低等脊椎动物 鱼类中已经发现了20多个TLRs,包括TRL1、TLR2、TLR3、TLR4、TLR5M、TLR5S、TLR7 9、TLR13、TLR14、TLR18 28[3-4]。根据系统进化树分析可以将脊椎动物的TLRs划分为6个亚家族,分别是TLR1、TLR3、TLR4、TLR5、TLR7和TLR11亚家族。哺乳类TLR1亚家族成员包括TLR1、TLR2、TLR6和TLR10,而鱼类TLR1亚家族包括TLR1、TLR2、TLR18、TLR25、TLR28[5]。
TLR18作为TLR1亚家族成员,目前已经在斑马鱼(Daniorerio)[6]、斑点叉尾鮰(Ictalurus punctatus)[7]、大西 洋鲑(Salmosalar)[8]、草 鱼(Ctenopharyngodonidella)[9]、黄颡鱼(Pelteobagrus fulvidraco)[10]和鲤(Cyprinuscarpio)[11]等研究中得到报道。然而,在鲻科鱼类中尚未见TLR18相关报道。
梭鱼(Lizahaematocheila)为鲻科鱼类代表种之一,已经成为我国沿海地区重要的经济养殖鱼类[12]。随着梭鱼养殖规模的扩大,养殖病害也逐年增多,尤其是细菌性疾病已经成为限制梭鱼养殖的重要因素。停乳链球菌(Streptococcusdysgalactiae)为革兰氏阳性细菌,是多种鱼类的致病菌。前期研究发现梭鱼腹腔注射停乳链球菌后7 d死亡率达到80%以上[13]。然而,目前对梭鱼感染停乳链球菌后免疫反应的研究非常欠缺,极大地限制了采用免疫学方法(如细菌性疫苗)预防梭鱼细菌性疾病的技术发展。本文对梭鱼TLR18进行了基因克隆并采用荧光定量PCR对其在正常组织和细菌感染后组织中的表达模式进行了研究,以期为深入探讨梭鱼乃至整个鲻科鱼类TLRs的功能奠定基础。
1 材料与方法
1.1 梭鱼及细菌感染
健康梭鱼[平均体质量(8±2)g]购自江苏盐城当地养鱼场。在本实验室的循环水养殖系统中暂养一周[水温:(28±2)℃;光照周期:12D/12L,饲喂:2次·d-1]之后,采用MS 222处理,解剖5尾鱼,各取8个不同组织(鳃、皮肤、肌肉、肝、脾、头肾、肠、脑)。
停乳链球菌由中国科学院水生生物研究所李爱华研究员提供[14],在本实验室培养后离心收集并计数,用PBS调整细菌浓度备用。20尾梭鱼随机平均分为试验组和对照组,试验组腹腔注射4×105cfu停乳链球菌(100μL)[15],对照组注射等量PBS。在注射12 h和24 h后,分别从对照组和试验组随机解剖5尾鱼,各取8个不同组织(鳃、皮肤、肌肉、肝、脾、头肾、肠、脑)。采集的组织样品立即在液氮中冷冻,然后在-80℃超低温冰箱中保存备用。
1.2 RNA提取与cDNA合成
采用Trizol试剂盒提取各个组织总RNA(Invitrogen,USA)。采用SMARTTMRACE cDNA Amplification Kit(Clontech,USA)合成SMART cDNA。采用Revert AidTMFirst Strand cDNA Synthesis Kit(Fermentas)合成cDNA第一链。
1.3 梭鱼TLR18全长序列的扩增
梭鱼TLR18部分cDNA序列来自梭鱼脾脏转录组[12]。根据梭鱼TLR18部分序列设计特异性引物进行序列验证后,采用RACE PCR方法获得梭鱼TLR18cDNA全长。所用引物序列见表1。
1.4 序列分析
采用ExPASy网站中的Translate软件对梭鱼TLR18氨基酸序列进行推导[16]。采用SMART(simplemodular architecture research tool)软件对TLR18的跨膜区、LRR结构域、TIR结构域进行预测[17]。采用ExPASy网站中的pI/Mw工具对梭鱼TLR18蛋白质分子量和等电点进行预测。序列相似性采用DNAStar软件包中的MegAlign进行计算。采用MEGA 6.0软件中的邻接法(neighbor joining,N J)构建系统进化树,所用的模 型 为Jones Taylor Thornton(JTT)模 型,bootstrap设置为10 000[18]。
1.5 梭鱼TLR18的表达分析
分别根据梭鱼TLR18和βactin(内参基因)[15]cDNA序列采用Primer premier6.0软件设计荧光定量PCR引物(表1)。qPCR反应体系:SYBR Premix 5μL,上 下 游 引 物(浓 度 为10 μmol·L-1)各0.5μL,模板3μL,ddH2O 1μL。反应条件:95°C预变性30 s,一步法扩增40个循环,95℃变性10 s,60℃退火10 s,72℃延伸10 s,循环结束后,绘制熔解曲线。每个组织样品重复3次。采用2-ΔΔCT方法分析TLR18在正常组织和细菌感染后组织表达情况[19]。利用SPSS 18.0软件中单因素方差分析进行数据统计分析(显著性水平设为P<0.05),利用Graphpad进行多重比较和作图。
2 结果与分析
2.1 梭鱼TLR18基因序列分析
梭鱼TLR18cDNA全长为2 753 bp(GenBank登录号:MT254067),其中5′非编码区长34 bp,3′非编码区长97 bp,开放阅读框全长2 622 bp,编码873个氨基酸(aa)。p I/Mw软件预测显示梭鱼TLR18的理论分子量为100.59 kD,理论等电点为8.47。SignalP 3.0软件预测显示梭鱼TLR18含有一个长度为17个氨基酸的信号肽序列。SMART软件预测显示梭鱼含有6个LRR、1个LRR CT、1个跨膜区和1个TIR结构域(图1,图2)。在LRR CT结构域中含有4个保守的半胱氨酸。TIR结构域含有2个保守的基序,分别是LC RD (A/P)G和FWXRLR。梭鱼TLR18与其他鱼类TLR18具有较高的序列相似性(57.4%~68.8%),其中与大西洋鲑TLR18序列相似性最高(68.8%)(表2)。
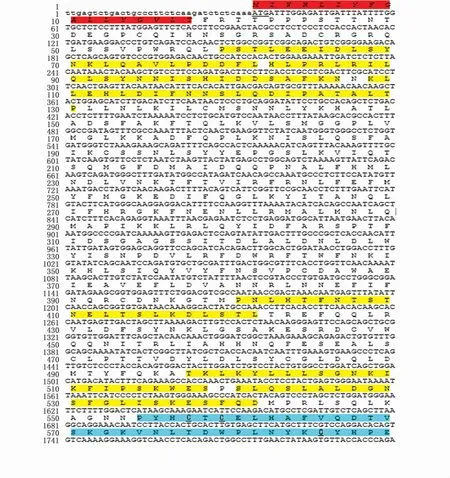
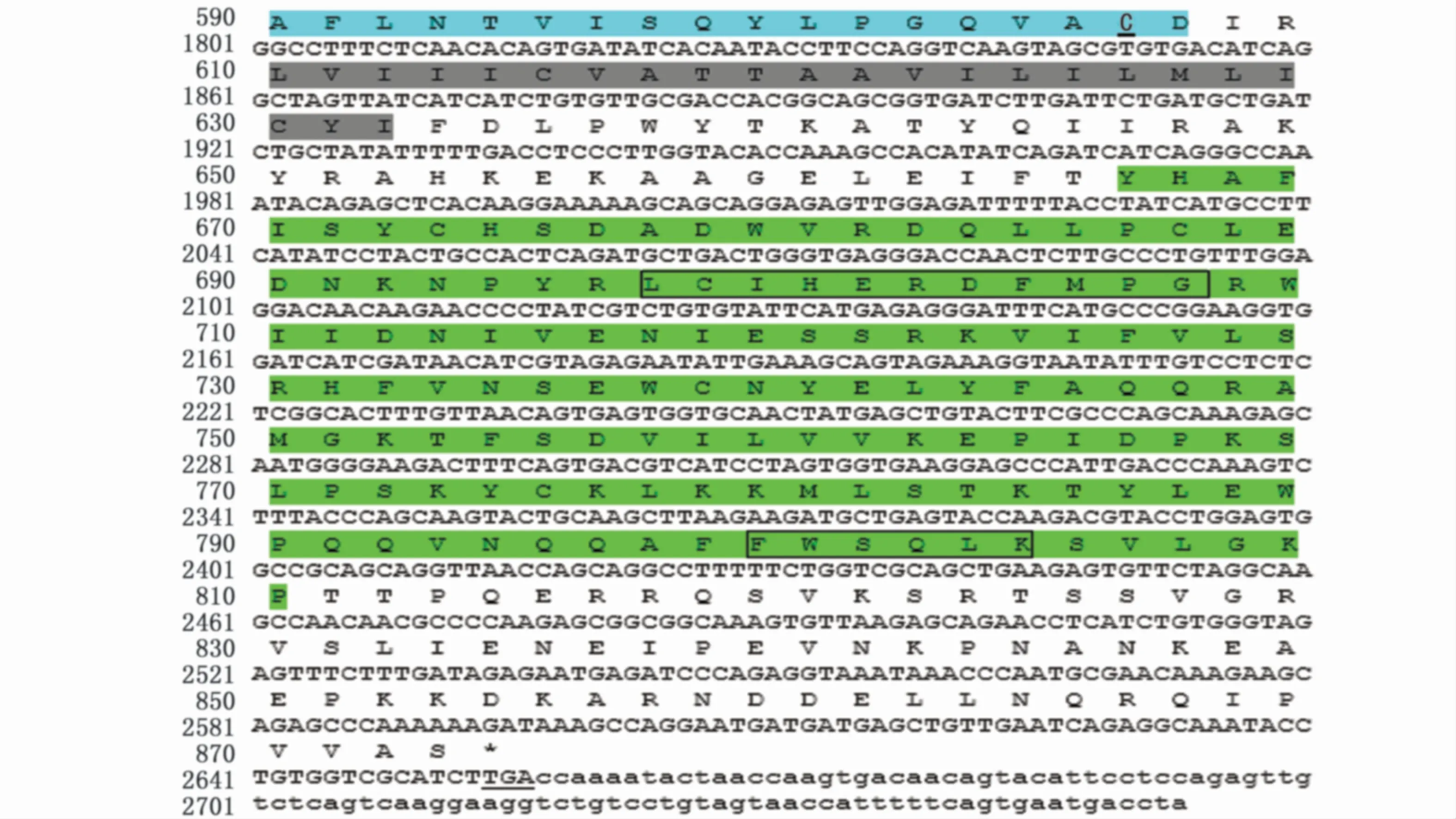
图1 梭鱼TLR18 cDNA及其氨基酸序列Fig.1 Nucleotide and putative am ino acid sequences of Liza haematocheila TLR18

表2 梭鱼TLR18与其他鱼类TLR18序列相似性分析Tab.2 Com parison of TLR18 sequence identity between Liza haematocheila and other teleosts
2.2 系统进化树分析
采用MEGA 6.0软件构建了系统进化树(图3),结果显示鱼类TLR18聚为一枝,该枝进一步分为两个小的进化枝,其中一枝包含草鱼TLR18、团头鲂(Megalobramaamblycephala)TLR18、鲤TLR18、斑马鱼TLR18和斑点叉尾鮰TLR18,另外一枝包括梭鱼TLR18和大西洋鲑TLR18。
2.3 梭鱼TLR18在正常组织中表达分析
采用荧光定量PCR方法检测了TLR18在健康梭鱼8个组织(鳃、皮肤、肌肉、肝、脾、头肾、肠、脑)中的表达情况,结果显示梭鱼TLR18呈组成型表达,在所选择的8个组织中均有表达,其中在头肾、脾脏和肝脏中表达量较高,而在鳃和肠中表达量较低(图4)。
2.4 梭鱼TLR18在细菌感染后不同组织的表达分析
采用荧光定量PCR方法检测了TLR18在停乳链球菌感染12 h和24 h后表达变化情况。结果显示,在停乳链球菌感染12 h后,梭鱼TLR18在除鳃以外的其他组织中均呈显著下调表达(P<0.05);在停乳链球菌感染24 h,梭鱼TLR18在除脾脏以外的组织中呈显著上调表达(P<0.05)(图5)。
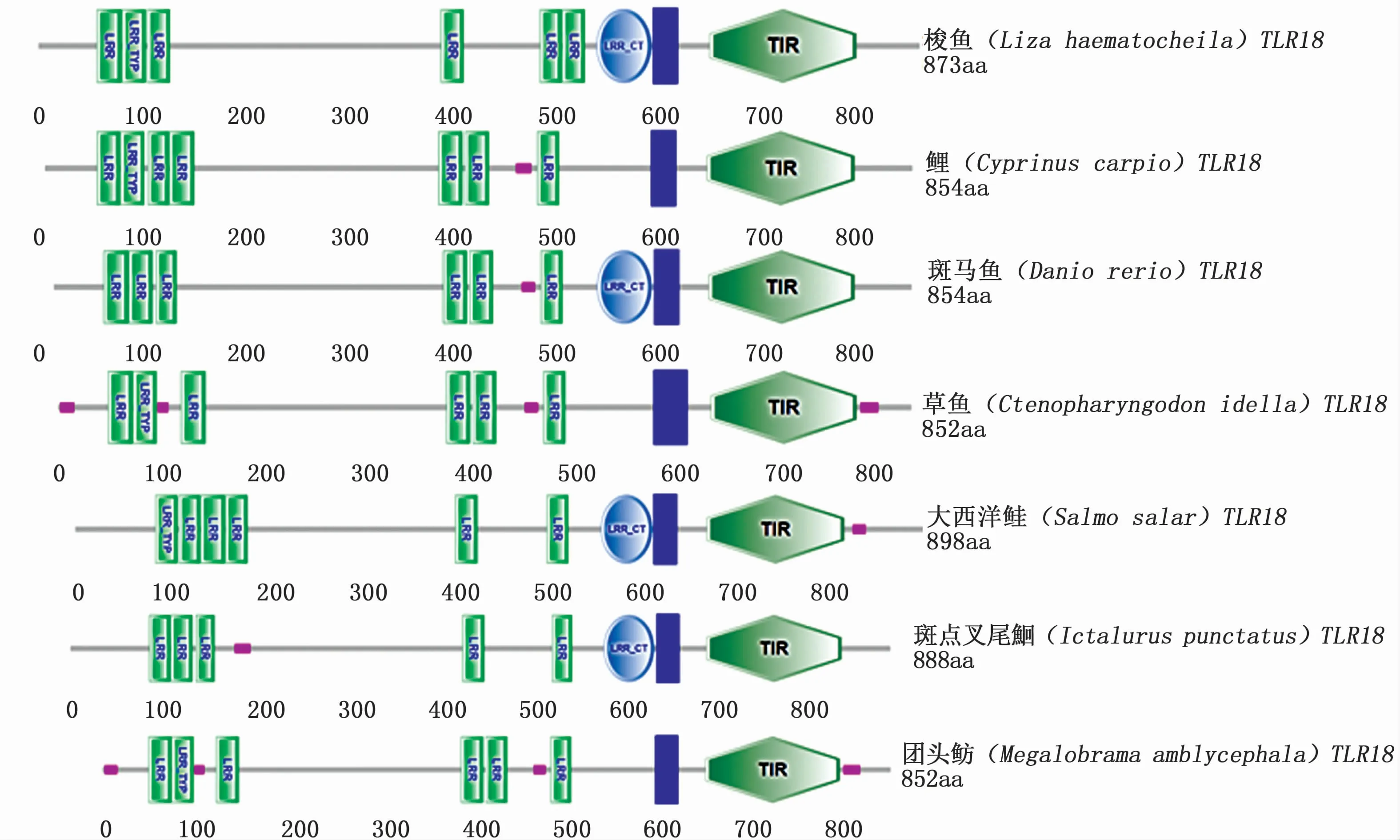
图2 部分鱼类TLR18结构域分析Fig.2 Protein domain analysis of fish TLR18
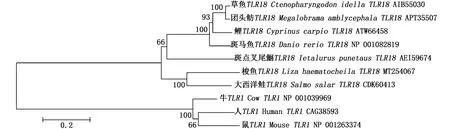
图3 鱼类TLR18系统进化树分析Fig.3 Phylogenetic tree analysis of fish TLR18
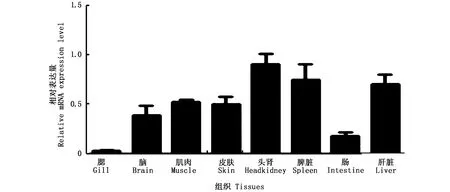
图4 梭鱼TLR18在正常组织中的表达Fig.4 Expression analysis of TLR18 in normal tissues of Liza haematocheila
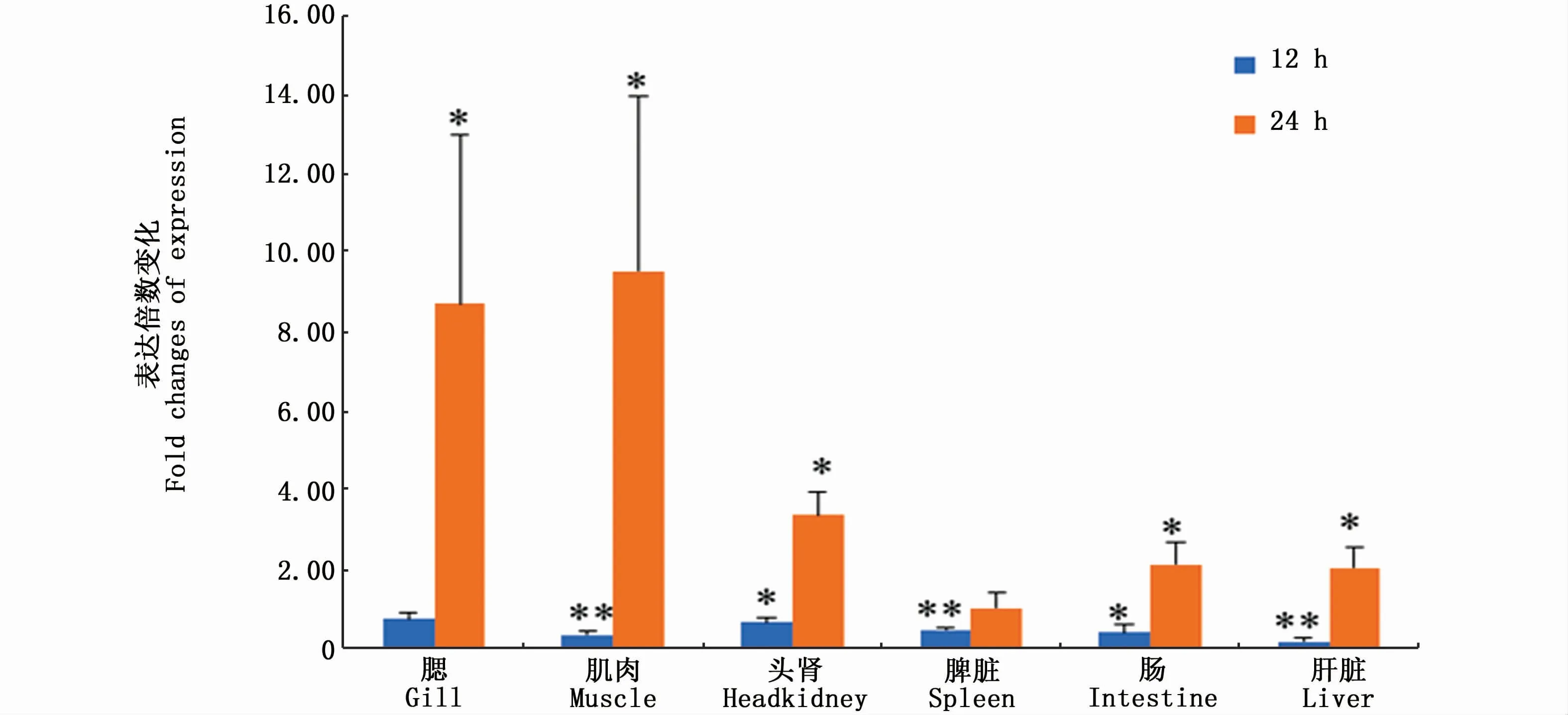
图5 梭鱼TLR18在停乳链球菌感染后表达变化Fig.5 Expression of TLR18 in tissues of Liza haematocheila follow ing Streptococcus dysgalactiae infection
3 讨论
TLR18是TLR1亚家族成员,目前仅在少数鱼类中得到克隆和鉴定。本文首次对鲻科鱼类代表种 梭鱼的TLR18进行了克隆和表达分析。梭鱼TLR18编码873个氨基酸,与其他鱼类TLR18具有相似长度的氨基酸序列(852 aa~898 aa)(图2)。同时,梭鱼TLR18与其他鱼类TLR18具有较高的序列相似性(表2),且系统进化树分析显示其与其他鱼类TLR18聚为一枝(枝值达到了100%)(图3)。SMART分析显示梭鱼TLR18含有TLRs家族典型结构域,包括6个LRRs、1个LRR CT、1个跨膜区和1个TIR结构域(图1~图2)。LRRs结构域的序列和数量决定了TLRs对不同PAMPs的识别特性[20]。梭鱼TLR18与其他鱼类TLR18具有类似的LRRs结构域数量,如斑马鱼和大西洋鲑的TLR18均含有6个LRRs和1个LRR CT结构域(图2),提示梭鱼TLR18与其他鱼类TLR18具有相似的功能。与其他鱼类TLR18相一致,梭鱼TLR18也含有一个跨膜区,提示梭鱼TLR18可能在细胞膜上发挥功能。梭鱼TLR18的LRR CT结构域中含有4个保守的半胱氨酸,发挥稳定TLR18结构的作用。TIR结构域参与TLRs的信号转导[21]。在梭鱼TLR18的TIR结构域中含有LC RD (A/P)G和FWXRLR两个保守基序,其中LC RD (A/P)G基序主要参与TLRs的信号转导,而FWXRLR基序则参与TLRs的细胞定位功能[21]。
梭鱼TLR18呈组成型表达,在健康梭鱼的不同组织中均有表达,这与其他鱼类TLR18的表达模式一致[7-11]。但是,不同鱼类TLR18在不同的组织中表达水平不尽相同。斑点叉尾鮰TLR18在鳃和后肾中表达较高[7];大西洋鲑TLR18在肌肉和肝脏中高表达[8];草鱼TLR18在脾脏、鳃和心 脏 中 高 表 达[9]。黄 颡 鱼(Pelteobagrus fulvidraco)TLR18在脾脏和头肾中高表达[10];鲤TLR18则在皮肤和脾脏中高表达[11];梭鱼TLR18在头肾、脾脏和肝脏中高表达(图4)。这些研究表明鱼类TLR18在正常组织中的表达具有种属特异性和组织特异性。
在病原微生物感染或PAMPs刺激后,不同鱼类的TLR18表达变化不尽相同。斑马鱼TLR18在分支杆菌Mycobacterium marinum感染后呈显著上调表达[6]。大西洋鲑TLR18在鲑鱼传染性贫血病毒(infectious salmon anaemia virus,ISAV)感染后无显著表达变化[8]。草鱼TLR18在灭活嗜水气单胞菌(Aeromonashydrophila)感染后在头肾、皮肤、肠中显著上调表达,在脾脏中呈显著下调表达,而在肝脏中无明显变化[9]。黄颡鱼TLR18在嗜水气单胞菌感染后6 h在脾脏中呈下调表达,48 h~72 h在脾脏中呈上调表达,6 h~48 h在头肾中呈上调表达[10]。本文发现梭鱼TLR18在停乳链球菌感染后12 h在肌肉、头肾、肝脏、脾脏和肠中呈显著下调表达;24 h则在鳃、肌肉、头肾、肠和肝脏中呈显著上调表达(图5)。上述研究提示TLR18可能参与了鱼类针对细菌的免疫反应。
综上所述,本文克隆获得了梭鱼TLR18基因cDNA序列全长,其蛋白结构含有典型的TLRs家族结构域。梭鱼TLR18在正常组织中呈组成型表达,并在停乳链球菌感染后呈显著诱导表达,表明TLR18基因在梭鱼细菌免疫反应过程中发挥重要作用,其具体识别机制和抗菌机制有待进一步研究。
