桃儿七种子休眠解除过程中细胞壁代谢及种皮超微结构的变化
2023-11-14久西加陈红刚王惠珍曾翠云
久西加,陈红刚,2,王惠珍,2,曾翠云,2,杜 弢,2*
(1 甘肃中医药大学 和政药用植物园,甘肃 和政,731200;2 西北中藏药协同创新中心,兰州,730000)
桃儿七[Sinopodophyllumhexandrum(Royle)Ying]为小檗科(Berberidaceae)桃儿七属(SinopodophyllumYing)多年生草本植物,传统医学认为其果实及根茎均能入药,具有调经活血、祛风除湿的作用[1]。药理学研究表明桃儿七中含有的木脂素类成分鬼臼毒素及其衍生物具有明显的抗肿瘤活性,可用于肺癌、肝癌、疣状癌及尖锐湿疣等的治疗[2],且以其衍生物制成的依托泊苷(VP-16)和替尼泊苷(VM-26)已在临床上广泛应用[3-4]。但是由于桃儿七种子所具有的休眠特性及市场需求的进一步增加已导致其野生资源匮乏,目前被列为国家二级保护植物[5]。
种子休眠是制约桃儿七规模化生产的主要障碍,目前已有学者围绕桃儿七种子休眠原因进行了一系列研究,认为桃儿七种子中的厚壁胚乳及内源抑制物是其休眠产生的主要原因[6],且已有证据表明具有厚壁胚乳的种子通常伴随着胚乳弱化才能完成萌发,如莴苣种子胚乳细胞壁剧烈加厚,只有吸涨后细胞壁持续松弛,胚乳机械强度降低,才能最终完成萌发[7]。通常认为细胞壁的松弛有两种机制,一是酶促机制,即多个细胞壁降解酶的共同作用,二是非酶促机制,包括扩张蛋白及活性氧等[8-9],细胞壁降解酶作用于细胞壁中的纤维素、半纤维素、果胶、木质素和蛋白质等主要成分,影响细胞壁的刚性结构和机械强度,进而影响种子的休眠和萌发[10]。研究表明,经赤霉素处理的黄精种子内细胞壁降解酶β-甘露聚糖酶、β-半乳糖苷酶和多聚半乳糖醛酸酶活性显著升高,进而导致胚乳细胞壁松弛,机械强度降低,促进萌发[11],而活性氧则可以直接攻击细胞壁多糖,从而导致细胞壁松弛,促进萌发,如使用外源H2O2处理苹果[12]和向日葵[13]的休眠种子时,能有效促进其萌发。
研究表明桃儿七种子在萌发过程中其细胞壁水解酶会上升积累,从而削弱厚壁胚乳对其萌发的阻碍[14];同时,转录组学研究表明,桃儿七种子的萌发也伴随着水解酶基因的高表达[15],但对于层积过程中桃儿七种子内的细胞壁代谢是否与休眠解除存在联系,以及如何对休眠解除发挥作用等尚不明确。因此,本研究通过低温层积解除桃儿七种子休眠,分析休眠解除过程中种子不同部位细胞壁组分及相关代谢酶的变化,同时利用扫描电镜对种皮的超微结构进行观察,以期建立细胞壁代谢与休眠解除的联系,进一步明确低温层积影响桃儿七种子休眠解除的生理因素,更深入探究和理解桃儿七种子休眠机制。
1 材料和方法
1.1 材 料
桃儿七[Sinopodophyllumhexandrum(Royle)Ying]种子于2021年9月采于甘肃中医药大学和政药用植物园(35°15′48″N,103°24′21″E),并由甘肃中医药大学杜弢教授鉴定确认,先经清水浸泡,揉搓后去掉果肉,再过筛剔除瘪粒,自然阴干,置于4 ℃冰箱储存备用。
1.2 仪器及试剂
试验仪器主要包括岛津LC-20A高效液相色谱仪, KH5200B型超声波清洗器(昆山禾创超声仪器有限公司), EX224ZH型电子分析天平(奥豪斯仪器常州有限公司)及BT125D型1/100000电子天平(北京赛多利斯科学仪器有限公司)。试剂对照品对羟基苯甲醛(B20327)、香草醛(100491-201902)和丁香醛(B20302),均购自上海源叶生物科技有限公司,质量分数均大于98%;甲醇(019318)、乙腈(0211128)为色谱纯,均购自北京迈瑞达科技有限公司;娃哈哈纯净水(天水娃哈哈食品有限公司)。
1.3 种子低温层积处理
将河沙洗净过筛(40目),高压灭菌锅灭菌(121 ℃,30 min),铺至距容器底部3~4 cm处,将桃儿七种子装入纱布网袋平铺于河沙之上,再盖河沙至距容器底部6~8 cm处,保证种子处于容器中部,沙子湿度为9%~11%,用保鲜膜封住容器,打孔透气,将容器置于4 ℃冰箱中。在层积处理0,15,30,45,60,75,90 d定期取样,每次取种子30 g,然后置于-80 ℃冰箱保存待测。
1.4 种皮扫描电镜观察
随机取各层积阶段的种子 10 粒,全部观察,挑选其中视野效果好,具代表性种子,借助扫描电镜(SEM)对桃儿七种孔处以及近胚根处种皮纵切面进行观察。(1)取材固定:新鲜组织确定取材部位,尽量减小牵拉、挫伤与挤压等机械损伤,1~3 min内取样,组织块面积不超过 3 mm2,用 PBS 轻轻漂洗掉样本表面污渍,保护好需要扫描的面并做好标记,迅速投入电镜固定液室温固定2 h,再转移至 4 ℃保存。(2)后固定:固定好的样品经 0.1 mol/L 磷酸缓冲液 PB(pH 7.4)漂洗 3 次,每次 15 min;0.1 mol/L磷酸缓冲液 PB(pH 7.4)配制 1%锇酸室温避光固定 1~2 h;0.1 mol/L 磷酸缓冲液 PB(pH 7.4)漂洗 3 次,每次15 min。(3)脱水:组织依次放入 30%、50%、70%、80%、90%、95%、100%、100%酒精,每次15 min,乙酸异戊酯15 min;(4)干燥:将样本放入临界点干燥仪内进行干燥。(5)样本导电处理:将样本紧贴于导电碳膜双面胶上,放入离子溅射仪样品台上进行喷金30 s 左右;(6)扫描电子显微镜下观察采图。
1.5 种子细胞壁组分含量及相关代谢酶活性测定
桃儿七种子纤维素含量、半纤维素含量、果胶含量以及纤维素酶、甘露聚糖酶、木糖苷酶、多聚半乳糖醛缩酶、果胶甲酯酶、苯丙氨酸解氨酶、肉桂醇脱氢酶、超氧化物歧化酶、过氧化物酶、过氧化氢酶活性均采用试剂盒(上海酶联生物科技有限公司)测定,具体操作按试剂盒说明进行。
1.6 木质素单体含量测定
1.6.1 细胞壁组分的分离
将桃儿七种子胚乳及种皮分离并风干,直到含水量恒定,液氮研磨。按如下步骤提取细胞壁组分:向50 mL离心管中添加1.0 g粉末,添加35 mL 50 mmol/L NaCl并超声处理30 min,然后在4 000g下离心样品2 min,去除溶剂,继续分别添加35 mL 80%乙醇、丙酮和甲醇,超声处理30 min,离心并去除溶剂。在50 ℃下通过烘箱干燥材料,直到样品含水量稳定。
1.6.2 样品制备
将提取的干样品取0.2 g悬浮在3 mL,2 mol/L氢氧化钠和0.5 mL硝基苯于50 mL消化管中混合;将样品置于微波消解仪(Multiwave 3000),于170 ℃恒定温度下处理1 h,当温度降至60 ℃时,取出消化管;然后将反应混合物在5 000g下离心2 min,并将顶部的水相转移到50 mL离心管中;再用乙酸乙酯(40 mL×3)萃取,合并有机相,利用氮吹仪(Termovap Sample Concentrator)去除溶剂,样品加入25 mL色谱级甲醇,并过0.22微孔滤膜待测。
1.6.3 对照品溶液的制备
分别精密称定对羟基苯甲醛、香草醛和丁香醛3种对照品各5.15 mg、5.00 mg、2.45 mg,置于 10 mL 量瓶中,加甲醇溶解并定容至刻度,分别得到对照品系列浓度储备液。
1.6.4 色谱条件
采用Agilent 5 TC-C18(2)色谱柱(4.6mm×250mm)。流动相A为含5%乙腈的0.02 mol/L NaH2PO4的水(用H3PO4调节pH至2.9),流动相B为甲醇/乙腈(50%V/50%V)。梯度洗脱,0~5 min,5%~15%B;5~8 min,15%~20%B;8~10 min,20%~25%B;10~12 min,25%~27%B;12~15 min,27%B;15~20 min,27%~30%B;20~25 min,30%~60%B;25~30 min,60%~80%B;30~35 min,80%~100%B;35~45 min,100%B;45~50 min,100%~5%B;50~55 min,5%B。流速为1.0 mL/min,柱温为35 ℃,进样量为90 μL,检测波长为290 nm。
1.6.5 方法学考察
(1)精密度试验:取 1.6.3节混合对照品溶液,按1.6.4节色谱条件检测指纹图谱,连续进样6次,计算峰面积RSD值。计算得到对羟基苯甲醛RSD为0.70%,香草醛RSD为0.50%,丁香醛RSD为0.66%,表明仪器精密度良好。(2)重复性试验:取同一样品,按 1.6.2节制备方法平行制备6份供试品溶液,按1.6.4节色谱条件分别进样检测,记录各成分峰面积,计算各成分含量RSD分别为0.72%、0.62%、0.16%,表明样品重复性良好。(3) 稳定性试验:取同一样品,按1.6.2节方法制备供试品溶液,按1.6.4节色谱条件进样检测,分别在0,2,4,8,12,24 h进样。记录色谱图,并计算各成分峰面积RSD值为0.13%、0.80%、1.10%。表明该供试液在24 h内基本稳定。(4)线性关系考察:取混合对照品储备溶液,经适当稀释,得到系列浓度的混合对照品溶液,按1.6.4节色谱条件进样分析,记录峰面积,以浓度(x)为横坐标,峰面积(y)为纵坐标,进行线性回归, 得回归方程与线性范围见表 1。(5)加样回收试验:取已知对羟基苯甲醛、香草醛和丁香醛含量的同一样品9份,每份0.1 g,精密称定,分别加入一定量的对羟基苯甲醛、香草醛和丁香醛对照品溶液,使加入量为样品中对羟基苯甲醛、香草醛和丁香醛含量的 80%(3份)、100%(3份)和120%(3份)。按1.6.2节方法平行制备供试品溶液9份,按1.6.4节色谱条件进样检测,记录各成分峰面积,计算加样回收率,结果对羟基苯甲醛、香草醛和丁香醛的平均加样回收率为 97.36%(RSD为1.5%,n=9),表明该测定方法的回收率良好,准确度满足要求。
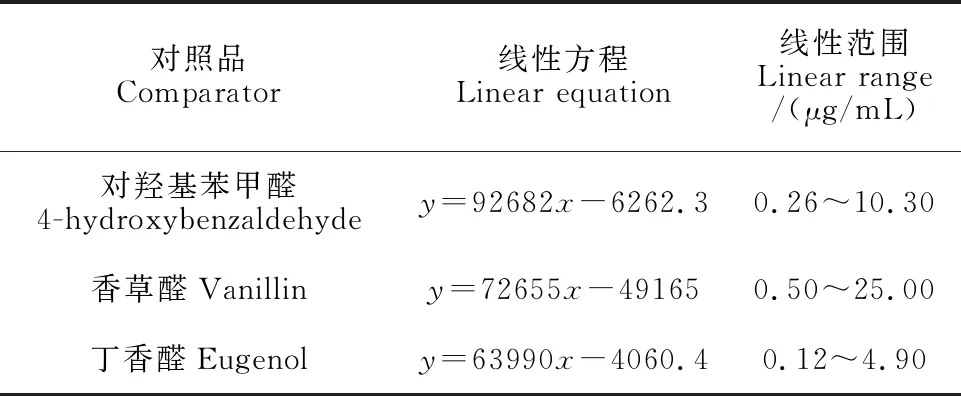
表1 对照品峰面积与浓度线性方程
1.7 种子发芽率测定
随机选取各层积时期桃儿七种子150粒,用1%的次氯酸钠溶液消毒15 min,蒸馏水冲洗3~5次,播于沙床上(铺沙3~5 mm),每皿播种50粒,3次重复,在25 ℃全光照条件下培养,每天加水1 mL,并记录萌发种子数(以胚根突破种皮为种子萌发标准),最后据观察结果计算发芽率(发芽种子总数/供试种子数×100%)。
1.8 数据分析
使用Origin 2019作图,SPSS 17.0进行方差分析,利用SPSSAU平台进行逐步回归分析。
2 结果与分析
2.1 不同层积阶段桃儿七种子萌发率
图 1显示,桃儿七种子发芽率随层积时间的延长而呈上升趋势,休眠逐渐解除,种子发芽率由初始的34.81%逐渐升高至87.22%,最终趋于稳定,且层积阶段间多差异显著(P<0.05)。
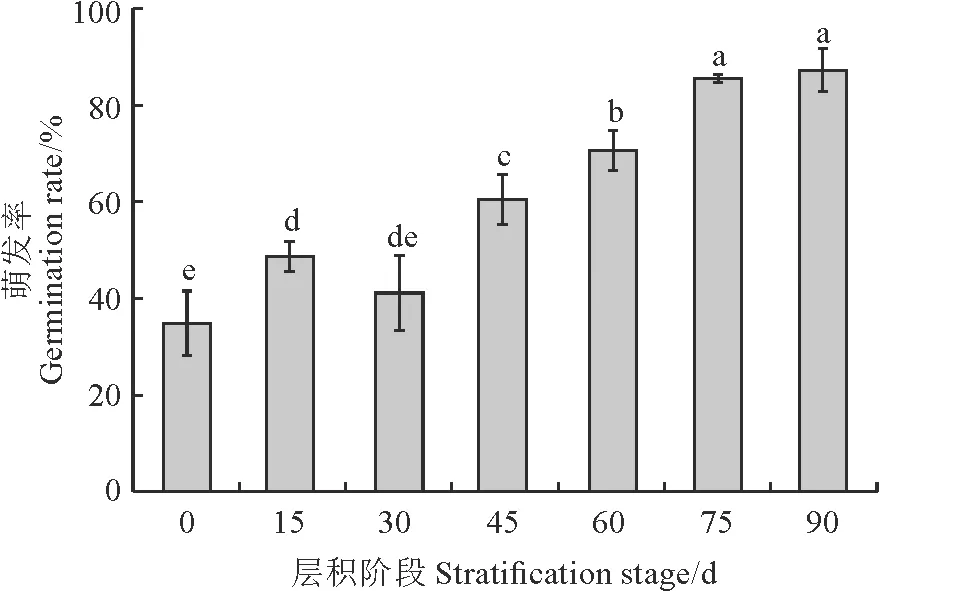
不同小写字母表示层积阶段间在0.05水平上差异显著。下同。
2.2 不同层积阶段桃儿七种子细胞壁代谢特征
2.2.1 纤维素含量及纤维素酶活性
由图 2,A可知,纤维素含量在桃儿七种子胚乳和种皮中较多,而在种胚中远低于胚乳和种皮。在整个层积过程中,其种胚和种皮中纤维素含量均整体表现出先降后升的相似变化趋势,种胚中纤维素含量在层积45 d时降至最低(7.85 mg/g),种皮中纤维素含量在层积60 d时降至最低(16.69 mg/g),并与大多数层积时间差异显著;胚乳中纤维素含量的变化较为平稳,但在层积45 d出现最低值,也与大多数层积时间差异显著。同时,桃儿七种皮、胚乳及种胚中纤维素酶活性均较低,基本在0.01~0.30 U/g范围内浮动,仍以种皮在三者中最低;各部分纤维素酶活性随着层积时间的变化趋势与纤维素含量的变化趋势相互对应,均先升后降,且均在层积45 d或60 d时出现峰值(图2,B)。
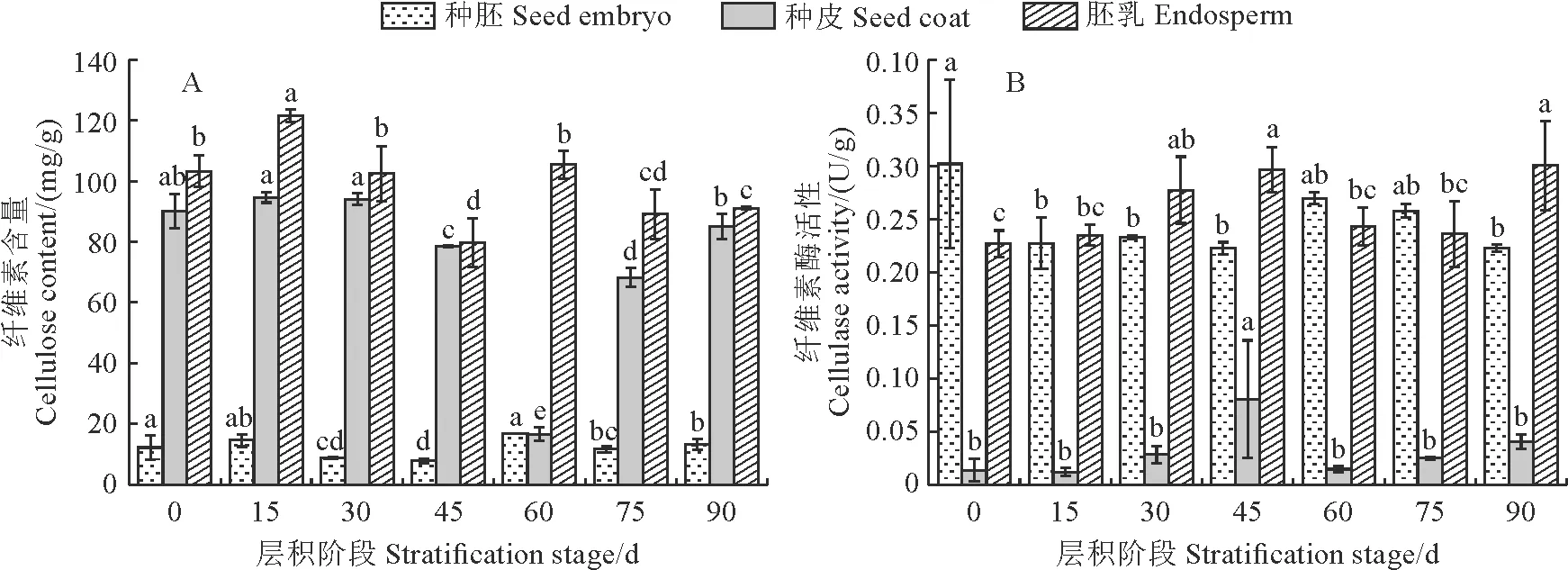
图2 不同层积阶段桃儿七种子纤维素含量及纤维素酶活性变化
2.2.2 半纤维素含量及相关代谢酶活性
图3,A显示,半纤维素含量在桃儿七种子种胚和种皮中较高,而在胚乳中明显较低。在整个层积过程中,种胚和种皮中半纤维素含量的变化总体上较为一致,均呈先降后升的趋势,种皮中半纤维素含量在层积60 d时下降至最低值,并与其余层积时间差异显著,而种胚中半纤维素含量分别在层积45 d和90 d时出现两次低值,也与其余层积时间差异显著;胚乳中半纤维素含量除在层积30 d时显著升高外,其余各阶段间均无显著变化。同时,在种子层积过程中,桃儿七种皮、胚乳及种胚中甘露聚糖酶活性均处于较低水平,基本在0.14~1.33 U/g范围内浮动,并以种皮中最低;种胚和胚乳中甘露聚糖酶活性变化比较平稳,而种皮中甘露聚糖酶活性总体呈上升趋势,并在层积45 d时达到峰值(图3,B)。另外,在种子层积过程中,木糖苷酶活性在桃儿七种胚和胚乳中较高,在种皮中明显较低。种胚中木糖苷酶活性在层积0 d时最高,并与其余层积阶段均有显著差异;胚乳中木糖苷酶的活性变化幅度较小,在层积45 d时达到峰值,仅与层积0 d和15 d时差异显著;种皮中木糖苷酶活性在0.16~0.32 U/g间浮动,在层积45 d时活性最高,但仅与层积30 d时差异显著(图3,C)。

图3 不同层积阶段桃儿七种子半纤维素含量及甘露聚糖酶和木糖苷酶活性变化
2.2.3 果胶含量及相关代谢酶活性
由图4,A可知,桃儿七种胚中果胶含量明显较种皮和胚乳高;在整个种子层积过程中,种胚中果胶含量分别在层积45 d、75 d和90 d时显著低于其余层级时段,种皮和胚乳中果胶含量变化较为一致,总体随着层积时间呈先升后降的变化趋势,在层积15 d时均显著升高,而在层积60 d和90 d时均显著下降。同时,层积过程中桃儿七种皮、胚乳及种胚中多聚半乳糖醛缩酶活性的变化幅度均较小;种胚中酶活性在层积45 d时显著降低,在其余各阶段间均无显著变化,种皮和胚乳中酶活性的变化趋势相似,均在层积后期呈上升趋势(图 4,B)。此外,层积过程中桃儿七种皮、胚乳及种胚中果胶甲酯酶活性的变化相似,均呈先升后降的趋势,且都在层积45 d时出现峰值,并与其余时间段存在显著差异(图4,C)。

图4 不同层积阶段桃儿七种子果胶含量、多聚半乳糖醛缩酶及果胶甲酯酶活性变化
2.2.4 木质素含量及相关代谢酶活性
由图5,A 和表2可知,桃儿七种皮和胚乳中木质素单体的组成比例具有明显区别,种皮中以G-木质素含量最高,而在胚乳中以H-木质素含量最高;在整个层积过程中,种皮和胚乳内3种木质素单体含量均随着层积时间呈下降趋势;从层积0~90 d,种皮中G-木质素含量变化幅度最大,由0.83 mg/g降至0.07 mg/g,胚乳中H-木质素含量变化最大,由0.33 mg/g降至0.09 mg/g。同时,在整个种子层积过程中,桃儿七苯丙氨酸解氨酶活性在种皮中较高,而在胚乳中较低;其活性随着层积时间变化趋势在种皮和胚乳中相似,但种皮中酶活性在层积15 d和75 d时显著降至最低,而胚乳中酶活性在层积90 d时显著降至最低(12.10 mg/g)(图 5,B)。另外,在整个种子层积过程中,桃儿七种皮和胚乳中肉桂醇脱氢酶的活性较低且变化趋势平稳,均在0.16~0.77 U/g范围内浮动,且种皮明显低于同期胚乳(图5,C)。

在图A中S、R、Z分别表示混合对照品、胚乳、种皮,1、2、3分别表示对羟基苯甲醛、香草醛和丁香醛。
2.3 不同层积阶段桃儿七种子的活性氧代谢特征
桃儿七超氧化物歧化酶在种胚、胚乳及种皮中的活性均较高,且种胚和胚乳中其活性变化趋势相似,在层积75 d和90 d时均显著升至最高,并与其余时间段差异显著;种皮中超氧化物歧化酶活性的变化幅度较小,在层积30 d和75 d时最低,其余各阶段间均无显著差异(图6,A)。桃儿七种胚内过氧化氢酶活性变化幅度较大,呈现升-降-升-降-升的波动变化趋势,在层积60 d和90 d时显著较高,并与其余时段差异显著;胚乳中过氧化氢酶活性在整个层积过程中变化较为平稳,但在层积60 d和90 d时出现峰值;种皮中过氧化氢酶活性总体呈现先降后升的趋势,在层积90 d时最高,并较其余各阶段均存在显著差异(图6,B)。在整个层积过程中,种胚内过氧化物酶活性变化也较大,与过氧化氢酶较为相似,呈现升-降-升-降的波动变化趋势,在层积15 d和60 d时显著升高,但在层积75 d和90 d时显著下降,并与其余时间段差异显著,在层积90 d时已降至32.96 U/g;胚乳中过氧化物酶活性呈小幅上升趋势,层积60 d时出现峰值;种皮中过氧化物酶活性在层积90 d时显著升至最高,并与其余各阶段差异显著,其余时间段间均无显著差异(图6,C)。
2.4 不同层积阶段桃儿七种皮表面及纵截面的超微结构变化
桃儿七种皮主要由角质层、栅状石细胞层及海绵组织层3层构成(图7)。最外层为角质层,结构致密;角质层内层为一列排列紧密,纵向分布,细胞壁不均匀加厚的栅状石细胞层;最内层为横向排列,由10层以上细胞构成的海绵组织层。整个层积过程中,角质层和栅状石细胞层变化不大,种皮表面及种子内部海绵组织变化明显(图7、8)。桃儿七种子在低温层积30 d时,种皮表面开始出现破损(图8,C、J),种皮细胞中的黏质开始分泌,此时种皮内部海绵组织开始膨胀疏松(图7,E、F)。在低温层积60 d后,种皮开始凸起,表面破损加剧并出现明显裂缝(图8,E、L), 此时种皮内海绵组织层膨胀加剧,继续向外施压破坏种皮(图7,I、J)。在低温层积 90 d时,海绵组织间隙进一步增大,膨胀加剧(图7,L),种皮表面进一步皱缩,裂纹加深且增多,种皮表面黏质大量分泌(图8,G、N)。

A、B.层积0 d;C、D.层积15 d;E、F.层积30 d;G、H.层积45 d;I、J.层积60 d;K.层积75 d;L.层积90 d;Ma.角质层;Pa.栅状石细胞层;Qa.海绵组织层。

A、H.层积0 d;B、I.层积15 d;C、J.层积30 d;D、K.层积45 d;E、L.层积60 d;F、M.层积75 d;G、N.层积90 d。
2.5 桃儿七种子萌发过程中细胞壁代谢主要影响因素分析
将不同层积阶段种子不同部位的细胞壁组分含量及相关代谢酶活性作为自变量(x),种子萌发率作为因变量(y),通过Stepwise法进行逐步回归分析,以探究影响桃儿七种子萌发率的主要影响因素。结果(表3)显示,经过模型自动识别,最终余下胚乳S-木质素含量(x1)和种皮S-木质素含量(x2)共2项在模型中,回归方程为y=1.161-0.307x1-0.121x2,R2值为0.924,意味着胚乳S-木质素含量和种皮S-木质素含量可以解释92.4%的种子萌发率变化,模型拟合良好。而且模型通过F检验(F=24.243,P<0.05),说明模型有效。另外,针对模型的多重共线性进行检验发现,模型中VIF值(均为1.012)均小于5,意味着不存在着共线性问题,并且D-W值(1.992)在2附近,说明模型不存在自相关性,样本数据之间并没有关联关系,模型较好。胚乳S-木质素含量回归系数值(-0.307)和种皮S-木质素的回归系数值(-0.121)的t测验值分别为-6.266(P<0.01)和-3.704(P<0.05),意味着胚乳S-木质素和种皮S-木质素会对桃儿七种子萌发率产生显著的负向影响。
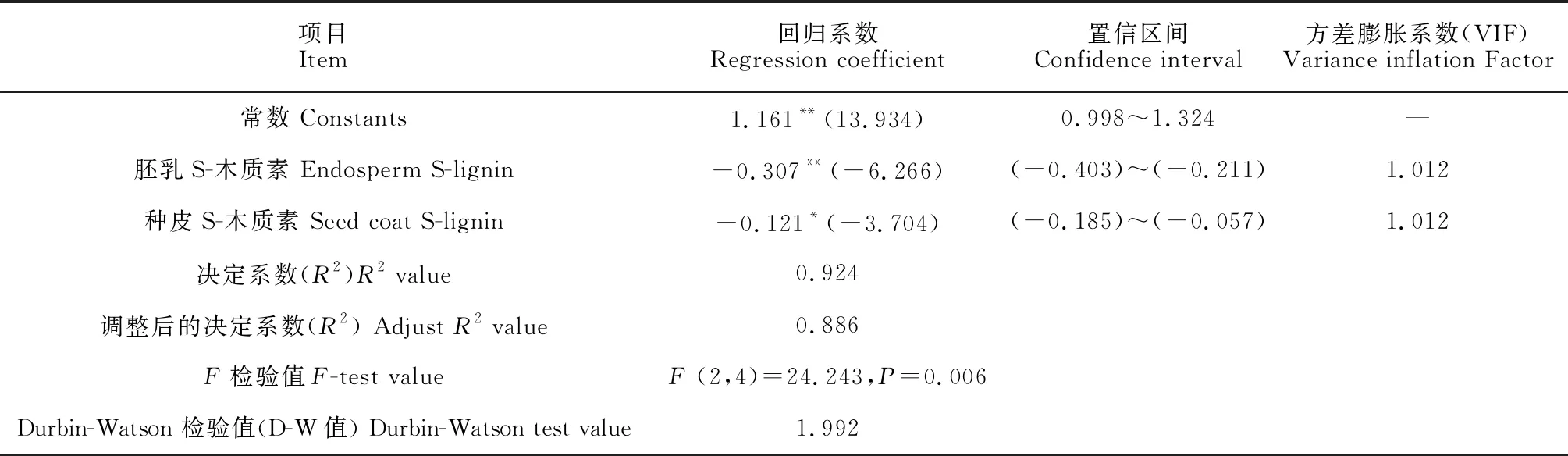
表3 逐步回归分析结果
3 讨 论
植物种子在成熟过程中,其种皮中的薄壁细胞会逐渐分化形成角质层、蜡质层、栅栏层等具有支撑保护作用的结构[16],虽然这些结构使得种子在应对恶劣的气候条件时占据一定的有利条件,但是也阻碍了种子的透气透水性;另外,这些结构的细胞壁通常呈现一定程度的加厚,导致种子的萌发受到更大的机械束缚。研究表明,低温层积处理能破坏大花四照花种皮表层结构,同时还能破坏种皮内部栅栏层,从而促进休眠解除[17]。本研究表明,桃儿七种皮主要由3层构成,分别为角质层、栅状石细胞层及海绵组织层,在休眠解除的过程中,种皮内部的海绵组织逐步疏松膨胀,并向外施压破坏种皮,种皮表面裂纹逐渐加深增多,种皮内黏质大量向外分泌,种皮结构的破坏减少了种子萌发所受到的机械约束;另外,海绵组织层的疏松可能导致种子吸水能力的增强,最终导致种子休眠的解除。
纤维素是由β-D-吡喃葡萄糖残基以β-1,4-糖苷键连接而成的无分支长链,是植物中最广泛的骨架多糖,约占植物细胞壁的30%~40%[18]。通常高纤维素含量意味着高机械强度,这对种子萌发具有不利影响,如休眠的柳叶刺廖(PolygonumpennsylvanicumL.)种子胚乳中纤维素含量更高[19]。半纤维素成分多样,主要包括木聚糖 (xylan)、木葡聚糖(xyloglucan)、甘露聚糖 (mannan) 和它们的衍生物,其中木葡聚糖能通过氨键与纤维素微纤维相互作用,促进纤维素网络的结构完整性,进而增强细胞壁的机械支撑作用[20],但过多的半纤维素积累会阻碍种子的透气透水性,如半纤维素(尤其是木聚糖)在种皮部位的沉积造成红木(BixaorellanaL.)种子的高度不透水性[19]。果胶是植物细胞壁的第三类多糖物质,广泛存在于植物细胞壁的初生壁和中胶层中,在单、双子叶植物的细胞壁中果胶含量最高可达35%,果胶在植物的生长发育中发挥着多重作用,如促进细胞黏附、提供结构支撑、为植物生长发育和防御反应提供寡糖、维持细胞壁流动性等[21]。细胞壁的松弛是大多数植物种子转向萌发的必然过程,而通过细胞壁降解酶发挥作用,促使细胞壁组分发生变化,破坏细胞壁结构,进而减少种子萌发的机械约束是其内在的机制之一,通常细胞壁降解酶包括纤维素酶、甘露聚糖酶、多聚半乳糖醛缩酶、果胶甲酯酶、木糖苷酶和阿拉伯糖苷酶等。纤维素酶能打断β-1,4-糖苷键从而降解羧甲基纤维素,促进细胞壁松弛,如用纤维素酶处理月季种子能显著提高其发芽率,打破休眠[22];甘露聚糖酶可以催化水解半纤维素中主要含有的半乳甘露聚糖,进而转变为植物需要的基源物质,如曼陀罗种子在胚乳破裂前,甘露聚糖酶活性显著增加,说明其与胚乳弱化具有密切的关系[23];木糖苷酶则可以彻底降解半纤维素中另一主要成分木聚糖[24];多聚半乳糖醛缩酶在果胶甲酯酶的参与下能催化水解果胶分子中α-(1,4)-多聚半乳糖醛酸,从而促进细胞壁松弛[25]。
本研究结果表明,桃儿七种子不同部位的细胞壁组分具有明显差异,种胚中以半纤维素和果胶为主,胚乳中以纤维素为主,而种皮中则以半纤维素为主,这意味着桃儿七种子的不同部位具有不同的机械强度,同时胚乳中的高纤维素含量说明其细胞壁可能存在一定程度的加厚。在整个低温层积过程中,桃儿七种胚、种皮和胚乳中的纤维素含量均在层积中期(45 d和60 d)降至最低,同样种胚和种皮内的半纤维素含量也在此时显著下降,3个部位的纤维素酶活性在层积中期(45 d和60 d)对应升高,种皮中甘露聚糖酶活性和木糖苷酶活性也在层积中期时达到最大,说明层积中期种子内的纤维素和半纤维素逐步降解,导致细胞壁进一步松弛,从而加速休眠的解除,但种胚内甘露聚糖酶活性和木糖苷酶活性在整个层积过程中无显著变化,又说明种胚内的半纤维素降解可能主要不是由酶解造成。桃儿七种子3个部位的果胶含量均在层积后期(75 d和90 d)时显著下降,同时种皮和胚乳中多聚半乳糖醛缩酶活性也相应在层积后期升高,但3个部位的果胶甲酯酶活性在层积45 d时显著升高,这可能是果胶降解首先需要果胶甲酯酶去甲基后才能被多聚半乳糖醛缩酶降解的缘故。另外,3个部位的果胶含量在层积后期显著下降也说明细胞壁结构被进一步破坏,种子内的机械约束逐渐减弱。
木质素是植物次生壁的重要组成部分之一,可与细胞壁中的半纤维素、纤维素等成分相互交连,从而形成结构复杂的细胞外基质,增强植物细胞的机械强度,同时木质素也具有疏水性,使水分不易通过植物细胞,为植物形成一层有效的物理屏障[26]。但对于种子萌发而言,过多的木质素积累会造成吸水障碍和机械约束,不利于种子萌发,如使用外源木质素酶处理蓝紫倒距兰[Anacamptismorio(L.) R.M.Bateman]种子能显著提高其种子吸水性,并促进萌发[27]。本研究中,桃儿七种皮和胚乳内木质素单体的组成比例具有明显区别,且3种木质素单体含量均随层积时间的延长而显著降低,种皮和胚乳中的苯丙氨酸解氨酶作为木质素单体合成途径的关键控制酶,其活性在层积15 d和75 d时均显著降低,但种皮和胚乳中肉桂醇脱氢酶活性一直保持在较低水平且变化平稳。此外,本研究逐步回归分析的结果也表明胚乳和种皮中的S-木质素对种子萌发存在显著的负向影响关系,说明木质素(尤其是S-木质素)含量的降低可能进一步破坏了种皮和胚乳细胞壁的刚性结构,从而加速种子休眠的解除。
种子中活性氧代谢对细胞壁松弛、胚乳弱化、细胞的程序性死亡及种子休眠等诸多方面起到重要的作用[28],如三叶鬼针草(BidenspilosaL.)种子经可产生羟基自由基的试剂处理后,可以有效解除其种子休眠[29]。然而过量的活性氧会造成细胞的损伤和种子老化,维持细胞内活性氧的稳态对于种子萌发极为重要,通常植物细胞会通过SOD、CAT和 POD等将H2O2进一步分解为H2O和O2,而且研究也证实SOD可以促进烟草种子的萌发[30],POD活性的降低有利于葡萄芽休眠的释放[31]。本研究发现,桃儿七种胚内POD活性在层积过程中呈现升-降-升-降的波动变化趋势,胚乳内POD活性在层积60 d时出现峰值,而后活性明显下降;同时,种胚内CAT活性也呈现升-降-升-降-升的波动变化趋势,并在层积60 d和90 d时出现两次峰值,而其活性在胚乳中则变化平稳,说明种胚内活性氧代谢较胚乳旺盛,种胚和胚乳中可能存在大量活性氧攻击细胞壁多糖,加速细胞壁松弛,促进种胚伸长和胚乳弱化,从而导致休眠解除。另外,桃儿七种胚和胚乳内SOD活性在层积后期显著上升以及CAT活性在层积60 d和90 d时出现上升则说明活性氧对于细胞壁多糖的攻击可能是间歇性的,当细胞内积累过多活性氧时,为避免其带来的细胞损伤,抗氧化酶活性会急剧升高以维持种子内的活性氧代谢稳态。
本研究中桃儿七种胚和胚乳内POD活性在层积75 d和90 d时明显下降,说明层积后期可能存在大量活性氧攻击种胚和胚乳中的细胞壁多糖,加速细胞壁的松弛,促进种胚伸长和胚乳弱化,从而导致休眠解除,而种胚和胚乳内SOD活性在层积后期(75 d、90 d)显著上升以及CAT活性在层积60 d和90 d时出现的上升则可能是为了减轻过量的活性氧带来的毒害作用。
4 结 论
桃儿七种皮主要由角质层、栅状石细胞层及海绵组织层构成,在低温层积解除休眠的过程中,其细胞壁刚性结构组分纤维素、半纤维素及木质素在维素酶、甘露聚糖酶、木糖苷酶、多聚半乳糖醛缩酶和果胶甲酯酶等共同作用下逐步酶解,同时种胚和胚乳中的大量活性氧进一步攻击细胞壁多糖,从而导致种皮内部的海绵组织逐步疏松膨胀,并向外施压破坏种皮,种皮表面裂纹逐渐加深增多直至破裂,种皮内黏质大量向外分泌,促使种子萌发的机械束缚力降低,透性提高、胚根生长能力增强,最终导致其种子休眠的解除。其间,桃儿七种子胚乳和种皮中的S-木质素对种子萌发存在显著的负向影响,木质素(尤其是S-木质素)含量的降低可能进一步破坏了种皮和胚乳细胞壁的刚性结构,从而加速种子休眠的解除。
