水稻耐盐响应中钾运输载体的研究进展
2023-11-14矫金航张雅琳王赞彭周博阳刘敏敏
矫金航,张雅琳,王赞彭,周博阳,刘敏敏,喻 敏,潘 婷
(佛山科学技术学院 食品科学与工程学院,国际膜生物学与环境研究中心,广东佛山 528000)
1 盐胁迫对水稻的危害及水稻耐盐机理
根据联合国粮农组织统计,全球约20%农业用地受盐害的程度不断加重,预计到2050年,超过1/2的耕地将盐碱化[1]。不断加剧的土壤盐碱化已严重影响13个国家约40.3亿人口(占世界人口的50%),是制约全球粮食产量和品质的主要环境因素之一[2-3]。
高盐环境对水稻各个生长阶段造成许多负面影响。萌发阶段,盐分引起水稻种子生理代谢紊乱,出苗率下降;营养生长期,Na+、Cl-在叶片的过度积累会造成叶片卷曲枯黄,抑制新叶和根系的生长发育,光合作用受阻,抗氧化酶活性下降等。进入分蘖期和成熟期后,水稻的分蘖和伸长受到盐胁迫抑制,出现有效分蘖数降低,孕穗期缩短,抽穗延迟,穗短粒少,籽粒不饱满等情况。
水稻对盐胁迫的响应涉及许多生理过程,包括渗透调节、离子平衡、活性氧清除、激素调控等[4]。其中,维持K+和Na+的稳态对耐盐性至关重要。大量钾离子运输载体通过吸收K+,排出Na+或将Na+区隔化于液泡内来维持细胞质中较高的K+/Na+值,以缓解盐胁迫引起的离子毒害[5-6]。参与这些过程的钾运输载体可归类为Shaker、TPKs(tandem-pore K+channels)、KT/HAK/KUP(K+transporter/high-affinity K+transporter/K+uptake transporter)、HKT(high-affinity potassium transporter)和CPAs(monovalent cation/proton antiporters)。本文就水稻钾转运载体在盐胁迫条件下发挥的功能作用以及调控机理进行了综述,并对未来研究前景予以展望,为培育耐盐高产的水稻品种提供重要的理论依据。
2 水稻钾运输载体对盐胁迫的响应及其耐盐功能
2.1 Shaker通道
单一完整的植物Shaker钾离子通道由4个亚基组成,每个亚基上具有6个跨膜区和1个C-末端胞内区,其中第4跨膜区上富含感受膜电位变化的正电荷氨基酸,负责控制通道开放与关闭,第5、6跨膜区间的环状结构(P-loop)包含高度保守的特异序列,使通道具有高K+选择性[7-9]。Shaker钾离子通道具有不连续的电压门控开关,可通过电压依赖性及K+跨膜运动的方向进一步划分为内向型整流K+通道(IR)、外向型整流K+通道(OR)、弱整流型K+通道(WR)[10-11]。
研究发现,内向整流型K+通道OsAKT1的超极化位点在盐胁迫下被激活,促进根系K+的大量摄入[12]。OsAKT2介导K+在韧皮部装载和再分布,有助于维持Na+、K+的稳态并抑制根部对Na+的吸收[13]。内向整流型K+通道OsKAT1和OsKAT2也参与耐盐响应过程。OsKAT1具有内吸K+及外排Na+的作用,能够提高酵母和水稻细胞的耐盐性[14-15]。OsKAT2在保卫细胞K+吸收中发挥作用并通过调节气孔开放来参与水稻耐盐[16-17]。外向整流型K+通道OsK5.2(OsGORK)在响应盐胁迫中可能也发挥重要作用,其转录水平受盐胁迫诱导上调,有利于K+在根中的保留[18-19]。另有研究发现,OsK5.2参与调节气孔关闭,同时将K+卸载至木质部,以提高水稻的耐盐性[20]。
2.2 TPK通道
不同于Shaker钾离子通道,TPK双孔钾离子通道每个亚基仅包含4个跨膜区及2个环状结构(P-loop),虽然其对电压变化并不敏感,但是由于具备高度保守的特异序列,因此同样对K+具有高度选择性。水稻TPK包含3名成员:OsTPKa、OsTPKb、OsTPKc[21](表1)。

表1 水稻钾离子通道
OsTPKa和OsTPKb分别定位于细胞溶酶液泡(LVs)和小的蛋白储存液泡(SVs)中[22-23],过表达OsTPKa和OsTPKb减少Na+积累并促进K+转运以维持胞内离子稳态,增强对盐胁迫的耐受性[24-25]。
2.3 KT/HAK/KUP转运体
HAK家族在植物K+的摄取及转运中扮演重要的角色,结构分析表明该蛋白家族具有10~14个跨膜区,且在第2和第3跨膜区之间包含1个环状结构[26]。水稻HAK家族包含27个成员,可被划分为4个基因进化簇:簇I、簇Ⅱ、簇Ⅲ、簇Ⅳ[27],其中簇I被认为对K+具有高亲和力,簇II成员的序列和功能差异较大,而簇Ⅲ、簇Ⅳ的功能特征鲜有报道[28-29]。水稻HAK转运体介导K+的吸收转运和Na+的外排(表2)。大多OsHAK的表达受低钾和盐胁迫诱导,OsHAK1、OsHAK5和OsHAK16通过促进K+的吸收来维持植物体内较高的K/Na比[29-32],OsHAK3和OsHAK21对调节胞质内Na+/K+稳态至关重要[33-35]。OsHAK8介导K+吸收和转运以应对低钾胁迫,耐盐性功能仍需进一步研究[36]。OsHAK10、OsHAK12、OsHAK17和OsHAK18受盐胁迫诱导表达,OsHAK10可增加老叶中Na+的积累[37],OsHAK12具有Na+渗透性,参与木质部Na+的回收从而降低地上部Na+含量[38],OsHAK17和OsHAK18同样受低钾诱导,但不直接参与K+吸收,而参与K+在韧皮部K+转运和再分配[39-41]。此外,某些OsHAK转运体对种子萌发有所调节,OsHAK9介导盐胁迫下种子萌发中Na+、K+的平衡[42],OsHAK21参与盐胁迫下K+的吸收,并在种子萌发和幼苗建立中发挥作用[43]。

表2 水稻KT/HAK/KUP转运体
2.4 HKT转运体
HKT是一类Na+或K+转运体或Na+、K+共转运体,由4个MPM(membrane-pore-membrane motif)基序组成,每个基序由2个跨膜区和1个环状结构(P-loop)构成[44]。HKT的离子选择性通常由第一环状结构的保守氨基酸性质决定[45-46]。目前已在水稻中鉴定出9个HKT基因,依据进化关系可划分为2个亚族[47]。
I类OsHKT转运体主要定位于木质部薄壁细胞的质膜,具有Na+选择性[48-49](表3)。OsHKT1;1和OsHKT1;4通过降低韧皮部或木质部汁液中Na+浓度来减轻地上部离子毒害[47-52]。OsHKT1;5将木质部中的Na+卸载至薄壁细胞,同时促进K+向地上部的运输来维持Na+和K+平衡[53-54]。OsHKT1;3与OsHKT1;5均可在盐胁迫下促进种子萌发并恢复幼苗生长[55-57]。II类OsHKT转运体则对Na+、K+均具有较强的渗透性,在维持水稻Na+/K+稳态中发挥作用(表3)。OsHKT2;1介导Na+的流入以补充缺钾胁迫时K+的缺失,但其对Na+的吸收功能可被盐胁迫迅速抑制[58-60]。OsHKT2;2在低钾条件下诱导Na+的吸收,随胞外K+浓度的增加,Na+转运速率降低[61]。OsHKT2;4具有较强的K+渗透性,高Na+浓度下OsHKT2;4介导的Na+转运活性受限[62-64]。
2.5 CPA转运体
植物CPA家族主要包括3个家族:NHX(Na+/H+exchanger)、CHX(cation/H+exchanger)和KEA(K+efflux antiporter)。其中,NHX家族在耐盐性方面的研究较为深入。NHX一般含有10~12个跨膜区,跨膜区之间没有典型的环状结构。NHX能够催化H+与Na+和/或K+的跨膜交换,对盐胁迫下维持植物细胞内pH平衡及离子稳态至关重要[65-66]。水稻中有5个基因编码NHX转运体,根据进化关系,可分为2个亚组,OsNHX1-OsNHX4为第一亚组,定位于液泡膜,OsNHX5为第二亚组,定位于内膜[67]。
研究表明,OsNHX1、OsNHX2、OsNHX3和OsNHX5均受盐胁迫诱导表达,它们将细胞质中的Na+区隔化至液泡内或其他区室内,维持胞质内离子平衡,减少Na+的毒害[68-70],对OsNHX2、OsNHX3的进一步研究发现其主要通过将Na+储存至叶鞘薄壁细胞中来提高水稻的耐盐力[70-71]。OsNHX5的功能与家族其他成员略有不同,它介导低Na+转运,KCl处理下其转录水平上升,推测OsNHX5具有K+/H+交换的作用[72]。OsSOS1是质膜定位的Na+/H+反向转运体,盐胁迫下其表达上调并通过OsCBL4-OsCIPK24-OsSOS1途径激活,从而促进Na+外排,降低细胞内的Na+含量,调节水稻的耐盐性[72-73]。
3 水稻钾运输载体在盐胁迫下的调控机理
3.1 转录调控
转录调控是植物应对非生物胁迫的关键手段[74],目前已鉴定出许多响应盐胁迫的转录因子家族,如bHLH、WRKY、MYB、NAC等[75],其对钾运输载体均具有一定的调控作用(图1)。OsMYB106(MYB型转录因子)、OsBAG4(分子伴侣调控蛋白)和OsSUVH7(DNA甲基化识别酶)三者相互作用形成复合物,促进OsMYB106与OsHKT1;5中的顺式结合元件MYBE结合,激活OsHKT1;5的表达,减少Na+在胞内的过度累积[76]。OsGTγ-2(trihelix transcription factor,三螺旋转录因子家族GTγ亚家族成员)受盐胁迫、渗透胁迫及氧化胁迫诱导表达,研究表明OsGTγ-2直接与OsNHX1、OsHKT1;3和OsHKT2;1的启动子相互作用并正向调节水稻耐盐性[77]。OsNAC3(NAC型转录因子)通过正向调节OsHKT1;4和OsHKT1;5参与水稻耐盐响应过程[78]。OsbHLH001(bHLH型转录因子)可通过特异性结合OsAKT1启动子区的E-box序列,诱导OsAKT1的表达,促进K+流入从而调节盐胁迫下水稻中的钾钠比[79]。OsbHLH035通过激活OsHKT1;3和OsHKT1;5的表达,调控盐胁迫后的种子萌发和幼苗恢复[80]。OsJAZ9(OsTIFY11a,TIFY型转录因子)能够与OsbHLH062相互作用并抑制OsbHLH062介导的对OsHAK21和OsHAK27转录激活[81]。转录因子OsbZIP72直接与OsHKT1;1启动子区域中的ABA反应元件结合,诱导OsHKT1;1的表达以响应盐害[82],OsbZIP71能够与OsNHX1的启动子结合,促进OsNHX1表达,增强水稻耐盐性[83]。
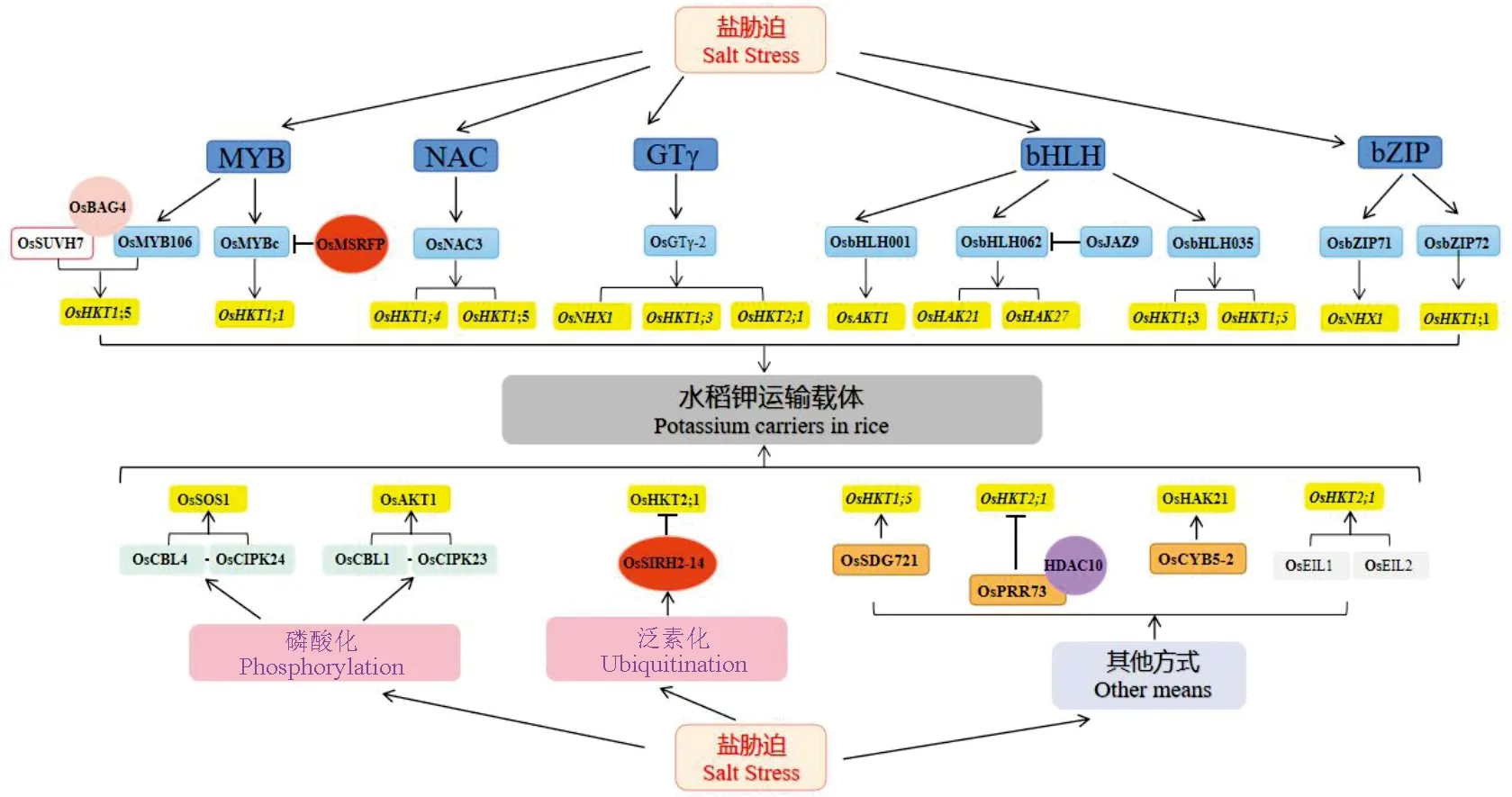
涉及激活或调控响应盐胁迫水稻钾运输载体的途径;水稻转录因子(TF)MYB、GTγ、bHLH、bZIP对钾运输载体的转录调控;磷酸化、泛素化等方式对钾运输载体活性的调控。
3.2 翻译后修饰
蛋白质翻译后修饰对水稻响应盐胁迫至关重要,通过磷酸化、泛素化等修饰手段可快速调节多个细胞途径中蛋白质活性、功能和定位以及不同蛋白间的相互作用,以减轻盐胁迫造成的损害[84-85]。
磷酸化是最常见修饰形式,CBL-CIPK网络在感应盐诱导的Ca2+信号和调节Na+/K+稳态方面中发挥着关键作用[86-87](图1)。
SOS信号通路是植物中首个发现参与非生物逆境的信号传导途径。水稻SOS途径中,钙结合蛋白OsSOS3/OsCBL4感知盐胁迫引起的胞质钙信号,与蛋白激酶OsSOS2/OsCIPK24互作并磷酸化OsSOS2,磷酸化后的OsSOS2蛋白迅速与质膜定位的OsSOS1结合并将其激活,促进Na+排出,维持细胞中离子平衡[88]。此外,盐胁迫引发的胞质内Ca2+浓度升高,诱导OsCBL1和OsCIPK23互作并激活OsCIPK23,形成的复合物磷酸化激活OsAKT1的通道活性,促进根部K+吸收[89]。
泛素化修饰在植物应激反应中也起着作用(图1)。E3连接酶通过改变应激响应蛋白(如转录因子)的稳定性来发挥调节作用,从而改变下游反应或通过降解下游级联本身所涉及的蛋白质,其中泛素26S蛋白酶体介导的盐相关蛋白降解在耐盐性中发挥重要功能[90-91]。据报道,RING型E3连接酶OsSIRH2-14在高盐条件下与OsHKT2;1在胞质和质膜上发生强烈的物理作用,并通过泛素26S蛋白酶体降解OsHKT2;1以减少Na+的吸收[92]。OsMYBc能够与OsHKT1;1启动子结合上调其活性,正向调控水稻的耐盐性[88],RING型E3连接酶OsMSRFP通过泛素26S蛋白酶体介导OsMYBc降解并减弱OsMYBc对OsHKT1;1的转录调控作用,降低OsHKT1;1的表达[93]。
3.3 其他调控手段
除上述提及到的调控手段,一些钾运输载体可与其他蛋白之间产生相互作用以此来完成盐胁迫环境下信号的传递、基因的表达以及对生长发育的调控等(图1)。研究发现,在盐胁迫下,OsSDG721(SET domaing group,具有组蛋白赖氨酸甲基转移酶活性的蛋白)能够结合OsHKT1;5的启动子区域,上调OsHKT1;5的表达,维持胞内K+、Na+稳态[94]。OsPRR73(pseudo response regulator,伪应答调控蛋白)与HDAC10(Histone deacetylases,组蛋白去乙酰化酶)结合形成的复合物能够与OsHKT2;1的启动子区域结合,抑制OsHKT2;1的表达,从而减少细胞内Na+的流入和胞质内ROS的积累,增强水稻的耐盐性[59]。盐胁迫下,内质网定位的细胞色素b5(OsCYB5-2)能与OsHAK21互作,增强OsHAK21对K+亲和性,促进K+内吸,从而维持细胞内K+/Na+稳态[34]。OsEIL1和OsEIL2(乙烯不敏感3-LIKE1、LIKE2)能够直接激活OsHKT2;1在根中的表达,OsHKT2;1吸收并转运过多的Na+,负向调控水稻幼苗的耐盐性[95]。
4 展 望
随着对水稻钾运输载体研究的不断深入,其具体结构功能也逐渐得以揭示,但目前水稻钾运输载体的分子机制研究仍处于起始阶段,在探究钾运输载体调控的方式及互作关系上仍有很大的空缺。针对这一问题,笔者认为可以从以下几个方面展开深入探究:(1)从基因和蛋白水平对耐盐及不耐盐的水稻进行分析,探究不同品种类型之间钾运输载体的差异,进一步揭示不同材料间盐胁迫反应的异质性。(2)盐胁迫下,植物感知渗透压变化和离子信号并将其转导至细胞内部,以此改变细胞特性来应对盐胁迫。通过分析寻找与钾运输载体互作的蛋白或启动子等顺式元件,来探寻钾运输载体在盐胁迫信号网络中发挥的功能作用,例如调节下游靶基因表达的转录因子或激酶等。(3)水稻钾运输载体蛋白具有不同的时间空间表达模式,进一步探究其在水稻生长的各时期阶段发挥不同的作用有重要意义。例如在盐胁迫条件下,OsHKT1;4控制生殖生长阶段的Na+稳态,但不影响营养阶段的Na+积累;OsHKT1;5介导的Na+调控转运,对维持盐害下水稻苗期和生殖期生长至关重要。(4)许多与水稻不同发育阶段耐盐性相关的QTL(数量性状基因座),可有效控制水稻茎部和根系的K+浓度、叶片光合作用和蒸腾速率、成熟期灌浆粒数和重量等性状。耐盐稻杂交所鉴定的qSKC-1 QTL编码OsHKT1;5调节盐胁迫下的钠钾稳态,中国地方品种‘九彩青’中分离出的qSE3 QTL具有与OsHAK21类似的功能,可促进盐胁迫下的种子萌发和幼苗建立。因此,进一步挖掘耐盐稻基因,为培育耐盐高产的水稻品种提供基因资源,并利用标记辅助育种(MAB)将耐盐QTL转移到优质水稻材料是实现水稻耐盐的一种可能途径。
