薯蓣皂苷元通过NLRP3通路对RAW264.7来源泡沫细胞炎症反应的影响①
2023-11-13李海涛滕云飞胡国富华中科技大学同济医学院附属协和医院武汉430000
蔡 飞 李 沁 李海涛 滕云飞 胡国富 (华中科技大学同济医学院附属协和医院,武汉 430000)
动脉粥样硬化(atherosclerosis,AS)是一种以血管内皮细胞损伤、脂质浸润和慢性炎症等为主要特征的慢性疾病[1]。氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)是AS 发生发展进程中的关键因子。AS发展早期,单核细胞向内膜迁移聚集分化为巨噬细胞。巨噬细胞通过其表面的跨膜蛋白,如SR-A、CD36 等过度摄取ox-LDL,变为胆固醇负载的泡沫细胞[2]。泡沫细胞可通过分泌炎症细胞因子,如IL-1β、TNF-α等加强局部炎症反应,促进斑块不稳定性从而加重AS[3-4]。NLRP3 在炎症刺激和调节过程中起重要作用。研究表明,急性冠状动脉综合征患者外周血中检测到NLRP3 蛋白表达升高,并与疾病严重程度呈正相关,说明NLRP3 过度激活能够加快AS 相关疾病进展[5]。动物实验也发现AS模型小鼠表现出NLRP3炎症通路激活,而NLRP3沉默能够缓解机体炎症以及延缓斑块形成[6]。薯蓣皂苷元是(Diosgenin)主要以穿龙薯蓣、盾叶薯蓣作为原料,经水解、提取制得的中药单体,具有治疗糖尿病、治疗阿尔茨海默病、抗肿瘤、抗感染、抗炎及抗心血管疾病等功效[7-8]。已有研究表明,薯蓣皂苷元能够抑制AS 中炎症因子表达及斑块形成,但与AS中NLRP3炎症通路的相关作用机制尚未阐明[9]。鉴于此,本研究通过构建RAW264.7 来源泡沫细胞模型探讨薯蓣皂苷元对RAW264.7 来源泡沫细胞NLRP3炎症通路的影响。
1 材料与方法
1.1 材料 RAW264.7 细胞购自武汉普诺赛公司(货号:CL-0190);薯蓣皂苷元购自德国默克生物有限公司(货号:D1634);ox-LDL、蛋白提取试剂盒及BCA 蛋白浓度测定试剂盒均购自北京索莱宝生物有限公司(货号:IO1300、BC3711、PC0020);IL-1β及IL-18 ELISA 检测试剂盒均购自武汉华美生物科技有限公司(货号:CSB-E08054m、CSB-E04609m);CCK-8 试剂盒、兔多抗GAPDH 及兔多抗Caspase-1均购自武汉爱博泰克生物科技有限公司(货号:RM02823、AC001、A0964);兔单抗NLRP3 及兔单抗Cleaved GSDMD 购自美国CST 生物有限公司(货号:15101、10137);离心机购自德国Eppendorf 公司;超低温冰箱购自青岛海尔股份有限公司;CO2恒温培养箱购自日本Sanyo公司。
1.2 方法
1.2.1 细胞培养 RAW264.7细胞置于含10%FBS、1% 青霉素和链霉素的DMEM 培养基中37 ℃、5%CO2相对饱和湿度培养,根据细胞生长情况2~3 d传代1 次,0.25%胰酶消化,取对数生长期生长状态良好的细胞进行实验。
1.2.2 CCK-8 检测 取对数生长期生长状态良好的RAW264.7 细胞,采用含10%胎牛血清、1%青霉素和链霉素的DMEM 培养基调整细胞密度至1×105个/ml,接入96孔板(100 µl/孔),实验分为对照组、模型组、薯蓣皂苷元组。其中模型组通过采用80 µg/ml ox-LDL 诱 导RAW264.7 细 胞24 h 建 立RAW264.7 来源泡沫细胞模型[10];薯蓣皂苷元组分别加入不同浓度薯蓣皂苷元(1、2、4、8、16 µmol/L)及80 µg/ml ox-LDL 处理24 h,每组设空白对照孔,每孔重复3 次。加药培养结束后加入10 µl CCK-8溶液37 ℃孵育4 h,酶标仪于450 nm 处测定各孔吸光度(A),细胞增殖率(%)=[A实验组-A空白对照组]/[A对照组-A空白对照组]×100%。
1.2.3 油红O染色 实验分为对照组(不经药物干预)、模型组(80 µg/ml ox-LDL)、低剂量薯蓣皂苷元组(加入1 µmol/L 薯蓣皂苷元)及高剂量薯蓣皂苷元组(加入4 µmol/L 薯蓣皂苷元)。细胞接种于铺有盖玻片的6 孔板,药物处理24 h 后去除培养基,PBS冲洗,4%多聚甲醛固定10 min,新鲜配制的油红O染液室温孵育15 min,PBS 冲洗后甘油封片,显微镜下观察拍照。
1.2.4 ELISA 试剂盒检测IL-1β 及IL-18 表达 药物处理24 h 后收集对照组、模型组、低剂量薯蓣皂苷元组及高剂量薯蓣皂苷元组细胞,分别采用ELISA 试剂盒检测细胞IL-1β 及IL-18 表达,严格按照试剂盒说明书操作。
1.2.5 Western blot 检测 药物处理24 h 后收集对照组、模型组、低剂量薯蓣皂苷元组及高剂量薯蓣皂苷元组细胞,根据蛋白提取试剂盒步骤提取细胞总蛋白,定量30 µg进行SDS-PAGE电泳,转至PVDF膜,5%脱脂奶粉室温封闭2 h,分别加入GAPDH 一抗(1∶20 000 稀释)、Caspase-1 一抗(1∶500 稀释)、NLRP3 和Cleaved GSDMD 一抗(1∶1 000 稀释),4 ℃孵育过夜,TBST 清洗3 次,加入辣根过氧化物酶标记的二抗(1∶5 000 稀释)室温孵育2 h,TBST 清洗4 次。加入ECL 化学发光显影后扫描胶片,采用Image J 软件分析蛋白条带灰度值。目的蛋白表达=目的蛋白条带灰度值/内参GAPDH条带灰度值。
1.3 统计学方法 数据通过SPSS16.0软件进行统计学分析,以±s表示,多组间样本比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 CCK-8 检测不同浓度薯蓣皂苷元对RAW264.7 来源泡沫细胞活力的影响 CCK-8 检测结 果 显 示,80 µg/ml ox-LDL 处 理RAW264.7 细 胞24 h后细胞活力相比于正常组明显下降。与模型组相比,2、4、8 µmol/L 薯蓣皂苷元处理后细胞活力显著增强(P<0.05),且呈剂量依赖性(图1)。
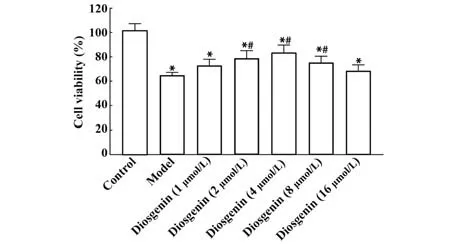
图1 不同浓度的薯蓣皂苷元对RAW264.7 来源泡沫细胞活力的影响Fig.1 Effects of different concentrations of diosgenin on viability of RAW264.7-derived foam cells
2.2 油红O 染色观察各组RAW264.7 细胞内脂质变化 油红O染色结果显示,与对照组相比,模型组RAW264.7 细胞经80 µg/ml ox-LDL 诱导24 h 后可见细胞中存在大量红色脂滴,表明RAW264.7 源性泡沫细胞建立成功;与模型组相比,低剂量及高剂量薯蓣皂苷元组泡沫细胞内脂滴染色较淡(图2)。

图2 各组RAW264.7来源泡沫细胞内脂质变化(×400)Fig.2 Changes of lipids in RAW264.7-derived foam cells in each group (×400)
2.3 试剂盒检测各组细胞IL-1β 及IL-18 表达 与对照组相比,模型组RAW264.7 细胞IL-1β 及IL-18水平显著升高(P<0.05)。与模型组相比,高剂量薯蓣皂苷元组RAW264.7 细胞IL-1β 及IL-18 水平显著降低(P<0.05,图3)。
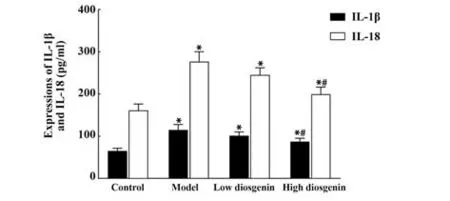
图3 各组细胞IL-1β及IL-18表达变化Fig.3 Changes of IL-1β and IL-18 expressions of cells in each group
2.4 Western blot 检测各组细胞NLRP3、Caspase-1及Cleaved GSDMD 蛋白表达 与对照组相比,模型组RAW264.7 细胞NLRP3、Caspase-1 及Cleaved GSDMD表达均显著升高(P<0.05)。与模型组相比,低剂量薯蓣皂苷元组RAW264.7 细胞Caspase-1 表达显 著 降 低(P<0.05),高 剂 量 薯 蓣 皂 苷 元 组RAW264.7细胞NLRP3、Caspase-1及Cleaved GSDMD表达均显著降低(P<0.05,图4)。
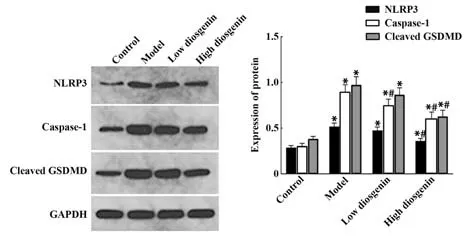
图4 各组细胞NLRP3、Caspase-1及Cleaved GSDMD 蛋白表达变化Fig.4 Expression changes of NLRP3, Caspase-1 and Cleaved GSDMD proteins of cells in each group
3 讨论
AS是一种常见慢性疾病,主要特点为动脉血管管腔在粥状脂质斑块沉积作用下变窄,引起血流不畅,最终造成其下游组织缺血性损伤。AS不仅直接危害机体健康,还能引发动脉瘤、主动脉夹层及冠状动脉疾病等一系列高危疾病,有较高的发病率和致死率,且治疗难度大,治疗成本高[11]。随着人们生活水平逐渐提高,中老年人过量摄入高脂食物,AS 已成为中老年人易患的主要疾病之一。文献报道,预估2020 年全球颈动脉粥样硬化患者有近20亿人,我国可能有近2.7亿患者,且呈逐年上升趋势[12]。目前临床治疗AS 的药物主要以调节体内血脂水平为主,一般分为他汀类、烟酸类、贝特类及胆酸螯合剂类等,这类药物虽对AS 有一定治疗作用,但也存在许多副作用,如肝脏功能损伤、胃肠道消化不良、过敏反应等[13]。我国传统中草药对AS的治疗具有多靶点、多途径及毒副作用小的特点[14]。近年中草药及中草药提取物在治疗AS 方面已取得巨大成就。研究证明大黄素、白藜芦醇、丹皮酚、水蛭和三七总苷等对AS 防治具有良好疗效[15]。本研究通过CCK-8实验表明2、4、8 µmol/L薯蓣皂苷元能够提高ox-LDL 诱导的RAW264.7 细胞活力,油红O 染色结果表明低剂量(1 µmol/L)及高剂量(4 µmol/L)薯蓣皂苷元可抑制RAW264.7 源性泡沫细胞形成。而巨噬源性泡沫细胞形成是AS 进程的初始环节。AS 发病初期,巨噬细胞通过大量摄取ox-LDL 形成泡沫细胞,后期泡沫细胞沉积能导致AS早期形状不规则脂质条纹出现,从而导致脂质斑块形成[3]。薯蓣皂苷元抑制泡沫细胞形成可能是其防止AS 发生发展的重要手段。
炎症反应在AS 发病机制中至关重要。大量研究证明AS 病灶处有大量炎症因子存在,进而推进AS 发展[16]。NLRP3 炎症通路在炎症刺激和调节中起关键作用。体内过量的ox-LDL 和胆固醇等危险信号能激活NLRP3,NLRP3 进一步招募ASC 与Caspase-1结合形成多蛋白复合物,进而激活Caspase-1,活化的Caspase-1 一方面对IL-1β 和IL-18 前体进行切割,形成具有活性的IL-1β 和IL-18,另一方面对GSDMD进行切割,形成GSDMD N 端结构域,诱导细胞膜穿孔破裂,释放IL-1β 及IL-18 等炎症因子到胞外引起炎症反应[17-18]。研究表明,NLRP3 蛋白在冠心病患者血液中过表达并与AS严重程度呈正相关,说明NLRP3 过度激活能够加快AS 相关疾病进展[19]。IL-36 受体拮抗剂能通过抑制NLRP3 炎症途径发挥AS保护作用[20]。通过给予ApoE基因敲除的AS小鼠NLRP3抑制剂MCC950可减少IL-1β、MCP-1和Caspase-1 等表达,减少斑块形成、促进斑块稳定性并改善血管功能[21]。因此,针对NLRP3 炎症途径可能是防治AS的有效策略。本研究中,与模型组相比,低剂量及高剂量薯蓣皂苷元组RAW264.7 源性泡沫细胞NLRP3、Caspase-1、Cleaved GSDMD、IL-1β及IL-18 表达均降低且随薯蓣皂苷元剂量升高,降低幅度增大,提示RAW264.7 源性泡沫细胞NLRP3通路被激活,而薯蓣皂苷元可抑制NLRP3 通路激活,进而减少RAW264.7源性泡沫细胞IL-1β及IL-18等炎症因子分泌。
综上,薯蓣皂苷元可减少RAW264.7 源性泡沫细胞内脂质含量,抑制泡沫细胞形成,调节NLRP3通路减少炎症因子分泌,改善细胞炎症状态,对防治AS有重要意义。
