LPS与ATP共同诱导小鼠原代腹腔巨噬细胞焦亡模型的建立①
2023-11-13刘慧玲吴传新龙贤梨
刘慧玲 吴传新 龙贤梨 李 丽 李 飞 郭 晖 孙 航
(重庆医科大学附属第二医院病毒性肝炎研究所,重庆 400010)
细胞焦亡是一种依赖半胱天冬蛋白酶(caspase-1/-4/-5/-11)活化的炎症细胞死亡方式,其形态介于细胞凋亡和细胞坏死之间,且细胞焦亡的发生机制和调控机制与凋亡和坏死大不相同[1]。一直以来的观点认为在感染性疾病中,免疫细胞的耗竭主要由细胞凋亡引起,然而近年来在HIV 感染的研究中发现CD4+T 细胞的耗竭不仅有凋亡参与,也有焦亡参与,这种炎症性细胞死亡方式将更多的免疫细胞吸引到感染区域,最终对免疫系统造成严重破坏[2]。后续的研究进一步证实仅有5%的CD4+T 细胞耗竭由凋亡引起,而95%的CD4+T 细胞耗竭由caspase-1诱导的焦亡引起[3-4]。
研究发现在多种微生物感染中,caspase-1 的激活是一种宿主防御机制,感染过程中的局部炎症会增强组织破坏和病原体传播,但随着感染的进展,caspase-1 的激活会限制病原体的复制,增强先天和适应性免疫反应,但若感染持续存在,焦亡可造成免疫细胞过度死亡,导致免疫耗竭,引起机体的免疫抑制状态[1]。因此适宜的细胞焦亡是机体抵御病原入侵的重要机制,但过度激活细胞焦亡可使机体免疫失调进而加重炎症反应,严重时可导致器官功能障碍,甚至威胁生命[5]。
鉴于细胞焦亡在应对外来病原感染时产生的“双刃剑”作用,越来越多的科研人员开始关注这种特殊的炎症性细胞死亡方式,并探索其对感染性疾病发生发展的作用机制。目前国内外研究细胞焦亡时的动物模型多使用不同浓度的脂多糖(lipopolysaccharide,LPS)诱导小鼠发生脓毒症[6-7];或直接使用基因敲除小鼠[8-9]。体外模型则多为LPS 单独作用于细胞或LPS 和三磷酸腺苷(adenosine triphosphate,ATP)(或其他细菌)共同诱导细胞焦亡[7,10-13],但LPS 和ATP 的使用浓度及时间均不相同,且无法准确反映焦亡的发生率。本研究旨在通过LPS 和ATP 共同诱导巨噬细胞焦亡,并使用流式细胞术检测焦亡发生率,探索LPS 和ATP 共同诱导细胞焦亡的最佳条件,为研究免疫细胞焦亡的分子机制提供稳定可靠的体外焦亡模型。
1 材料与方法
1.1 材料 6~8周龄SPF级雄性C57BL/6购自常州卡文斯实验动物有限公司。LPS、ATP 购自美国Sigma 公司;DMEM 由本实验室制备;胎牛血清(life)、青-链霉素复合溶液购自湖北赛维尔生物科技有限公司;Annexin V-PE/7-AAD(货号:559763)、F4/80(货号:565410)、CD-11b(货号:557657)购自美国BD 公司;瑞氏-吉姆萨复合染液购自北京雷根生物技术有限公司;CCK-8 试剂盒购自上海碧云天生物技术有限公司;GSDMD(货号:ab209845)、caspase-11(货号:ab246492)、IL-1β(货号:ab234437)、HMGB1(货号:ab18256)购自英国Abcam 公司;caspase-1(货号:D7F10)、ASC(货号:D2W8U)、NLRP3(货号:D4D8T)、IL-18(货号:E8P5O)购自美国CST公司;IL-1β ELISA 试剂盒(货号:CME0015)、TNF-α ELISA 试剂盒(货号:CME0004)购自北京四正柏生物科技有限公司;流式细胞仪(CytoFLEX)购自德国Beckman公司。
1.2 方法
1.2.1 小鼠原代腹腔巨噬细胞的分离及培养 6~8 周龄C57BL/6 小鼠腹腔注射1 ml 3%硫乙醇酸盐溶液,3 d 后,用预冷的PBS 洗出小鼠腹腔液,400 g、4 ℃离心10 min,重悬于10%DMEM 完全培养基中。在37 ℃、5%CO2培养箱中培养2 h 后,洗去悬浮细胞,余下的贴壁细胞即为原代腹腔巨噬细胞,更换为新鲜的10%DMEM 完全培养基,在培养箱中培养过夜。
1.2.2 原代腹腔巨噬细胞形态观察 使用倒置光学显微镜观察贴壁后的巨噬细胞形态;瑞氏-吉姆萨染色进一步观察细胞形态,原代巨噬细胞接种于细胞爬片,贴壁后弃上清,多聚甲醛固定,晾干,瑞氏-吉姆萨复合染液滴加于整个爬片上,加入等量PBS,充分混合,水洗,干燥,镜检。
1.2.3 原代腹腔巨噬细胞纯度检测 贴壁后的原代腹腔巨噬细胞使用胰酶消化,EP 管收集细胞悬液,PBS 洗3 次,适量PBS 重悬,加入5%体积的F4/80 抗体,避光4 ℃孵育30 min,PBS 洗3 次,200 µl PBS重悬,流式细胞仪检测。
1.2.4 PE Annexin-V/7-AAD 检测细胞焦亡 分离出原代腹腔巨噬细胞,接种于24 孔板,每孔细胞约1×105个。贴壁后培养基更换为无血清的DMEM,根据HUANG 等[14]的研究,确定LPS 的浓度和作用时间分别为500 ng/ml 和24 h。将巨噬细胞随机分为500 ng/ml LPS 24 h+3 mmol/L ATP 1 h、500 ng/ml LPS 24 h+3 mmol/L ATP 2 h、500 ng/ml LPS 24 h+3 mmol/L ATP 4 h 和500 ng/ml LPS 24 h+3 mmol/L ATP 6 h,4 mmol/L ATP、5 mmol/L ATP 和6 mmol/L ATP 分组同3 mmol/L ATP,之后使用Annexin-V/7-AAD试剂盒检测焦亡发生率。
1.2.5 实验分组及处理 确定ATP 作用的最适浓度及时间后,后续实验分为4 组:①control 组:差异贴壁的巨噬细胞培养基中加入无菌PBS 溶液;②LPS 组:500 ng/ml 的LPS 诱 导 巨 噬 细 胞24 h;③ATP 组:5 mmol/L 的ATP 刺 激 巨 噬 细 胞4 h;④LPS+ATP 组:500 ng/ml 的LPS 诱导24 h 后再加入5 mmol/L的ATP刺激4 h。
1.2.6 Western blot 检测细胞焦亡蛋白表达 各组细胞弃培养基,PBS 洗涤2 次,裂解细胞,收集蛋白。BCA 法检测蛋白浓度,采用SDS-PAGE 80 V 电泳20 min 后转120 V 电泳60 min,300 mA 转膜60 min,5%脱脂奶粉封闭1.5 h,TBST 洗膜3 次,15 min/次。分别用β-actin(1∶1 000)、GSDMD(1∶1 000)、caspase-1(1∶1 000)、caspase-11(1∶1 000)、NLRP3(1∶1 000)、IL-1β(1∶1 000)、IL-18(1∶1 000)、ASC(1∶1 000)和HMGB1(1∶1 000)一抗4 ℃孵育过夜。TBST 洗膜3 次,二抗室温孵育90 min,TBST 洗膜3 次,电化学发光法(ECL)检测蛋白条带。以目的蛋白与β-actin的灰度值比值表示目的蛋白表达水平。
1.2.7 ELISA 检测IL-1β和TNF-α的表达水平 收集各组细胞培养上清液,按照ELISA 试剂盒说明书操作,通过标准曲线计算各组上清液中IL-1β 和TNF-α含量。
1.2.8 电镜观察细胞焦亡形态 经LPS 和ATP 共同处理巨噬细胞后,弃去培养液,加入电镜固定液4 ℃固定2~4 h,1%锇酸、0.1 mol/L PBS(pH=7.4)室温(20 ℃)固定2 h,脱水,渗透,包埋,切片,染色,分别使用透射电子显微镜(TEM)和扫描电子显微镜(SEM)观察,采集图像分析。
1.3 统计学分析 通过GraphPad Prism 8.0 软件进行分析,组间差异比较采用One-Way ANOVA 分析,以P<0.05为差异有统计学意义。
2 结果
2.1 原代腹腔巨噬细胞形态 光学显微镜下可观察到分离出的原代腹腔巨噬细胞贴壁后多呈不规则、梭形或伪足状态。经瑞氏-吉姆萨染色后可观察到胞核大且染色呈紫蓝色,胞浆染色淡,呈浅蓝色,可见明显伪足(图1)。

图1 原代腹腔巨噬细胞形态Fig.1 Form of primary peritoneal macrophages
2.2 原代腹腔巨噬细胞纯度 F4/80 是小鼠巨噬细胞的表面标志,小鼠巨噬细胞的特异表型为F4/80+,可通过流式细胞术进行检测。结果显示分离出的原代腹腔巨噬细胞经差异贴壁法去除未贴壁的细胞后,其纯度可由50%升高至90%以上,完全可满足后续实验要求(图2)。
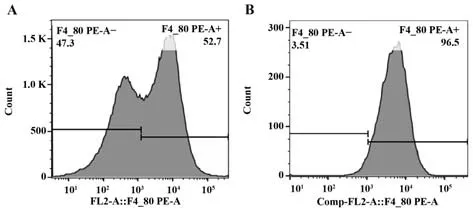
图2 原代腹腔巨噬细胞纯度Fig.2 Purity of primary peritoneal macrophages
2.3 不同剂量ATP 与LPS 对原代腹腔巨噬细胞焦亡的影响 结果显示经500 ng/ml LPS 刺激24 h 后再用ATP刺激4 h,巨噬细胞的焦亡发生率与ATP刺激的其他时间点具有明显差异,且以5 mmol/L ATP诱导巨噬细胞4 h 后焦亡发生率最高,以上结果证明500 ng/ml LPS 24 h+5 mmol/L ATP 4 h为诱导巨噬细胞焦亡的最佳刺激方案(图3)。

图3 不同浓度ATP诱导巨噬细胞焦亡Fig.3 Pyroptosis of macrophages induced by different concentrations of ATP
2.4 LPS 和ATP 共同作用后焦亡相关蛋白与炎症细胞因子的表达情况
2.4.1 焦亡相关蛋白表达水平 Western blot 检测焦亡相关蛋白表达水平,结果显示与空白对照组相比,LPS+ATP 组焦亡关键执行蛋白GSDMD、caspase-1、caspase-11、HMGB1、pro-IL-1β、pro-IL-18、NLRP3 和ASC 蛋白水平明显升高,且LPS 组的pro-IL-1β、pro-IL-18、ASC、caspase-11 和NLRP3蛋白水平明显高于空白对照组(图4)。
2.4.2 焦亡相关炎症细胞因子IL-1β 和TNF-α 表达水平 ELISA 检测培养上清中炎症细胞因子IL-1β 和TNF-α 的表达情况,与对照组相比,LPS 组和LPS+ATP 组中IL-1β 和TNF-α 表达水平均明显升高,差异有统计学意义,且ATP 组培养上清中的IL-1β含量也明显高于对照组(图5)。
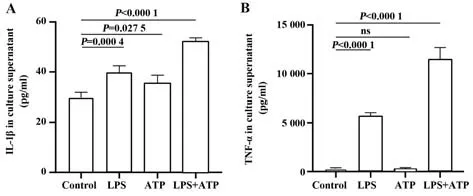
图5 细胞培养上清中IL-1β和TNF-α的表达水平Fig.5 Concentrations of IL-1β and TNF-α in cell culture supernatant
2.5 电镜观察细胞焦亡形态 电镜下可观察到LPS+ATP 组多数巨噬细胞呈焦亡状态,表现为细胞肿胀,细胞表面有破损。SEM 可观察到焦亡的巨噬细胞形态不规则,伪足(PS)大面积减少、退化,个别断裂;细胞膜大面积破损,大量细胞内容物释放至胞外,细胞周围可见游离细胞基质(CO),膜表面可见多处破损(图6A、B)。经TEM 观察可见焦亡细胞中度水肿,细胞核(N)呈近圆形,核固缩,局部核周隙增宽(图6C 黑色箭头处),线粒体(M)中度肿胀,基质溶解呈空泡状,粗面内质网(RER)明显扩张(图6C),细胞膜完整性被破坏(图6D黑色箭头处)。
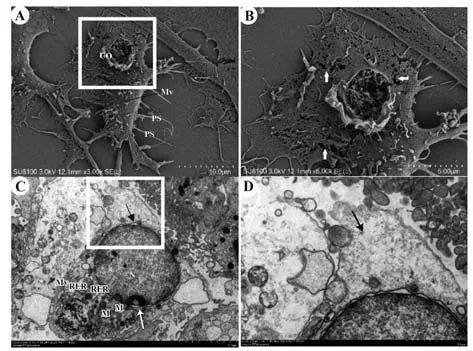
图6 电镜观察巨噬细胞焦亡形态Fig.6 Form of pyroptosis macrophages observed by electron microscope
3 讨论
脓毒症是感染性疾病严重的并发症,死亡率高达40%,LPS 是革兰阴性菌细胞壁的主要成分,免疫系统紊乱是脓毒症发生发展的主要机制,其中大量炎症细胞激活和促炎介质释放是免疫系统紊乱的重要原因,经证明TNF-α 和IL-1β 是脓毒症发病机制中的早期促炎介质,而高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是脓毒症发病机制中的晚期促炎介质,细胞焦亡的发生伴随大量炎症因子的释放,这种大量炎症因子释放的表现可能与脓毒症免疫系统紊乱相关[15-16]。目前针对脓毒症的治疗方案仍以控制感染、液体复苏及生命支持为主,尚缺乏有效的针对性治疗,因此细胞焦亡有望成为治疗脓毒症的突破口,而一个稳定可靠的体外细胞焦亡模型是研究其分子机制所必需的。
细胞焦亡可分为由caspase-1 激活的经典炎症小体焦亡途径和caspase-11 激活的非经典炎症小体焦亡途径。在经典炎症小体途径中,多种病原相关分 子 模 式(pathogen associated molecular patterns,PAMPs)和损伤相关分子模式(danger-associated molecular patterns,DAMPs)可激活炎症小体,进而活化caspase-1。目 前NOD 样 受 体 蛋 白3[nucleotidebinding domain(NOD)-like receptor protein 3,NLRP3]是研究最清楚的炎症小体之一,该炎症小体由模式识别受体(pattern recognition receptor,PRR)、凋亡相关斑点样蛋白[apoptosis-associated speck-like protein containing a Caspase-recruitment domain(CARD),ASC]和caspase-1组成。在非经典炎症小体途径中,通常是LPS 直接激活caspase-11 诱导焦亡发生,还可在NLRP3 和ASC 的共同作用下激活caspase-1[17]。邵峰院士及其团队在2015年提出GSDMD 是所有炎性caspase 的底物,是焦亡的关键执行蛋白,活化的caspase-1 可以切割多种底物,如GSDMD、pro-IL-1β和IL-18 前体(pro-IL-18),切割后的GSDMD 氨基末端(GSDMD-N)与细胞膜结合后形成孔洞,然后释放出成熟的IL-1β和IL-18[13,16,18-22]。
目前国内外研究焦亡机制使用的体外模型大多为LPS 和ATP 共同作用于巨噬细胞系诱导焦亡,巨 噬 细 胞 系 焦 亡 模 型 尤 以RAW264.7 为 主[11-13],RAW264.7 是小鼠单核巨噬细胞白血病细胞,其形态和功能都与原代巨噬细胞有一定的差异[23],而LPS和ATP 作用的时间和浓度多通过细胞活性和药物毒性确定,此方法虽然将药物的毒性作用控制到最低状态,但无法确定细胞焦亡的发生率[12]。根据细胞焦亡同时具有坏死和凋亡表型特征,即焦亡细胞表现为膜联蛋白-V(Annexin-V)和7-氨基放线菌素(7-aminoactinomycin,7-AAD)染色呈双阳性[24-25]。故本研究以小鼠原代腹腔巨噬细胞为主要研究对象,通过流式细胞术准确快速地检测模型构建过程中巨噬细胞焦亡的发生率,在确保LPS 对小鼠原代腹腔巨噬细胞的毒性作用最小的前提下,发现经500 ng/ml LPS 诱导24 h 后再使用5 mmol/L ATP 刺激4 h 为诱导小鼠原代腹腔巨噬细胞焦亡的最佳组合方式[14]。本研究发现LPS 组的NLRP3 和caspase-11与炎症相关蛋白及炎症细胞因子TNF-α、IL-1β和IL-18 明显高于control 组,焦亡关键蛋白caspase-1和GSDMD则无明显差异,此结果表明LPS成功诱导巨噬细胞炎症模型。在LPS+ATP 组中,不仅炎症相关的蛋白和细胞因子明显高于control 组,焦亡关键蛋白caspase-1 和GSDMD 也明显高于control 组,并且电镜下也观察到大量焦亡细胞,证明了焦亡模型构建成功。当LPS单独作用于巨噬细胞时引起了炎症反应,但caspase-1 和GSDMD 没有增高,当加入ATP 之后,caspase-1 和GSDMD 则显著升高,因此细胞焦亡的发生需要PAMPs 和DAMPs 共同作用,而caspase-1 的升高是受caspase-11 影响还是由于经典途径的激活仍需进一步研究。
综上,本研究在LPS 刺激小鼠原代腹腔巨噬细胞诱导炎症反应后加入ATP 成功建立了稳定的焦亡模型,为后续研究脓毒症免疫细胞焦亡的分子机制提供成熟的体外细胞模型。
