活血化湿汤通过靶向TP53 抑制M2 巨噬细胞极化与非小细胞肺癌细胞的侵袭①
2023-11-13高莉萍赵兰婷石军年兰州大学第二医院呼吸内科兰州730030
高莉萍 赵兰婷 冯 倩 石军年 (兰州大学第二医院呼吸内科,兰州 730030)
非 小 细 胞 肺 癌(non-small cell lung cancer,NSCLC)是肺癌病理学分类的一种,也是其中最常见的亚型,预后差[1]。中药对癌症的治疗作用已被广泛认同,目前已发现多种单味中药或复方汤剂对NSCLC 具有良好的治疗作用[2]。如石泉玉珍汤抑制NSCLC 血管生成和肿瘤生长,促进免疫应答[3]。在中医的范畴内,NSCLC 属于“咳嗽、肺积、息贲”等,诸多国医大师均认为NSCLC 的发病不离肺脾,治法不离益气化湿[4]。活血化湿汤由白茅根、白术、赤芍、赤小豆、大黄、党参、茯苓、红花、益母草、茵陈、玉米须、泽兰、栀子等组成,已经通过临床试验,对晚期肝癌黄疸具有良好的治疗效果[5]。但对NSCLC的治疗是否有效有待商榷。中医方剂成分复杂,具有多作用途径和多靶点的特征,而网络药理学能通过构建药物-靶点-疾病网络,相对系统地将多种成分、多种靶点的复杂特性展示出来,对药物、靶点和疾病的相互作用进行分析[6]。本研究拟采用网络药理学方法,构建活血化湿汤-靶点-NSCLC 的相互作用网络,分析活血化湿汤对NSCLC 的治疗作用及潜在靶点,为开发新药提供理论和基础实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 10 周龄清洁级雄性SD 大鼠10 只,体质量300~350 g,由兰州大学实验动物中心提供,许可证号:SCXK(甘)2018-0002。大鼠常规饲养,阴暗/光照各12 h,自由摄食和饮水,每3 d 更换饲料和饮用水。本研究经兰州大学第二医院动物伦理委员会审批(批号:D2021-083)。
1.1.2 主要试剂及仪器 活血化湿汤(基本方包括白茅根20 g、白术20 g、赤芍30 g、赤小豆20 g、大黄10 g、党参30 g、茯苓20 g、红花10 g、益母草10 g、茵陈30 g、玉米须20 g、泽兰10 g、栀子10 g)由兰州市中医院熬制并制备为含生药1 g/ml 的药液,冷却后置于-20 ℃备用;BEAS-2B 细胞(CL-0496)、NCIH1299细胞(CL-0165)、THP-1细胞(CL-0233)、RPMI-1640 培养基(PM150110)、PBS(PB180327)均购自武汉普诺赛生命科技有限公司;引物设计由南京金斯瑞制作合成;转染质粒购自上海吉玛基因;佛波酯(Phorbol 12-myristate 13-acetate,PMA)(70-CS1001)购自杭州联科生物技术有限公司;PE标记的CD206抗体(321105)、FITC 标记的CD86 抗体(374203)均购自BioLegend(北京)生物科技有限公司;ECL 显影试剂(P0018S)购自上海碧云天生物技术有限公司;IL-1β ELISA 试剂盒(E-EL-H0149c)和CCL18 ELISA 试剂盒(E-EL-H1270c)均购自武汉伊莱瑞特生物科技股份有限公司;结晶紫染液(C8470)和Matrigel 基质胶(356234)均购自北京索莱宝;Lipofectamine 3000转 染 试 剂(L3000007)、分 光 光 度 计(NanoDrop 2000)、Real Time PCR 系统(ABI 7500)均购自Thermo Fisher;TRIzol 试剂盒(15596-026)购自Invitrogen;PrimeScript RT 试剂盒(RR036A)、SYBR Premix ExTap Ⅱ试 剂 盒(RR820A)购 自TaKaRa;TP53(ab179477)、GAPDH(ab181602)和IgG(ab6721)抗体均购自英国Abcam;流式细胞仪(LSRFortessa)购自美国BD 公司;酶标仪(SynergyHT)购自美国Bio Tek 公司;显微镜(DM2000)购自徕卡显微系统公司。
1.2 方法
1.2.1 中药有效成分及靶点的获取 在TCMSP 数据库(https://tcmsp-e.com)中检索活血化湿汤的主要组成:白茅根、白术、赤芍、赤小豆、大黄、党参、茯苓、红花、益母草、茵陈、玉米须、泽兰、栀子的有效活性成分及作用靶点,检索条件设置为:口服生物利用度(Oral bioavailability,OB)≥30%,类药性(Drug-Likeness,DL)≥18。使用Uniprot数据库(https://www.uniprot.org)对靶点名称进行归一化处理,统一以基因名表示,同时删除无法转化的靶点并去掉重复靶点。
1.2.2 NSCLC相关风险基因的筛选 借助Malacards数据库(https://www.malacards.org)和DisGeNET 数据库(https://www.disgenet.org/search)查找NSCLC发病风险基因,将两个网站的结果进行综合及去重复处理。
1.2.3 核心靶基因筛选 将NSCLC 的发病风险基因与活血化湿汤的潜在作用靶基因利用Evenn 在线工具(http://www.ehbio.com/test/venn/#/)取交集,将得到的交集在STRING 网站(https://string-db.org/)中进行蛋白互作分析。
1.2.4 活血化湿汤含药血清的制备 选用健康10 周龄雄性SD 大鼠10 只,体质量300~350 g,适应性喂养7 d 后,依据“动物和人体表面积折算的等效剂量”对大鼠进行灌胃,灌胃剂量为10.8 g/(kg·d),2 次/d。采血前使大鼠空腹禁食12 h,末次灌胃2 h后采用3%戊巴比妥钠麻醉大鼠并断颈处死,取大鼠腹主动脉血,每只大鼠取血8 ml,采集的血液置于37 ℃水箱内水浴20 min,之后以3 000 r/min 离心20 min,去上清,过滤并除菌后置于-20 ℃备用。
1.2.5 MTT 法检测活血化湿汤对NSCLC 细胞的最佳干预浓度和时间 取5×103个处于对数生长期的NCI-H1299 细胞置于96 孔板,在37 ℃、5%CO2条件下培养24 h 后加入浓度为5%、10%、20%的含药血清各1 ml,同时设置加入等量PBS 的对照组。培养12 h、24 h和48 h后去除含药血清培养液,加入100 µl MTT 试 剂,振 荡 混 匀 后10 min 内 上 酶 标 仪 测 定570 nm处吸光度,统计并分析细胞增殖活力。
1.2.6 细胞培养和处理 将THP-1细胞、人正常支气管上皮细胞系BEAS-2B、人NSCLC 细胞系NCIH1299 置于含10%胎牛血清的RPMI1640 培养基中培养,培养条件:37 ℃、5%CO2。THP-1 细胞向巨噬细胞的诱导借助100 nmol/L PMA 完成,诱导时间48 h,之后收集THP-1 细胞并将其命名为M0 巨噬细胞用于后续研究。M0 巨噬细胞分别以PBS、活血化湿汤、活血化湿汤+TP53 过表达载体处理(TP53 过表达载体转染24 h 后再以活血化湿汤处理48 h)。TP53 过表达载体的转染参照Lipofectamine 3000 试剂盒说明书完成。
1.2.7 qRT-PCR 检测mRNA 表达 TRIzol 试剂盒提取总RNA,NanoDrop 2000 分光光度计以及Prime-Script RT 试剂盒分别用于总RNA 浓度测定和逆转录操作执行。之后以反转录得到的cDNA 为样本,借助SYBR Premix ExTap Ⅱ试剂盒完成PCR 反应,并结合7500 实时PCR 系统完成操作,反应条件为95 ℃ 5 min,95 ℃ 15 s,60 ℃ 1 min,循 环40 次。GAPDH 作为内参。TP53 正向引物:5'-GTTATGAGCTATCGCGCTATA-3',反向引物:5'-AATAGGCTTAGAGATATTGA-3';GAPDH 正 向 引 物:5'-GGTTCTCTCTCAGCCCATCAAGT-3',反向引物:5'-ACCTCGTGCACCTAAGTGTGCAA-3'。应用2-ΔΔCt法计算TP53的相对表达量。
1.2.8 Western blot 检测蛋白表达 RIPA 裂解液对细胞进行裂解,并借助BCA 试剂盒完成蛋白浓度的测定。取20 µg蛋白行SDS-PAGE凝胶电泳,转膜后使用5%脱脂奶粉封闭1 h。加入TP53(1∶10 000)、GAPDH(1∶2 500)一抗4 ℃孵育过夜。隔天TBST 洗膜,加入HRP 标记的山羊抗兔IgG 二抗(1∶2 000)室温孵育1 h。膜上加入ECL 显影试剂使蛋白条带可视化,Image J软件测定蛋白条带灰度值。
1.2.9 流式细胞术检测M1 型(CD86)和M2 型(CD206)巨噬细胞标志物表达 将M0 巨噬细胞以1×105个/孔接种于24 孔培养板,使用PBS、活血化湿汤、活血化湿汤+转染过表达TP53处理后收集细胞,使用PE 标记的CD206 与FITC 标记的CD86 抗体与细胞共孵育30 min 后,转移至流式细胞仪上分析,计算阳性细胞比例。
1.2.10 ELISA 检测IL-1β、CCL18 的浓度 收集PBS 组、活血化湿汤组、活血化湿汤+TP53 组巨噬细胞上清,以3 500 r/min 离心5 min 后,ELISA 法测定细胞上清中IL-1β、CCL18的浓度。首先在对应组细胞孔板中加入100 µl标准品,37 ℃孵育90 min,去除板内液体并加入100 µl 生物素化抗体工作液,37 ℃孵育60 min,洗板。之后每孔加入100 µl 的HRP 酶结合物工作液,37 ℃孵育30 min并洗板。加入90 µl底物溶液,37 ℃孵育15 min 后加入50 µl 终止液,酶标仪测定450 nm处OD值。
1.2.11 Transwell 检测细胞侵袭 在Transwell 小室上室预涂1 层Matrigel 胶,将1×105个NCI-H1299细胞接种于上室,下室加入含胎牛血清的培养基进行诱导。此外,将NCI-H1299 细胞和不同条件(PBS、活血化湿汤)处理的巨噬细胞共培养,以1∶1比例混合并分别接种于上室,下室同样加入胎牛血清培养基诱导。24 h 后多聚甲醛固定细胞,结晶紫染色,显微镜对侵袭细胞进行观察和计数。
1.3 统计学分析 所有计量资料采用SPSS23.0软件进行分析,以±s表示。采用t检验分析两组间数据差异,单因素方差分析比较多组间数据差异。P<0.05为差异具有统计学意义。
2 结果
2.1 活血化湿汤含药血清对NSCLC 细胞的最佳干预浓度和时间 MTT检测结果显示,相对于PBS组,活血化湿汤组各浓度梯度细胞活性均降低(均P<0.05),其中,10%活血化湿汤干预组的细胞活性最低。此外,活血化湿汤处理24 h 的细胞增殖活力显著低于12 h 和48 h(均P<0.05),提示活血化湿汤对NSCLC 细胞的最佳干预浓度和时间分别为10%和24 h。见图1。
2.2 活血化湿汤的有效活性成分及靶基因筛选TCMSP 数据库检索“活血化湿汤”组成药物的有效活性成分及靶基因发现,白茅根活性成分7种、靶蛋白83种;白术活性成分7种、靶蛋白23种;赤芍活性成分29 种、靶蛋白151 种;赤小豆活性成分5 种、靶蛋白39种;大黄活性成分16种、靶蛋白110种;党参活性成分21种、靶蛋白213种;茯苓活性成分15种、靶蛋白30种;红花活性成分22种、靶蛋白439种;益母草活性成分8 种、靶蛋白320 种;茵陈活性成分13 种、靶蛋白362 种;玉米须活性成分12 种、靶蛋白119 种;泽兰活性成分2 种、靶蛋白62 种;栀子活性成分15 种、靶蛋白356 种。经Uniprot 数据库转换,去除重复基因,共得到217个靶基因,采用Cytoscape将靶基因可视化,构建药物-靶点互作用网络(附图1,www.immune99.com)。
2.3 核心靶基因的筛选 在Malacards与DisGeNET网站中查询NSCLC的发病风险基因,分别得到46个和107 个NSCLC 的发病风险基因,数据经过综合去重后得到131个风险基因。将风险基因与活血化湿汤的靶基因取交集,得到17 个交集基因(附图2,www.immune99.com)。将这17 个靶基因上传至STRING 网站与Cytoscape 进行蛋白互作分析,结果显示TP53与其他基因的交互作用最强,可能对其他基因的表达产生影响(图2)。
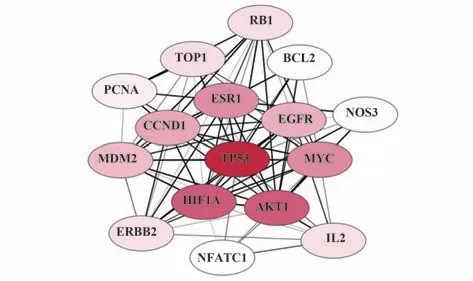
图2 核心靶基因的筛选结果Fig.2 Screening results of core target genes
2.4 活血化湿汤能抑制TP53 在NSCLC 中的高表达 GEPIA 网站中显示,相较于正常肺组织,TP53表达在肺腺癌(lung adenocarcinoma,LUAD)与肺鳞癌(lung squamous cell carcinoma,LUSC)组织中均上调(图3A)。本研究选择NCI-H1299 细胞进行研究,并检测细胞中TP53 的表达发现,NCI-H1299 细胞中TP53 表达较正常支气管上皮细胞BEAS-2B 显著上调,但经活血化湿汤处理后的NCI-H1299 细胞中TP53表达下调(均P<0.05,图3B~D)。

图3 活血化湿汤抑制TP53在NSCLC中的表达Fig.3 Huoxue Huashi Decoction inhibits expression of TP53 in NSCLC
2.5 活血化湿汤通过降低TP53 的表达抑制M2 巨噬细胞极化 使用活血化湿汤处理M0 巨噬细胞,观察巨噬细胞向M2 和M1 型巨噬细胞极化的趋势。流式分析显示,活血化湿汤处理后CD86 阳性细胞百分比上调,CD206阳性细胞百分比下调,在细胞中转染TP53过表达载体后,CD86阳性细胞百分比下调,CD206 阳性细胞百分比上调(均P<0.05,图4A、B)。同时,活血化湿汤处理后M1 巨噬细胞相关因子IL-1β 浓度升高,M2 巨噬细胞相关细胞因子CCL18浓度降低,转染TP53 过表达后,以上数据被部分逆转(图4C)。提示活血化湿汤抑制了巨噬细胞向M2方向的转化,促进向M1方向转化,而过表达TP53能部分削弱活血化湿汤的作用。
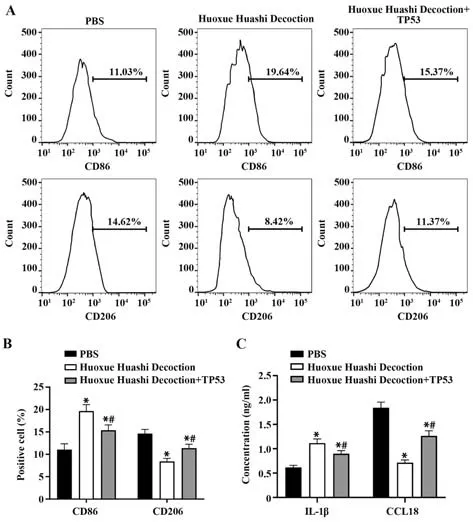
图4 活血化湿汤通过抑制TP53 表达进而降低M2 型巨噬细胞极化Fig.4 Huoxue Huashi Decoction reduces M2-type macrophage polarization by inhibiting expression of TP53
2.6 活血化湿汤通过抑制TP53表达抑制NCI-H1299细胞侵袭 Transwell 结果表明,活血化湿汤处理后的NCI-H1299 细胞侵袭数量显著减少,但过表达TP53 后侵袭数量有所增多(均P<0.05,图5A)。将不同条件处理的巨噬细胞与NCI-H1299 细胞共培养,结果发现经活血化湿汤处理后的巨噬细胞能显著抑制NCI-H1299 细胞的侵袭,在NCI-H1299 细胞中过表达TP53 能部分抵消以上作用(均P<0.05,图5B)。提示活血化湿汤可通过抑制TP53 进而抑制M2 巨噬细胞极化,从而抑制NCI-H1299 细胞侵袭。本研究机制图见图5C。
3 讨论
网络药理学以系统生物学为基础,强调从药物靶点出发促进药物治疗效果的提高,对促进药物实验的成功率以及降低研发经费均具有重要意义[7]。本文首先通过网络药理学方法筛选活血化湿汤治疗NSCLC 的主要潜在靶点,首先选出TP53。TP53是一种肿瘤突变蛋白质,该蛋白在癌症中普遍发生突变[8]。LUO 等[9]发现在斑马鱼中,肝脏特异性PTEN 和TP53突变之间的合作在遗传上能诱导肝癌发生。WAN 等[10]发现在血管肉瘤标本中TP53 免疫染色显著升高。关于NSCLC 的研究揭示了耐药NSCLC 细 胞 中TP53 的 表 达 升 高[11]。本 研 究 通 过GEPIA 网站预测到TP53 在LUAD 与LUSC 组织中表达均上调;qRT-PCR 发现在NSCLC 细胞系NCIH1299 细胞中TP53 表达也较正常细胞显著上调,活血化湿汤可抑制TP53表达,初步确认活血化湿汤可能靶向TP53在NSCLC中发挥潜在作用。
巨噬细胞源于单核细胞,被证实是细胞免疫调控中非常重要的因素[12]。巨噬细胞在功能上存在异质性,主要分为M1 和M2 两个亚群,M1 型巨噬细胞仍具有抗原递呈能力,可促进Th1反应,与抗肿瘤有关;而M2 型巨噬细胞则具有促进肿瘤活性作用[13]。在癌症早期,机体内趋化因子诱导巨噬细胞向M1 转化,发挥机体免疫作用,当癌症达到进展期,会促使M2 型细胞转化来抑制免疫反应,促进肿瘤进展[14]。此外,M2型巨噬细胞也被证实能够参与肝癌细胞的恶性生物学进展[15]。CD86 和CD206 分别为肿瘤M1 型和M2 型巨噬细胞的特异性标志物,其状态的改变与肿瘤的迁移和侵袭等存在密切关联[16-17]。IL-1β 是M1 型巨噬细胞的标志基因,与癌细胞的侵袭转移有关[18]。而CCL18 是M2 型巨噬细胞标志物,与癌细胞的恶性行为及癌症患者的预后不良存在关联[19-20]。本研究发现活血化湿汤能抑制NSCLC 中M2 型巨噬细胞活化,进而抑制癌细胞的侵袭能力,且该作用被TP53 部分逆转,进一步说明活血化湿汤通过TP53发挥对M2巨噬细胞活化与癌细胞侵袭的抑制作用。
本研究通过网络药理学初步预测出活血化湿汤调控TP53,又进一步通过细胞实验证实该猜测,并证明了活血化湿汤可通过TP53 抑制NSCLC 中M2 型巨噬细胞极化与癌细胞侵袭能力。但本研究未使用动物实验进行验证,结果可能存在差异,需要进一步研究验证。综上,本研究证实了活血化湿汤对NSCLC发展的抑制作用,为NSCLC的治疗提供了新的方案和药物治疗靶点。
