富马酸二甲酯调节巨噬细胞极化状态对原发免疫性血小板减少症小鼠的治疗效果①
2023-11-13宋传龙焦红杰海力其古丽努日丁
宋传龙 焦红杰 海力其古丽·努日丁 赵 莉 严 媚
(新疆医科大学第一附属医院儿内一科,乌鲁木齐 830054)
免疫性血小板减少症(immune thrombocytopenia,ITP)是一种常见的获得性自身免疫性疾病,其特征是抗血小板自身抗体介导的血小板生成减少和血小板破坏增加,导致血小板计数降低。ITP 患者出血表现出高度异质性,皮肤黏膜出血是最常见的临床表现,严重时可出现内脏或颅内出血,危及患者生命[1-2]。近年来,国内外均对ITP 进行了大量研究,但其发病机制和病理生理学过程仍未完全阐明,在一定程度上限制了ITP 治疗方法的开发。目前,大多数ITP 患者需要进行脾切除术或长期使用糖皮质激素、血小板生成素以及免疫抑制剂等进行治疗,但一些患者治疗无效、治疗后复发等问题使上述方法未取得理想效果[3]。因此,寻找新型安全的ITP有效疗法或药物是当前研究的重点内容。
富马酸二甲酯(dimethyl fumarate,DMF)是一种富马酸甲酯,作为工业化学中常用的化合物,价格低廉且易于获得,具有抗氧化、抗炎、抗肿瘤、神经保护和免疫调节等特性,长期摄入不会产生严重的副作用,已被批准和注册用于治疗银屑病和复发缓解型多发性硬化[4-5]。此外,DMF已显示出调控细胞多种生物学过程和信号转导的作用[6]。鉴于ITP 作为一种自身免疫性炎症性疾病以及DMF 在治疗免疫性疾病中的潜在作用,已有研究报道表明DMF 显著抑制了抗血小板抗体诱导的血小板破坏,从而对ITP 小鼠起到了一定的改善作用,但该作用的具体机制尚未明确[7]。本研究通过诱导构建ITP 小鼠模型,进一步评估DMF 是否可以改善或抑制ITP 小鼠模型中血小板减少,测定血常规指标、细胞因子水平、脏器指数、脾脏与股骨内巨核细胞等变化情况,并探究ITP 小鼠巨噬细胞极化状态,较为综合地探讨DMF 对ITP 的效果及作用机制,为临床合理用药提供理论支持。
1 材料与方法
1.1 材料
1.1.1 实验动物 实验用BALB/c 小鼠共60 只,雌雄各半,8周龄,体质量18~20 g,豚鼠共6只,雌雄各半,体质量220~250 g,均饲养于SPF 级动物饲养实验室内,室温为22~26 ℃,相对湿度45%~55%,光照周期12 h/12 h 明暗交替,期间自由饮食饮水,所用饲料、水及垫料均经高温高压消毒处理。本研究经新疆医科大学第一附属医院伦理委员会审核通过(伦理审批号:20211215-07)。
1.1.2 主要试剂 DMF、完全弗氏佐剂和不完全弗氏佐剂购于美国Sigma 公司;IFN-γ、IL-2、IL-4、IL-10、IL-17 及TGF-β1 ELISA 测定试剂盒购于上海瑞齐生物技术公司;HE 染色试剂盒购于北京百奥莱博科技公司;免疫荧光染色试剂盒和DAPI 染液购于上海碧云天生物研究所;鼠抗CD68 单克隆抗体、鼠抗F4/80-PE 单克隆抗体、鼠抗CD86-PE 单克隆抗体、鼠抗CD206-FITC单克隆抗体及生物素标记的山羊抗兔IgG抗体购于英国Abcam公司。
1.2 方法
1.2.1 ITP 模型构建 参考文献[8]制备豚鼠抗BALB/c 小鼠血小板血清(GP-APS),通过腹腔注射GP-APS 建立ITP 小鼠模型。将BALB/c 小鼠置于含乙醚的环境中麻醉,摘眼球取血,以乙二胺四乙酸二钠抗凝,离心分离出血小板,利用0.9%氯化钠稀释;将分离的血小板分别与等量完全弗氏佐剂和不完全弗氏佐剂混合,以此作为抗原,注射开始记为0 周,将含完全弗氏佐剂抗原注射于豚鼠足掌、背部、腹部及皮下,每次至少4 点,在第1、2、4 周,将含不完全弗氏佐剂抗原注射于相同部位,每次至少4 点。第5 周,通过豚鼠心脏采集全血,置于离心机以1 500 r/min 离心10 min,收集上清,即为GP-APS,检测抗血清效价及最佳稀释浓度,贮存于-20 ℃冰箱。小鼠适应性饲养1 周后,将GP-APS 置于56 ℃水浴锅内孵育30 min,用0.9%氯化钠按照1∶4 的比例稀释GP-APS,取需要构建ITP模型的小鼠,于1 d、3 d、5 d、7 d、9 d、11 d、13 d,分别腹腔注射100 µl稀释后的GP-APS,使小鼠血小板持续性降低。同时,对照组小鼠腹腔注射等体积0.9%氯化钠,造模第2、4、6、8、10、12、14 天,采集小鼠静脉血,全自动血液分析仪测定血小板数目。
1.2.2 实验分组与给药 实验分为对照组、ITP组、DMF 低剂量组和DMF 高剂量组,每组15 只小鼠。ITP 组、DMF 低剂量组和DMF 高剂量组的小鼠均构建ITP 模型。建模成功后,DMF 低剂量组和DMF 高剂量组小鼠分别按10 mg/kg、20 mg/kg 剂量灌胃DMF 进行处理,1 次/d,连续14 d。对照组和ITP 组同时以等量0.9%氯化钠灌胃,1 次/d,连续14 d。
1.2.3 外周血血常规测定 给药结束后,各组小鼠均通过腹腔注射10%水合氯醛进行麻醉后,剪尾收集外周血,采用全自动动物血液分析仪检
测小鼠血小板(PLT)、红细胞(RBC)、白细胞(WBC)以及血红蛋白(Hb)水平。
1.2.4 ELISA 法 心脏采血法收集各组小鼠外周血,室温静置2 h,4 000 r/min 离心5 min,收集上清,ELISA 法测定血清内细胞因子IFN-γ、IL-2、IL-4、IL-10、IL-17及TGF-β1的水平变化,严格按照试剂盒说明书进行。用酶标仪在450 nm 处检测OD 值,绘制标准曲线,计算各细胞因子含量。
1.2.5 脏器指数测定 实验后,电子天平称取各组小鼠体质量,取血结束后处死小鼠,无菌环境下剥离胸腺组织和脾脏组织,称量胸腺组织与脾脏组织的质量,计算脾脏指数与胸腺指数。计算公式为:胸腺指数=胸腺质量(mg)/体质量(g);脾脏指数=脾脏质量(mg)/体质量(g)。
1.2.6 HE 染色 处死各组小鼠,剥离脾脏组织与右侧股骨组织,清洗干净后,4%多聚甲醛固定。将股骨组织置于10%硝酸中脱钙处理2 h。将固定好的脾脏组织与脱钙固定的骨髓组织进行常规石蜡包埋,切成厚度约为4 µm的组织切片,脱蜡脱水,苏木精染液染色5 min,1%盐酸乙醇分化数秒,伊红染液染色30 s,梯度乙醇脱水,二甲苯透明,中性树胶封片,于光学显微镜下观察组织内巨核细胞,摄取图像,计数每个载玻片的5 个随机不同区域内巨核细胞数目,计算平均值。
1.2.7 免疫荧光染色 取制备的对照组、ITP 组和DMF 高剂量组小鼠脾脏组织石蜡切片,通过二甲苯脱蜡与梯度乙醇脱水后,浸入柠檬酸溶液中置于微波炉高温加热修复抗原12 min,冷却后用PBS洗涤,加入0.3% TritonX-100 置于37°C 下孵育15 min,使用5%山羊血清室温封闭1 h,将稀释后的CD68 和CD86或CD206(1∶500)滴在切片上进行标记,4 ℃孵育过夜;第2 天,PBS 洗涤切片后,加入稀释后的TRITC 标记山羊抗兔IgG(1∶500),室温避光孵育1 h,PBS 洗涤后,加入DAPI 复染细胞核10 min,使用抗猝灭剂封片,在荧光显微镜下观察,每张切片随机选择5 个不同视野摄取图像,计数标记的阳性细胞与总细胞,计算阳性表达水平,结果取平均值。
1.2.8 流式细胞术 将对照组、ITP组和DMF高剂量组小鼠的外周血置于经抗凝处理的试管内,在离心机中以4 000 r/min 离心10 min,留沉淀,并加入PBS 稀释混匀,根据单核细胞分离液试剂盒说明书进行操作,分离获得单核细胞,接种于6 孔板中,置于37 ℃、5%CO2培养箱培养,每隔2 d换液1次,收集培养1 周的细胞。取培养的单核细胞,PBS 洗涤,加入PE 标记的流式抗体F4/80、CD86 或FITC 标记的流式抗体CD206,混合均匀,置于4 ℃孵育30 min,PBS 洗涤后离心,加入适量的PBS 重悬,将获得的细胞悬液上流式细胞仪进行检测,记录各标记阳性细胞所占比例。
1.3 统计学分析 使用SPSS23.0统计学软件分析实验数据,以GraphPad Prism 8.30 软件绘制统计图。计量资料均以±s表示。两组数据比较采用t检验,多组重复测量数据比较采用单因素方差分析,组内两两数据比较采用LSD-t法,P<0.05表示差异具有统计学意义。
2 结果
2.1 各组小鼠外周血血常规比较 造模开始后,统计对照组和ITP 组不同时间点外周血PLT 数量,结果显示,与对照组比较,ITP 组小鼠PLT 数量呈下降趋势,同一时间点差异均具有统计学意义(P<0.05),说明造模成功,见图1。各组小鼠外周血PLT、RBC、WBC 及Hb 检测结果显示,与对照组比较,ITP 组小鼠PLT、RBC 及Hb 明显下降,WBC 明显升高(P<0.05);与ITP 组比较,DMF 低剂量组小鼠PLT 明显升高,WBC 明显下降(P<0.05),而RBC 与Hb 变化差异无统计学意义(P>0.05);与ITP 组比较,DMF高剂量组小鼠PLT、RBC及Hb均明显升高,WBC明显下降(P<0.05),见表1。
表1 各组小鼠外周血血常规比较(±s,n=15)Tab.1 Comparison of peripheral blood routine of mice in each group (±s, n=15)
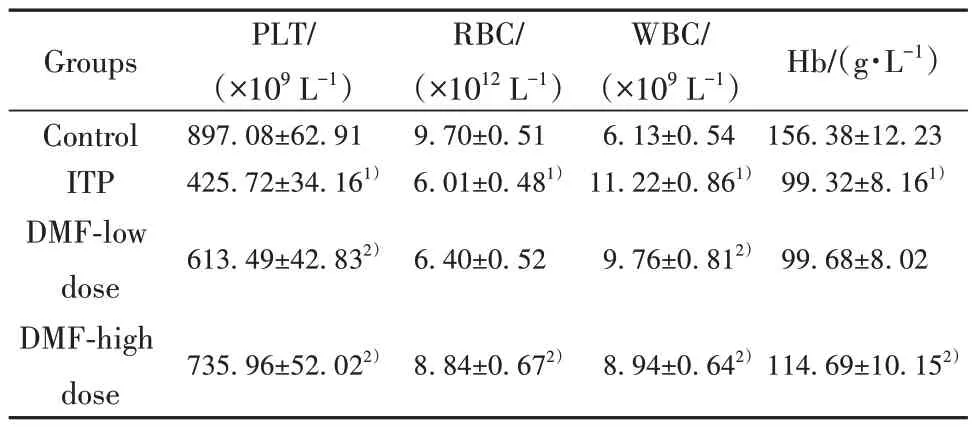
表1 各组小鼠外周血血常规比较(±s,n=15)Tab.1 Comparison of peripheral blood routine of mice in each group (±s, n=15)
Note:Compared with control group, 1)P<0.05; compared with ITP group, 2)P<0.05.
Groups Control ITP DMF-low dose DMF-high dose PLT/(×109 L-1)897.08±62.91 425.72±34.161)613.49±42.832)RBC/(×1012 L-1)9.70±0.51 6.01±0.481)Hb/(g·L-1)156.38±12.23 99.32±8.161)6.40±0.52 WBC/(×109 L-1)6.13±0.54 11.22±0.861)9.76±0.812)99.68±8.02 735.96±52.022)8.84±0.672)8.94±0.642)114.69±10.152)

图1 造模后不同时间点小鼠外周血PLT计数情况Fig.1 PLT counts in peripheral blood of mice at different time points after modeling
2.2 各组小鼠血清细胞因子水平比较 ELISA 测定各组小鼠血清细胞因子IFN-γ、IL-2、IL-4、IL-10、IL-17 及TGF-β1 水平,检测结果显示,与对照组比较,ITP 组血清中IFN-γ、IL-2 与IL-17 均明显升高,TGF-β1、IL-4 与IL-10 则明显下降(P<0.05);相较于ITP 组,DMF 低剂量组和DMF 高剂量组的血清中IFN-γ、IL-2 与IL-17 均明显下降,TGF-β1、IL-4 以及IL-10明显升高(P<0.05),见图2。
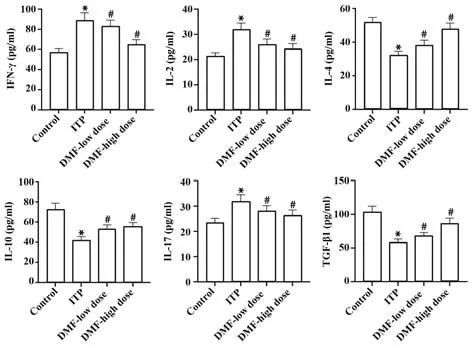
图2 各组小鼠血清细胞因子水平比较Fig.2 Comparison of serum cytokine levels of mice in each group
2.3 各组小鼠脏器指数比较 在实验后测定各组小鼠脾脏指数与胸腺指数,检测结果显示,ITP 组脾脏指数较对照组脾脏指数明显升高(P<0.05);与ITP 组比较,DMF 低、高剂量组脾脏指数均明显降低(P<0.05)。而各组小鼠的胸腺指数之间差异均无统计学意义(P>0.05),见图3。
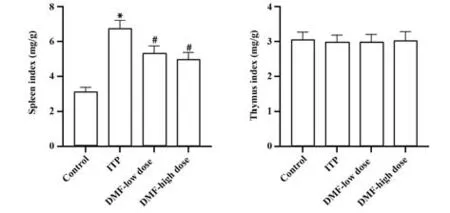
图3 各组小鼠脾脏指数与胸腺指数比较Fig.3 Comparison of spleen index and thymus index of mice in each group
2.4 各组小鼠脾脏组织和股骨组织HE 染色结果HE 染色观察各组小鼠脾脏组织和股骨组织内巨核细胞数目变化,结果如图4所示,对照组脾脏组织和股骨组织结构完整,未见明显异常;ITP 组小鼠脾脏组织形态紊乱,股骨和脾脏红髓中巨核细胞数目明显增多,且胞体异常增大,形态不规则;DMF 低、高剂量组小鼠中巨核细胞增多现象较ITP 组小鼠有所改善,形态结构也趋于正常。

图4 HE 染色观察各组小鼠脾脏与股骨内巨核细胞数目Fig.4 HE staining to observe numbers of megakaryocytes in spleen and femur tissues of mice in each group
2.5 各组小鼠脾脏组织内巨噬细胞极化情况比较 免疫荧光染色检测各组小鼠脾脏组织内巨噬细胞表型表达,结果如图5所示,与对照组比较,ITP组脾脏组织内CD68+CD86+阳性表达率升高,CD68+CD206+阳性表达率降低,差异具有统计学意义(P<0.05);与ITP 组比较,DMF 组脾脏组织内CD68+CD86+阳性表达率降低,CD68+CD206+阳性表达率升高,差异具有统计学意义(P<0.05)。
2.6 各组小鼠外周血巨噬细胞极化情况比较 流式细胞术检测结果显示,相较于对照组,ITP 组外周血F4/80+CD86+标记细胞比例明显升高,F4/80+CD206+标记细胞比例则明显降低,差异具有统计学意 义(P<0.05);而相 较于ITP 组,DMF 组F4/80+CD86+标记细胞比例明显降低,F4/80+CD206+标记细胞比例则明显升高,差异具有统计学意义(P<0.05),见图6。

图6 流式细胞术检测各组小鼠外周血巨噬细胞极化情况Fig.6 Flow cytometry to detect polarization of peripheral blood macrophages in mice in each group
3 讨论
ITP 的发生发展和发病机制非常复杂,涉及多种因素,一方面,自身抗体免疫球蛋白G以血小板糖蛋白为靶标形成抗原抗体复合物时,通过Fc受体被脾网状内皮系统中的巨噬细胞所吞噬;另一方面,除血小板自身抗体外,细胞免疫功能障碍也在ITP的发病中起关键作用,包括T 细胞、B 细胞和抗原呈递细胞,作为免疫应答调节细胞,T 细胞或相关细胞因子的分化以及功能障碍均与ITP 密切相关[9]。严重的ITP 及其并发症也是引起患者死亡的主要原因,此外,ITP 患者通常表现为预后不良[3]。尽管血小板输注是一种常用的临床治疗方法,但该方式并不是ITP 的有效治疗方法,此外,手术切除脾、糖皮质激素、免疫抑制剂等单独或联合应用于ITP 均未获得理想效果。
DMF 作为富马酸酯组合而成的药物,其临床特点是副作用相当轻微,这使得其成为一种潜在的耐受性良好药物,目前,已有大量研究指出DMF 在多种疾病中发挥调控作用,例如,DMF 通过抑制神经胶质细胞中NOS、IL-1β和IL-6等炎症细胞因子的表达来发挥抗炎作用[10];DMF 不仅能诱导结肠癌的细胞凋亡和坏死性凋亡[11],还能够通过激活SOCS3/JAK1/STAT3信号通路抑制肝细胞癌细胞增殖、血管生成以及自噬,从而起到一定的抗肿瘤作用[12];此外,DMF 还被广泛用作抗氧化剂和抗炎剂,用于治疗多种自身免疫性疾病,例如,DMF 通过激活多发性硬化中的核因子Nrf2 通路发挥抗炎作用,还可以通过抑制NF-κB 通路调节固有性免疫反应和适应性免疫反应[13]。考虑到ITP 也是一种自身免疫性疾病,而国内外关于DMF 在ITP 中的作用研究报道相对较少。因此,本研究通过腹腔注射GP-APS 构建ITP 小鼠模型后给予DMF,以评估DMF 对ITP 小鼠模型的改善效果及作用机制,实验结果表明,经GPAPS 诱导后小鼠外周血血小板数量明显降低,而DMF 治疗后显著抑制了GP-APS 诱导的小血小板减少与RBC、Hb 水平降低,并抑制了WBC 水平升高,提示DMF可能是一种治疗ITP的新方法。
ITP 是由细胞免疫和体液免疫共同参与的免疫功能异常所引发的,迄今为止,研究者普遍认识到自身反应性B 淋巴细胞功能失调在ITP 发病机制中发挥作用,辅助性T(Th)细胞及其分泌性细胞因子也在ITP的发生发展过程中起着关键作用[14]。Th细胞可分为Th1、Th2 和Th17 细胞,Th1 细胞主要通过产生IFN-γ、IL-2与IL-17诱导细胞免疫,这些促炎细胞因子通过激活巨噬细胞、淋巴细胞和其他炎症细胞参与炎症反应;相比之下,Th2 细胞通过分泌抗炎细胞因子,如TGF-β1、IL-4 以及IL-10,参与巨噬细胞失活和体液免疫反应的调控作用[15-16]。已知DMF通过调节免疫细胞功能从而对多种自身免疫性疾病具有治疗作用。本研究检测结果显示,ITP 小鼠血清中IFN-γ、IL-2与IL-17均明显升高,TGF-β1、IL-4与IL-10 则明显下降,而经过DMF 低、高剂量作用的ITP 小鼠,其血清中IFN-γ、IL-2 与IL-17 均明显下降,TGF-β1、IL-4 以及IL-10 明显升高。骨髓巨核细胞异常增生伴成熟障碍也是ITP 的主要特点之一,巨核细胞作为血小板的前体细胞,从骨髓的骨内壁龛向脉管系统迁移,将前血小板延伸到血窦,通过循环血液逐渐将其分解为血小板[17]。本研究结果也显示,ITP 小鼠股骨组织和脾脏组织中巨核细胞数目异常增多且形态不规则,而DMF 作用后能够改善这种异常现象。
巨噬细胞作为一种免疫细胞,以促炎经典激活巨噬细胞(M1型)或抗炎替代激活巨噬细胞(M2型)的两种形式存在,M1 型巨噬细胞发挥促炎、抗肿瘤和抗微生物功能,释放高水平的促炎细胞因子,如IL-1β、TNF-α、IL-6 和iNOS;M2 型巨噬细胞通过释放抗炎细胞因子,如TGF-β、IL-10 发挥抗炎及免疫抑制作用,具有促血管生成和促纤维化特性,并能够促进肿瘤进展[18]。既往研究表明,巨噬细胞在ITP 中起着关键作用,既可以作为效应细胞吞噬血小板,也可以作为抗原呈递细胞,刺激自身抗体对抗血小板的产生,并且已在ITP 中检测到M1/M2 比例失衡,M1型巨噬细胞的大量存在导致促炎细胞因子的释放增加[19]。此外,CHANG 等[20]研究表明抑制miR-155-5p 的表达可以促进PD1/PDL1 通路介导的巨噬细胞向M2 型极化,从而达到缓解ITP 的作用。因此,抑制巨噬细胞向M1 型极化和促进巨噬细胞向M2 型极化可能是治疗ITP 的途径之一。以往研究表明,DMF 可以通过抑制巨噬细胞和中性粒细胞的异常激活减轻炎症反应[21]。脾脏不仅是由血源性病原体、死亡或凋亡细胞等外来或自身抗原刺激机体引起免疫应答的淋巴器官,还是重要的巨噬细胞储存器官,脾脏内巨噬细胞主要包括红髓内的红髓巨噬细胞、边缘区嗜金属巨噬细胞、边缘区巨噬细胞以及白髓内着色小体巨噬细胞,均是脾脏内主要的吞噬细胞和功能细胞[22]。此外,外周血中的细胞是参与机体稳态调节和骨代谢的重要组成,其中,单核细胞来源于骨髓干细胞,在骨髓中经前单核细胞分化发育为单核细胞,然后释放到外周血中,经过血液循环移行到各个组织中,进而分化成为巨噬细胞[23]。本研究检测结果显示,ITP 小鼠脾脏组织内以CD68+CD86+标记的M1 型巨噬细胞阳性表达率升高,以CD68+CD206+标记的M2 型巨噬细胞阳性表达率降低,外周血F4/80+CD86+比例明显升高,F4/80+CD206+细胞比例明显降低,说明ITP 小鼠发生了M1 型巨噬细胞与M2 型巨噬细胞比率失衡的现象,而DMF 作用的ITP 小鼠脾脏组织内CD68+CD86+阳性表达率降低,CD68+CD206+阳性表达率升高,此外,外周血F4/80+CD86+细胞比例也降低,而F4/80+CD206+细胞比例也表现出明显的升高现象,由此推测,DMF 可能通过调控巨噬细胞极化从而改善ITP。
综上所述,DMF 能够抑制ITP 小鼠血小板数量的降低,调节血常规指标,降低脾脏指数和骨髓巨核细胞异常的现象,从而改善ITP,研究结果提示该作用机制可能与抑制巨噬细胞向M1 型极化并促进向M2 型极化相关,为进一步了解ITP 发病机制及DMF治疗ITP的研究提供实验基础。
