乙型肝炎病毒相关肝细胞癌关键基因筛选及其与预后关系的生物信息学分析
2023-11-11徐雅琪王艳玉张文婧穆华夏卜伟晓陶子琨孔雨佳石福艳王素珍
徐雅琪, 王艳玉, 张文婧, 韩 梅, 穆华夏, 杨 希, 卜伟晓, 陶子琨, 孔雨佳, 石福艳, 王素珍
(潍坊医学院公共卫生学院卫生统计学教研室,山东 潍坊 261053)
原发性肝癌是全球第七大常见癌症,中国原发性肝癌发病率较高、病例数最高[1]。肝细胞癌(hepatocellular carcinoma,HCC)是肝癌的主要类型,约占75%[2]。HCC 主要致病因素是病毒(慢性乙型和丙型肝炎病毒)、代谢(糖尿病和非酒精性脂肪性肝病)、毒性(乙醇和黄曲霉毒素)和免疫系统相关疾病[3]。其中,病毒诱导的遗传改变、不可逆肝损伤和肝硬化导致乙型肝炎病毒(hepatitis B virus,HBV)相关HCC 患者的预后较差[4],而免疫应答与HBV 感染期间患者的疾病进展有关联[5]。目前国内外生物信息学研究大多只聚焦于HCC 生物标志物的筛选和关键通路的探索方面,关于HBV-HCC 的免疫浸润分析较少。因此,探讨HBV-HCC 免疫细胞浸润机制,可为进一步研究HBV-HCC 的发病机制提供依据。本研究结合基因表达综合数据库(Gene Expression Omnibus,GEO)芯片数据和生物信息学方法,筛选出差异表达基因(differentially expressed genes,DEGs),构建蛋白-蛋白互作(protein-protein interaction,PPI)网络,采用生存分析方法确定与HBV-HCC相关的关键基因,并进行功能通路富集分析,采用“CIBERSORT”软件包进行HBV-HCC 的免疫细胞浸润分析,为阐明HBV 促进HCC 发生发展的分子机制、探索HBV-HCC 的关键基因和相关功能通路及HBV-HCC 的潜在诊断治疗靶点提供依据 。
1 资料与方法
1.1 数据收集采用美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI) 平 台 下 载 的GEO (http://www.ncbi.nlm.gov/geo/),选取含有肝癌病因信息的数据芯片GSE121248[6]。芯 片 信 息 为Affymetrix Human Genome U133 Plus 2.0 Array,平 台 为 GPL570,该芯片分离慢性HBV 诱导的HCC 组织及其癌旁正常组织,并提取总RNA 进行Affymetrix 基因微阵列分析。本研究数据包含70 例慢性HBV 诱导的人HCC 组织和37 例癌旁正常组织。
1.2 DEGs 的筛选采用R 软件的“limma”数据包对GSE121248 基因组表达谱数据进行标椎化,并筛选DEGs。DEGs 筛选标准:DEGs 的 log2变化倍数(fold changes,FC)的绝对值变化超过1 倍, 且 校 正 后P<0.05, 即| log2FC | >1,AdjustedP<0.05,并采用R 软件中的“ggplot2”数据包绘制差异分析结果的火山图和热图。
1.3 DEGs 的富集分析采 用 R 软 件 的“clusterProfiler” 数据包对DEGs 进行基因本体(Gene Ontology,GO) 功能富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路富集分析,以P<0.05 为标准筛选DEGs 主要富集功能和通路,采用“ggplot2”数据包进行可视化处理。其中GO 功能富集分析包括生物学过程(biological process,BP)、分子功能(molecular function,MF)和细胞定位(cellular component,CC)3 个部分。
1.4 PPI 网络构建和关键基因筛选采用STRING 数 据 库(http://string-db.org/)[7]对 筛选得到的DEGs 构建PPI 网络,并采用Cytoscape 3.9.1 软件(http://www.cytoscape.org)对所构建的PPI 网络进行可视化分析。采用Cytoscape 的插件CytoHubba[8]筛选出最大中心度(maximal clique centrality,MCC)评分前10 位的关键基因。关键基因表达相关性分析采用STRING 数据库。
1.5 关键基因的验证性分析基于基因表达水平值的交互式分析 (Gene Expression Profiling Interactive Analysis,GEPIA)数据库[9](http://gepia.cancer-pku.cn/)对关键基因进行验证分析。以|log2FC| = 1 和P= 0.05 作为截断标准。采用Kaplan Meier-Plotter 数 据 库[10](http://kmplot.com/analysis)评估关键基因对HCC 患者生存和预后的影响。根据HCC 患者特定基因表达水平的中位值将研究对象分为低表达组和高表达组,采用Kaplan-Meier 生存曲线分析HCC 患者的总体生存(overall survival,OS)率,并计算风险比(hazard ratio, HR) 和95% 置 信 区 间(95% confidence interval,95%CI)。为进一步验证肿瘤组织和癌旁正常组织中蛋白质表达量的差异,本研究采用人类蛋白质图谱(Human Protein Atlas,HPA) 数据库[11]对关键基因进行蛋白质表达分析,分析结果采用免疫组织化学图谱表示。
1.6 免疫细胞浸润分析采用R 软件中的“CIBERSORT”数据包比较HCC 和癌旁正常组织中免疫细胞亚型的丰度水平[11]。采用箱线图比较HCC 和癌旁正常组织中免疫表达分布差异性。以P<0.05 为差异有统计学意义。
2 结 果
2.1 HCC 组织和癌旁正常组织中的DEGs 筛选本研究共筛选出574 个DEGs,其中上调基因173 个(log2FC>1),下调基因401 个(log2FC<-1)。基于差异表达分析的可视化分析结果见 图1A (火 山 图) 和 图1B (前50 个DEGs 的热图)。
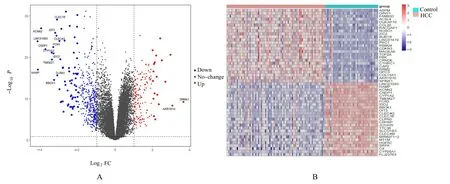
图1 HCC 和癌旁正常组织中DEGs 表达水平Fig.1 Expression levels of DEGs in HCC and adjacent normal tissues
2.2 GO 功能富集分析和KEGG 信号通路富集分析对GEO 芯片进行GO 功能富集分析和KEGG信号通路富集分析,并以AdjustP为标准从小到大排列,展示了GO 功能富集分析前10 个功能和KEGG 通路富集分析前27 个通路结果。其中GO 功能富集分析中BP 结果显示: DEGs 主要富集在小分子代谢、氨基酸分解代谢过程、信号转导、细胞黏附和分裂、免疫应答及炎症反应等过程;GO 功能富集分析中CC 结果显示:DEGs 主要集中在细胞外基质、血液微粒、胶原蛋白三聚物、血浆脂蛋白微粒和纺锤体中央区等部分;GO 功能富集分析结果显示:MF 与氧化还原酶活性,血红素结合,铁、锌和钙离子结合及花生四烯酸单加氧酶活性等功能相关。KEGG 信号通路富集分析结果显示:DEGs 主要富集在视黄醇代谢通路、代谢途径、药物代谢-细胞色素P450、细胞色素P450 对外源药物代谢通路和化学致癌作用、蛋白丝氨酸/苏氨酸激酶活性和p53 信号通路。见图2。

图2 DEGs 的GO 功能富集分析和KEGG 信号通路富集分析Fig.2 GO functional enrichment analysis and KEGG signaling pathway enrichment analysis on DEGs
2.3 DEGs 的PPI 网络构建和关键基因筛选对DEGs 进行PPI 网络可视化分析,结果显示:得分最高的前10 个基因分别为细胞分裂周期20(cell division cycle 20,CDC20)、细胞周期蛋白依赖性激酶1 (cyclin dependent kinase 1,CDK1)、细胞周期蛋白A2(cyclin A2,CCNA2)、纺锤体检测点蛋白(spindle checkpoint protein,BUB1B)、拓扑 异 构 酶Ⅱα (topoisomerase Ⅱα, TOP2A)、Discs 大同源相关蛋白5 (discs large homolog associated protein 5,DLGAP5)、异常纺锤体样小头 畸 形 相 关 蛋 白 (abnormal spindle-like microcephaly associated protein,ASPM)、中心体蛋白55(centrosomal protein 55,CEP55)、驱动蛋白超家族11(kinesin superfamily 11,KIF11)和驱动蛋白超家族20A (kinesin superfamily 20A,KIF20A),作为HBV-HCC 的 关 键 基 因。且这10 个关键基因均为上调DEGs,其PPI 网络由10 个节点和45 个边组成,平均局部聚类系数为1,PPI富集P<0.001。对关键基因的基因共表达分析结果显示这10 个关键基因表达之间存在一定相关性。见图3。
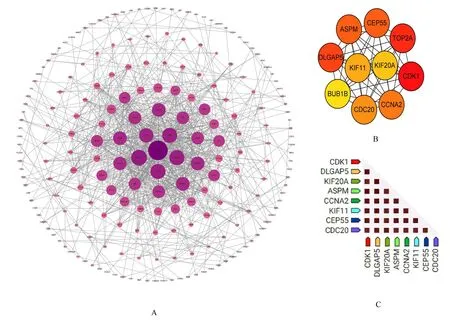
图3 DEGs 的PPI 网络和关键基因的共表达分析Fig.3 PPI network of DEGs and co-expression analysis on key genes
2.4 关键基因的验证性分析与癌旁正常组织比较,本研究筛选的10 个关键基因中8 个关键基因(CDK1、TOP2A、DLGAP5、ASPM、CCNA2、CDC20、KIF20A 和BUB1B)在HCC 组织中表达水平升高(P<0.01)(图4)。HCC 组织中CEP55和KIF11 表达水平也高于癌旁正常组织,但差异无统计学意义(P>0.05)。为进一步验证关键基因对肝细胞癌患者生存预后的影响而进行OS 分析,结果显示:本研究筛选的10 个关键基因的高表达与HCC 患者的不良预后均有关联(P<0.05)(图5)。HCC 组 织 中CDC20、CDK1、CCNA2、TOP2A、DLGAP5、KIF20A 和KIF11 表达水平明显高于癌旁正常组织,而HCC 组织和癌旁正常组织中CEP55 表达水平比较差异无统计学意义(P>0.05)。BUB1B 和ASPM 蛋 白 表 达 情 况 在HPA 数据库中无记录。HPA 数据库中免疫组织化学结果见图6。

图4 HCC 和癌旁正常组织中关键基因表达水平Fig.4 Expression levels of key genes in HCC and adjacent normal tissues
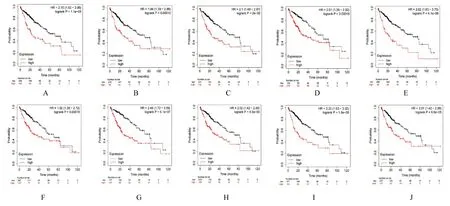
图5 低和高表达组HCC 患者10 个预后基因的生存曲线Fig.5 Survival curves of 10 prognostic genes of HCC patients in low and high expression groups

图6 免疫组织化学染色检测HCC 和癌旁正常组织中预后相关基因的表达情况Fig.6 Expressions of genes related to survival in HCC and adjacent normal tissues detected by immunohistochemistry staining
2.5 免疫细胞浸润分析结果HCC 组织中M1 巨噬细胞、M2 巨噬细胞、CD4+T 淋巴细胞和CD8+T 淋巴细胞百分率高于癌旁正常组织。HCC组织中M0 巨噬细胞、调节性T 淋巴细胞(Tregs)和静息NK 细胞百分率高于癌旁正常组织(P<0.05),而γδT 淋巴细胞和活化的肥大细胞百分率低于癌旁正常组织(P<0.05)。见图7。
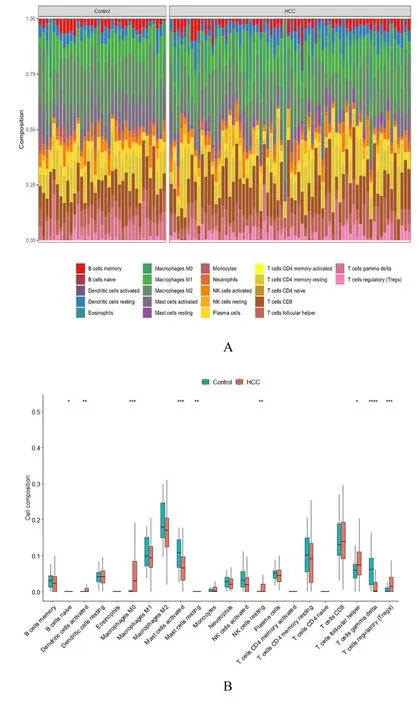
图7 HCC 和癌旁正常组织中免疫细胞丰度分布图(A)和差异性分析箱线图(B)Fig.7 Abundances distribution map(A) and differential analysis box diagram (B) of differences of immune cells in HCC and adjacent normal tissues
2.6 10 个关键基因的KEGG 信号通路富集分析CDC20、CDK1、CCNA2 和BUB1B 在细胞周期信号通路中富集;CDC20、CDK1 和CCNA2 在病毒致癌作用通路中富集;CDC20、CCNA2 和BUB1B 在人T 淋巴细胞白血病病毒1(human Tlymphocyte leukemia virus-1,HTLV-1) 感染通路中富集,提示CDC20、CDK1、CCNA2 和BUB1B可能在HBV 相关HCC 的发生发展中起主要作用。见表1。
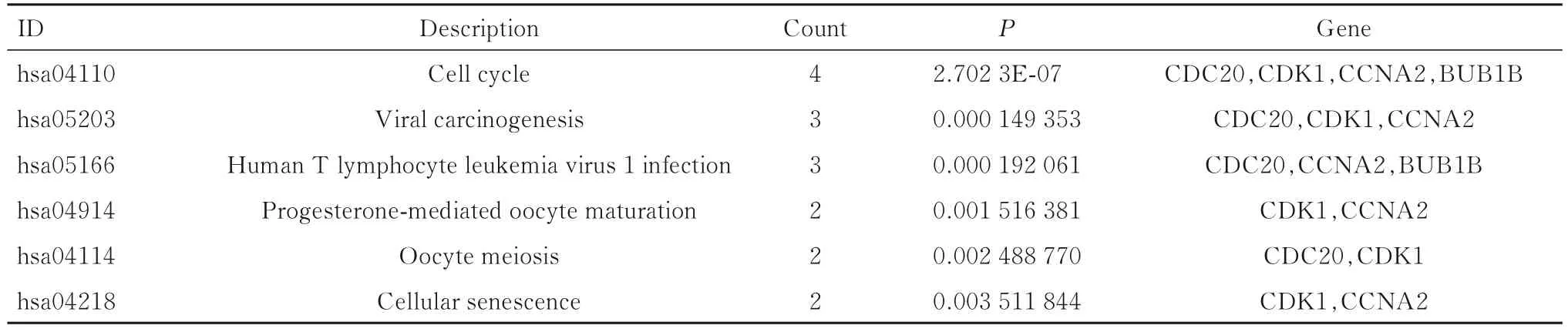
表1 关键基因的KEGG 信号通路富集分析Tab.1 KEGG signaling pathway enrichment analysis on key genes
3 讨 论
HBV 与HCC 发生之间的生物学过程较为复杂,HBV 感染期间由免疫反应引起的肝脏炎症导致大多数患者发生肝纤维化和肝硬化,从而促进了HCC 的 发 展[12]。此 外,与 其 他 类 型HCC 比 较,HBV DNA 整合到宿主基因组中会诱导遗传不稳定性和各种癌症相关基因的诱变[13]。因此,本研究采用大数据挖掘和生物信息学方法对HBV-HCC 的DEGs 及其相关功能通路进行了探讨。
本研究主要针对HBV-HCC 患者共筛选出574 个DEGs,进一步通过PPI 网络分析得到10 个关键基因。另外,基于TCGA 和GTEx 数据库对所筛选的10 个关键基因的差异表达进行了验证,验证结果进一步表明所筛选的10 个关键基因与HBV-HCC 的发生发展有密切关联。
本研究结果显示:DEGs 显著影响细胞分裂、细胞代谢、免疫应答和炎症反应。REVILL 等[14]研究显示:病毒感染细胞的免疫清除和肝细胞再生增加了病毒感染性肝病发展为HCC 的风险。相关流行病学研究显示:慢性低水平炎症可显著增加患癌的风险,相关蛋白的长期异常表达可能诱发生理性疾病和形成潜在的致癌微环境,而肿瘤的发生发展反之影响炎症反应过程[15-16]。此外,KEGG 通路富集分析结果显示:DEGs 主要富集在视黄醇代谢通路、细胞色素P450 对外源药物代谢通路和化学致癌作用等生物过程。该研究与PETTINELLI等[17]研究结论一致,癌症与异常代谢过程有关,视黄醇代谢改变参与肝纤维化过程。细胞色素P450 系在药物代谢中起重要作用,GAO 等[18]研究显示:细胞色素P450 2E1(CYP2E1)参与许多已知环境毒物的代谢和活化,而较高的CYP2E1 活性可能是从肝纤维化到HCC 发生的危险因素;化学致癌是细胞经历癌基因和肿瘤抑制因子的遗传学和表观遗传学变异的过程[19]。
为深入了解关键基因的生物功能,本研究重点分 析了CDC20、CDK1、CCNA2 和BUB1B 这4 个细胞周期与病毒致癌作用相关基因。其中CDC20是APC 的经典激活剂,也是具有调节细胞周期检查点功能的关键E3 连接酶。相关研究[20]显示:CDC20 在细胞周期的中期和末期异常表达或功能障碍导致有丝分裂停滞的消除,导致癌变的非整倍性。CDK1 是Ser/Thr 蛋白激酶家族的成员,通过与CCNB1 相互作用,在真核细胞周期的G1/S 和G2/M 相 变 中 起 重 要 作 用[21]。相 关 研 究[22]显 示:CDK1 在HCC 组织中过表达与肿瘤体积大、晚期肿瘤分期、门静脉侵袭、肝内转移、分化不良、甲胎蛋白(alpha fetoprotein,AFP) 水平高、Ki-67指数高和患者预后不良等有显著关联。CCNA2 在间期结束时激活CDK1 以促进有丝分裂,且CCNA2 过表达已在许多类型的癌组织中被发现[23]。BUB1B 作为关键的有丝分裂纺锤体检查点,在许多肿瘤的发展中起重要作用。研究[24]显示:BUB1B 促进肿瘤增殖并诱导胶质母细胞瘤的放射抵抗力。
本研究还探讨了其他6 个关键基因(TOP2A、DLGAP5、 ASPM、 CEP55、 KIF11 和KIF20A)的生物学机制和功能,本研究结果显示:这6 个基因均与HCC 的发生发展密切相关。有研究[26]显示:TOP2A 在HCC 组织中的高表达与Ki-67 高表达有关,并且已经发现Ki-67 表达与HCC 组织生长速率和患者预后不良相关[25]。DLGAP5 敲低则通过减少P53 积累来抑制HCC 细胞增殖。而ASPM基因表达与肝炎引起的肝硬化密切相关,表明ASPM 可 能 与 炎 症 有 关[27]。ASPM 可 能 与HCC 细胞中的KIF11 相互作用,通过Wnt/β-catenin 信号通路促进HCC 的恶性进展[28]。另外,CEP55 过表达与多种肿瘤类型的肿瘤分期、侵袭性、转移和预后不良相关[29]。KIF20A 在细胞周期的G2期积聚在细胞核中,同样也通过调节各种信号通路促进细胞增殖、细胞凋亡和转移[30]。
为进一步探讨免疫应答在HBV-HCC 发生发展中的作用,本研究进行免疫浸润分析,结果显示:HCC 组织中巨噬细胞、 CD4+T 淋巴细胞和CD8+T 淋巴细胞百分率较高,M0 巨噬细胞、Treg、静息NK 细胞在HBV-HCC 组织中显著浸润,而γδT 淋巴细胞和活化的肥大细胞呈低浸润。相关研究[31-32]显示:在自限性急性HBV 感染期间,CD4+T 淋巴细胞和CD8+T 淋巴细胞产生强烈反应以控制和清除HBV,HBV 特异性CD8+T 淋巴细胞通过产生干扰素γ(interferon-gamma,IFN-γ)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)或直接杀死受感染的HCC 细胞表现出抗病毒活性。然而,在慢性HBV 感染期间,HBV 的持续存在加速肝组织中Tregs 募集,促进HBV-HCC 免疫逃逸,导致HCC 患者发生门静脉肿瘤血栓[33]。另外,NK 细胞通过产生炎性细胞因子[白细胞介素4(interleukin-4,IL-4)和白细胞介素13(interleukin-13, IL-13) ] 促 进 肝 星 状 细 胞(hepatic stellate cells,HSCs) 激活,导致HBV 转基因小鼠发生自发性肝纤维化[34],HSCs 也上调肝脏中Tregs 水平,这也与纤维化和肝硬化后HCC的发生有关[35]。而γδT 淋巴细胞驱动的髓源性抑制细胞在HBV 耐受肝脏中的积累强烈抑制CD8+T 淋 巴 细 胞 功 能[36]。由 此 可 知,HBV 诱 导 的 免 疫失衡导致了HCC 发生发展,控制和维持免疫平衡成为HBV-HCC 治疗的关键问题。
本研究筛选出HBV-HCC 发生发展中DEGs 和信号通路,并发现了10 个关键基因的高表达与HCC 患者的生存率降低有密切关联。另外,本研究也初步探讨了HBV 病毒感染在非肿瘤肝组织转化为肝癌组织过程中的分子机制,该结果可为肝癌诊治提供一些潜在的治疗靶点和实践依据。然而,由于本研究是基于公开数据库的生物信息学研究,具有一定的局限性,缺乏验证关键基因的实验和临床数据,在后续的研究中,本课题组将结合实验及临床数据进一步明确上述10 个关键基因在HBVHCC 中的研究价值。
