色甘酸二钠对大鼠脑缺血/再灌注损伤的改善作用及其机制
2023-11-11陈薪旭陈奕斌黎昌炫
朱 娴, 陈薪旭, 陈奕斌, 黎昌炫, 刘 杰, 王 埮
(海南医学院第一附属医院神经内科,海南 海口 570102)
缺血性卒中(cerebral ischemic stroke,CIS)是一种由大脑供血动脉狭窄或闭塞造成脑供血不足进而引起脑组织坏死的脑血管病[1]。海马神经元易受CIS 影响而产生损伤,引起患者情绪失控,远期出现运动功能障碍等症状[2]。CIS 造成大量神经元损伤的同时,也会启动病灶周围组织再生反应。有学者[3]认为:内源性神经干细胞快速增殖并迁移至受损脑组织是发挥组织重构和神经修复作用的基础。然而,这种内源性修复功能不足以使神经功能完全恢复。因此,如何快速恢复海马区神经元增殖是CIS 溶栓后治疗的关键。
肥大细胞(mast cells,MCs)是血液中广泛存在的一类粒细胞,能够根据局部环境和激活状态改变自身表型。既往研究[4]显示:幼鼠围手术期缺血后,MCs 经血-脑屏障进入中枢神经系统,可诱导小胶质细胞活化和炎症反应,造成幼鼠脑神经元发育受阻。色甘酸二钠(sodium cromoglycate,SCG)是一类抑制MCs 脱粒和迁移的药物[5],可减少CIS 溶栓大鼠模型中性粒细胞进入脑实质,降低模型大鼠死亡率,减轻大鼠海马、丘脑及大脑皮质 区 域 损 伤[6]。目 前,有 关SCG 对CIS 溶 栓 治 疗后神经元新生的影响尚不清楚。本研究采用线栓法构建大鼠脑缺血/再灌注(ischemia/reperfusion,I/R)损伤模型模拟静脉溶栓,探讨SCG 对I/R 大鼠脑组织神经元新生的作用,为研究SCG 在CIS 治疗中的作用提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器80 只SD 大鼠由海南药物研究所有限责任公司提供,无特定病原体动物(specific pathogen free,SPF) 级,雄性,8 周龄,动物生产许可证号:SCXK (琼) 2020-0007,体质量170~180 g;大鼠饲养于海南医学院动物实验中心SPF 动物房中,饲养条件:温度22 ℃~26 ℃,湿度30%~70%,12 h/12 h 固定昼夜循环,给予充足的食物和水。脑缺血模型线栓(型号:L3600,广州佳灵生物技术公司),2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)(批号:133725,美国Sigma 公司),高尔基染色试剂盒(批号:103962,美国Thermo 公司), 5-溴 脱 氧 尿 嘧 啶 核 苷(5-bromodeoxyuracil nucleoside, BrdU)(批 号:162290,美国Sigma 公司),抗鼠BrdU 抗体(批号:ab0753,英国Abcam 公司),抗鼠双皮质素抗体(doublecortin,DCX)(批号:5302,美国CST公司),抗鼠脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、抗鼠抗酪氨酸激酶受体B (tyrosine kinase receptor B,TrkB),抗鼠神经生长因子3(neurotrophins-3,NT-3) 和抗鼠抗酪氨酸激酶受体C (tyrosine kinase receptor C,TrkC) 抗体(批号:bs3728、bs2837、bs3822 和bs1535,北京博奥森生物科技公司),辣根氧化酶偶 联 山 羊 抗 鼠/兔IgG (H+L) 抗 体(批 号:b183237/b277372,上海碧云天生物科技公司)。Y 型迷宫设备(型号:SA204,江苏赛昂斯公司),倒置荧光显微镜(型号:EVOS M5000,美国Thermo 公司),凝胶电泳装置(型号:Miniprotean Tetra,美国Bio-Rad 公司),化学发光成像仪(型号:1600/1600R,上海天能生物公司),膜片钳系统(型号:MultiClamp 700B 和MultiClamp 1550B,瑞士Axon 公司),激光扫描共聚焦显微镜(型号:CX7 Pro,美国Thermo 公司)。
1.2 实验动物分组、给药和模型制备80 只大鼠分为假手术组和I/R 模型组,假手术组18 只,I/R模型组62 只。所有大鼠适应环境喂养1 周,麻醉I/R 模型组大鼠,仰卧位姿势固定在鼠板上,颈部备皮消毒,切开1 个长度约为2 cm 的切口。沿着肌肉组织分离出左侧颈动脉,分别结扎颈总动脉和颈外动脉。在颈总动脉结扎处穿刺开孔,插入脑缺血模型线栓,经颈动脉分叉前进至颈内动脉,继续推进直至大脑中动脉,深度约为16 mm。此时,大脑中动脉血流被线栓阻塞。持续2 h 后取出线栓,缝合伤口,结扎颈总动脉避免伤口出血。麻醉假手术组大鼠,颈部备皮消毒后分离颈动脉,不进行其他任何处理,缝合伤口,滴加青霉素避免感染。
1.3 改良的神经功能缺损程度评分(modified neurological severity score,mNSS)法评估各组大鼠神经功能建模后24 h 按参考文献[7]中mNSS法评估大鼠神经功能。行为学实验包括提尾实验、运动实验、感觉实验、平衡木实验、反射丧失实验和不正常运动实验,总评分为18 分,评分越高代表大鼠神经功能损伤越严重。剔除I/R 模型组神经功能评分<6 分(2 只) 和≥15 分(8 只) 及死亡(7 只)大鼠,将造模成功的45 只大鼠随机分为I/R组、I/R+低剂量(20 mg·kg-1) SCG 组和I/R+高剂量(60 mg·kg-1) SCG 组,每组各15 只。假手术组和I/R 模型组大鼠分别腹腔注射生理盐水,剂量为10 mL·kg-1,连续腹腔注射2 周。各剂量SCG 组大鼠给予相应剂量SCG,持续2 周。记录各组大鼠mNSS 评分,评价不同剂量SCG 对大鼠神经功能的影响。
1.4 Y 型迷宫实验检测各组大鼠学习记忆能力腹腔给药2 周后,每组随机选取12 只大鼠开展Y 型迷宫检测,检测期间持续给药治疗。Y 型迷宫各支臂装有信号灯,设置安全区(无电刺激)与非安全区(电刺激)。随机确定安全区,测试大鼠电击回避学习和记忆能力。训练时,将大鼠置于Y 型迷宫中,以所在支臂为起点,安全区支臂信号灯亮,延迟5 s 启动电刺激。当大鼠逃避至安全区,并且在信号灯持续时间(10 s) 内不折返至电击区,记为正确反应,否则记为错误反应。大鼠共训练20 次,记录正确反应次数,并计算正确反应率,正确反应率=正确反应次数/20×100%,正确反应率可反映大鼠学习能力。将各组大鼠置入Y 型迷宫中,安全区亮灯,记录各个大鼠到达安全区时间,记为正确反应时间,代表大鼠的记忆能力。
1.5 2,3,5- 氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色法检测各组大鼠脑梗死区面积完成“Y”型迷宫实验检测后,各组随机取3 只大鼠,取大鼠脑组织,冰箱冷冻成形后切片,约6 片。将切片浸于2%TTC 染色液中,水浴(37 ℃)中避光孵育,期间多次翻片保证染色充分,整个过程共30 min。取出染液中切片,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗后,将切片按顺序排列后拍照,计算脑梗死区面积。脑梗死区面积=白色梗死区域面积/脑组织区域面积。
1.6 长时程增强检测各组大鼠学习和记忆能力每组随机选取3 只大鼠以CO2处死,采用PBS缓冲液(4 ℃预冷)经心脏灌流冲尽全身血液后取出完整脑组织,置入冰浴人工脑脊液(artificial cerebrospinal fluid,ACSF) 中。去除小脑,沿大脑中缝切开左右半球,取缺血侧大脑,分离出海马区组织,切断海马伞部,割断下托,置于预备的琼脂块上,将海马与琼脂块固定在切片机标本托上,冰浴ACSF、持续供氧条件下,将海马沿长轴切出厚度为400 μm 的切片。转移切片至ACSF 中平衡,以聚四氟乙烯涂层的钨丝电极为刺激电极,以充满 ACSF 的玻璃微电极为记录电极,插入脑组织海马CA1 区谢氏侧支或者CA3 区锥体细胞发出的轴突通路,通电刺激后引发场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP)。调整电极位置和刺激强度以诱发不同fEPSP,设基线为200 μA 下最大值信号强度的40%。固定电极和刺激强度,稳定记录20 min。更换更高频率刺激诱发长时程电位增强(long term potentiation,LTP),连续给予20 串刺激,每串包含200 个脉冲,频率为200 Hz,波宽200 μ s,串间隔30 s,稳定记录60 min。计算每分钟神经兴奋性突触后fEPSP 斜率和高频刺激后fEPSP。
1.7 高尔基染色检测各组大鼠脑组织中海马齿状回区树突棘密度每组随机取3 只大鼠以CO2处死,采用PBS 缓冲液(4 ℃预冷)经心脏灌流冲尽全身血液后取出完整脑组织,置于4%多聚甲醛中固定24 h。取出脑组织,梯度乙醇脱水,浸泡入溶液1 与溶液2 的混合液中冷藏14 d(溶液1、2、3、4 和5 均为高尔基染色试剂盒中试剂)。取出脑组织浸入溶液3 冷藏48 h,置入异戊烷中包埋,冷冻后切成,片厚为10 μm,转移至载玻片。载玻片上滴加溶液4 与溶液5 混合液反应30 min。蒸馏水冲洗,最后采用不同浓度乙醇脱水,分别采用二甲苯Ⅰ和二甲苯Ⅱ溶液透化,以中性树胶封片。置于激光共聚焦显微镜下观察各组大鼠脑组织中海马齿状回区神经元每50 μm 长度的树突上树突棘数,即为树突棘密度。
1.8 免疫荧光法检测各组大鼠脑组织中海马齿状回区5-溴脱氧尿苷(5-bromodeoxyuridine,BrdU)阳性细胞数和双肾上腺皮质激素(doublecortin,DCX)蛋白表达水平各组随机选取3 只大鼠,连续腹腔注射50 mg·kg-1BrdU 3 d 后处死,取脑组织,采用冷冻液包埋后切成约10 μm 厚切片。将切片置于染缸中滴加丙酮甲醇混合溶液(1∶1)浸没,固定20 min。取出切片贴于载玻片上,浸没于山羊血清中封闭60 min。PBS 缓冲液清洗,切片上滴加兔源抗鼠BrdU 抗体与鼠源抗鼠DCX 抗体稀释液,4 ℃孵育过夜。PBS 缓冲液清洗,滴加Alexa Fluor 555 山羊抗兔IgG(H+L)或Alexaflour 488山羊抗鼠IgG(H+L)二抗稀释液。室温避光孵育1 h,滴加DAPI 染色液孵育20 min,再滴加抗荧光淬灭剂封片,荧光显微镜下观察。采用Image Pro Plus 6.0统计软件计算海马齿状回区BrdU阳性细胞数,扫描得到DCX 平均荧光强度,以DXC 平均荧光强度代表DCX蛋白表达水平。
1.9 Western blotting 法检测各组大鼠大脑海马组织 中BDNF、TrkB、NT-3 和TrkC 蛋 白 表 达 水 平
每组取3 只大鼠,处死后取缺血侧基底节区,加入RIPA 裂解液匀浆,静置30 min。4 ℃离心(12 000 r·min-1、30 min)吸取上清液,检测蛋白浓度并加入上样缓冲液,加热10 min 使蛋白变性。取凝胶上样并开启电泳,通过湿法转膜法转移凝胶条带蛋白至PVDF 膜上。取出PVDF 膜,脱脂奶粉封闭,分别加入抗鼠BDNF、抗鼠TrkB、抗鼠NT-3 与抗鼠TrkC 抗体孵育过夜,次日PBS 缓冲液洗净一抗,加入辣根氯化酶偶联山羊抗鼠/兔IgG(H+L)抗体室温孵育。条带上滴加增强型化学发光试剂(enhanced chemiluminescence,ECL)显色液,化学发光成像仪下获得各个蛋白条带,以β-actin作为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参条带灰度值。
1.10 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组大鼠神经功能评分和脑梗死面积,正确反应率和正确反应时间,fEPSP 斜率,脑组织中海马齿状回区树突棘密度,脑组织中海马齿状回区BrdU 阳性细胞数和DCX 蛋白表达水平,海马组织中BDNF、TrkB、NT-3 和TrkC 蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠正确反应率和正确反应时间与假手术组比较,I/R 组大鼠正确反应率降低(P<0.05),正确反应时间增加(P<0.05)。与I/R 组比较,I/R+低剂量SCG 组大鼠正确反应率和正确反应时间差异无统计学意义(P>0.05),而I/R+高剂量SCG 组大鼠正确反应率明显增加(P<0.05), 正 确 反 应 时 间 明 显 降 低(P<0.05)。见图1。
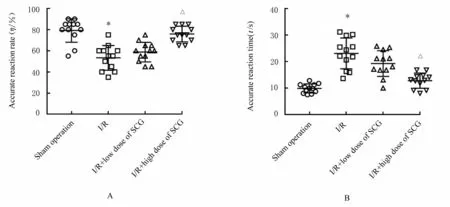
图1 各组大鼠正确反应率(A)和正确反应时间(B)Fig.1 Accurate reaction rate(A) and accurate reaction time (B)of rats in various groups
2.2 各组大鼠神经功能评分和脑梗死面积与假手术组比较,I/R 组大鼠神经功能评分升高(P<0.05),缺血侧出现明显的梗死区域;与I/R 组比较,I/R+高剂量SCG 组大鼠神经功能评分明显降低(P<0.05),且脑梗死面积明显减少(P<0.05);I/R+低剂量SCG 组大鼠神经功能评分和脑梗死面积与I/R 组比较差异无统计学意义(P>0.05)。见图2 和3。
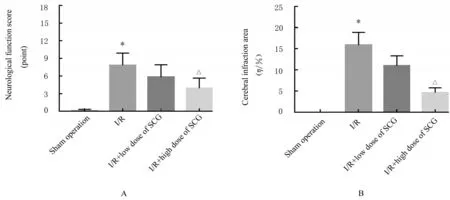
图2 各组大鼠神经功能评分(A)和脑梗死面积(B)Fig.2 Neurological function scores(A) and cerebral infraction areas(B) of rats in various groups
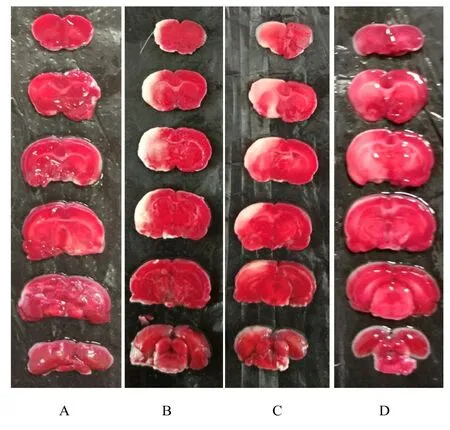
图3 TTC 染色法检测各组大鼠脑梗死面积Fig.3 Cerebral infraction areas of rats in various groups detected by TTC staining method
2.3 长时程增强检测各组大鼠电刺激后海马神经元fEPSP 斜率与假手术组比较,I/R 组大鼠fEPSP 斜率明显降低(P<0.05);与I/R 组比较,I/R+高剂量SCG 组大鼠fEPSP 斜率明显升高(P<0.05)。见图4 和5。
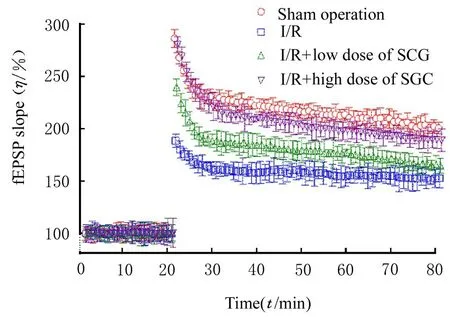
图4 不同时间点电刺激后各组大鼠海马神经元fEPSP 斜率Fig.4 fEPSP slopes of hippocampus neurons of rats in various groups after electrical stimulation at different time points
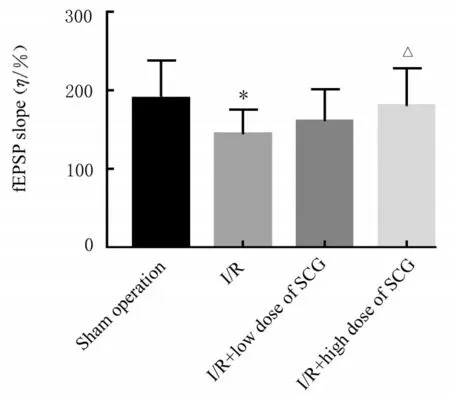
图5 各组大鼠海马神经元fEPSP 斜率Fig.5 fEPSP slopes of hippocampus neurons of rats in various groups
2.4 各组大鼠脑组织中海马齿状回区树突棘密度假手术组、I/R 组、I/R+低剂量SCG 组和I/R+高剂量SCG组大鼠脑组织中海马齿状回区树突棘密度分别为(146.67±10.60)、(54.33±11.93)、(86.67±12.66) 和(119.00±16.46) 个/50 μm,组间比较差异有统计学意义(F=26.792,P<0.001)。与假手术组比较,I/R 组大鼠脑组织中齿状回区树突棘密度明显降低(P<0.05);与I/R 组比较,I/R+高剂量SCG 组大鼠脑组织中海马齿状回区树突棘密度明显升高(P<0.05)。各组大鼠脑组织中海马齿状回区树突棘形态表现见图6。
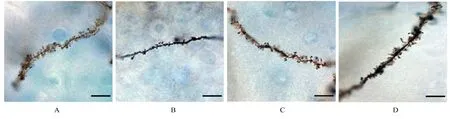
图6 各组大鼠脑组织中海马齿状回区树突棘形态表现(高尔基染色,Bar=10 μm)Fig.6 Morphology of dendritic spines in dentate gyrus of hippocampus in brain tissue of rats in various groups (Golgi staining, Bar =10 μm)
2.5 各组大鼠脑组织中海马齿状回区BrdU 阳性细胞数和DCX 蛋白表达水平与假手术组比较,I/R 组大鼠脑组织中海马齿状回区BrdU 阳性细胞数和DCX 蛋白表达水平差异无统计学意义(P>0.05);与I/R 组比较,I/R+高剂量SCG 组大鼠脑组织中海马齿状回区BrdU 阳性细胞数和DCX 蛋白表达水平升高(P<0.05)。见图7 和表1。
表1 各组大鼠脑组织中海马齿状回区BrdU 阳性细胞数和DCX 蛋白表达水平Tab.1 Number of BrdU positive cells and expression levels of DCX protein in dentate gyrus of hippocampus in brain tissue of rats in various groups (n=3,±s)
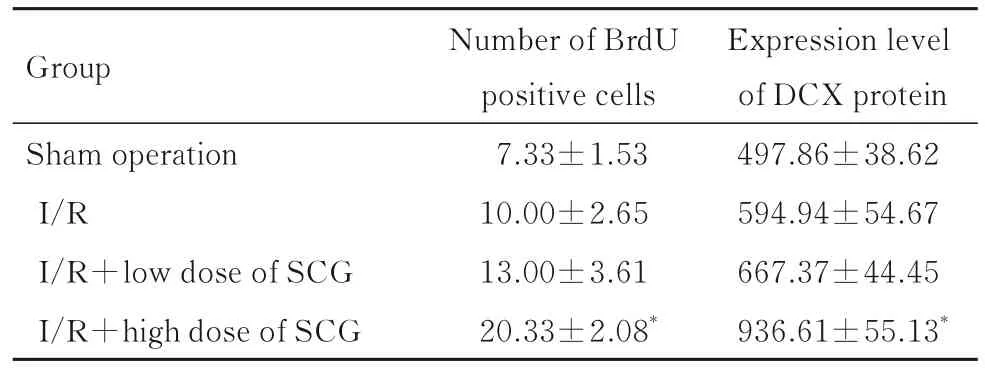
表1 各组大鼠脑组织中海马齿状回区BrdU 阳性细胞数和DCX 蛋白表达水平Tab.1 Number of BrdU positive cells and expression levels of DCX protein in dentate gyrus of hippocampus in brain tissue of rats in various groups (n=3,±s)
*P<0.05 compared with I/R group.
Group Sham operation I/R I/R+low dose of SCG I/R+high dose of SCG Expression level of DCX protein 497.86±38.62 594.94±54.67 667.37±44.45 936.61±55.13*Number of BrdU positive cells 7.33±1.53 10.00±2.65 13.00±3.61 20.33±2.08*

图7 免疫荧光法检测各组大鼠脑组织中海马齿状回区BrdU 阳性细胞和DCX 蛋白表达情况(Bar=100 μm)Fig.7 BrdU positive cells and expressions of DCX protein in dentate gyrus of hippocampus in brain tissue of rats in various groups detected by immunofluorescence method (Bar =100 μm)
2.6 各组大鼠大脑海马组织中BDNF、TrkB、NT-3和TrkC 蛋白表达水平与假手术组比较,I/R 组大鼠大脑海马组织中NT-3 蛋白表达水平升高(P<0.05),而BDNF、TrkB 和TrkC 蛋白表达水平差异无统计学意义(P>0.05)。与I/R 组比较,I/R+高剂量SCG 组大鼠大脑海马组织中BDNF、TrkB、NT-3 和TrkC 蛋白表达水平升高(P<0.05)。见图8 和表2。
表2 各组大鼠大脑海马组织中BDNF、TrkB、NT-3 和TrkC 蛋白表达水平Tab.2 Expression levels of BDNF,TrkB, NT-3, and TrkC proteins in hippocampus tissue of brain of rats in various groups(n=3,±s)
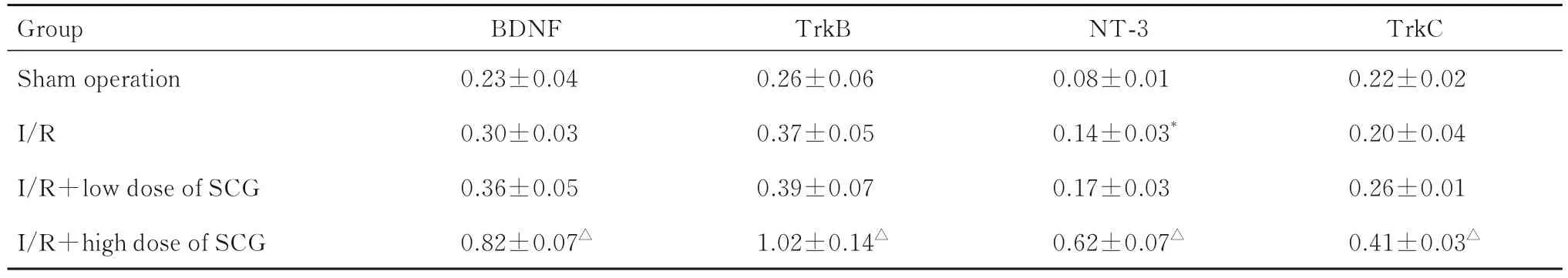
表2 各组大鼠大脑海马组织中BDNF、TrkB、NT-3 和TrkC 蛋白表达水平Tab.2 Expression levels of BDNF,TrkB, NT-3, and TrkC proteins in hippocampus tissue of brain of rats in various groups(n=3,±s)
*P<0.05 compared with sham operation group; △P<0.05 compared with I/R group.
Group Sham operation I/R I/R+low dose of SCG I/R+high dose of SCG TrkC 0.22±0.02 0.20±0.04 0.26±0.01 0.41±0.03△BDNF 0.23±0.04 0.30±0.03 0.36±0.05 0.82±0.07△TrkB 0.26±0.06 0.37±0.05 0.39±0.07 1.02±0.14△NT-3 0.08±0.01 0.14±0.03*0.17±0.03 0.62±0.07△
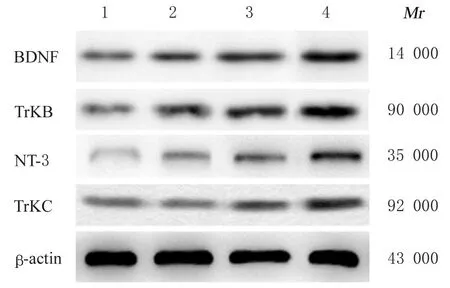
图8 各组大鼠大脑海马组织中BDNF、TrkB、NT-3 和TrkC 蛋白电泳图Fig.8 Electrophoregram of expressions of BDNF,TrkB, NT-3, and TrkC proteins in hippocampus tissue of brain of rats in various groups
3 讨 论
CIS 溶栓诱发再灌注会造成大脑海马区神经元死亡[8]。本研究结果显示:I/R 大鼠脑组织中出现梗死灶和神经功能损伤,Y 型迷宫实验检测结果显示:I/R 组大鼠出现认知功能障碍,表明I/R 构建成功。I/R 模型可模拟临床患者部分肢体运动受损及口眼歪斜等症状[9]和模拟CT 检查呈现的缺血侧低密度阴影信号的情况[10]。此外,I/R 模型易造成远期认知功能障碍情况,这与临床患者CIS 溶栓后远期可能发展为血管性痴呆的病情相符[11]。
既往研究[12-13]显示:SCG 具有治疗中枢神经系统损伤的作用,给予癫痫大鼠SCG 可明显改善大鼠癫痫症状;50 mg·kg-1SCG 可明显降低围术期脑卒中大鼠中枢神经系统中MCs 数,减轻脑损伤严重程度。本研究采用20 和60 mg·kg-1SCG 观察 SCG 对I/R 大鼠的影响,结果显示:与I/R 组比较,I/R+高剂量SCG 组大鼠神经功能评分明显升高,脑梗死面积减少,大鼠认知功能改善;I/R+低剂量SCG 组大鼠各项神经功能评分和脑梗死面积等虽有改善趋势,但差异无统计学意义。
I/R 诱发中枢神经系统损伤机制复杂,但无论何种机制,其恢复治疗机制均涉及提高神经元状态[14]。神经元发生损伤后,脑组织产生代偿性促进神经元新生的反应,该过程是生物体的一种内源性保护行为,神经元新生与神经功能恢复密切相关。有 研 究[15]显 示: 海 马 中BDNF/TrkB 和NT-3/TrkC 信号通路蛋白表达与神经发育、突触形成及学习记忆紧密相关。以基因技术编码敲低BDNF 表达可能导致突触功能障碍、突触可塑性降低和学习及记忆功能受损[16]。增加BDNF和NT-3蛋白表达则有助于树突棘的生长,调节轴突形态,促进神经元新生[17-18]。本研究结果显示:与假手术组比较,I/R 组大鼠大脑海马组织中NT-3 蛋白表达水平升高,但BDNF、TrkB 和TrkC 蛋白表达水平无明显变化。BrdU 是胸腺嘧啶核苷酸类似物,能够在细胞增殖时期代替胸腺嘧啶进入正在复制的DNA 分子中,可通过荧光标记准确地反映细胞增殖情况,而DCX 则是未成熟新生的齿状回颗粒细胞的可靠标记物。在生物内源性修复过程中,BrdU 阳 性 细 胞 数 和DCX 蛋 白 表 达 水 平 升 高[19-20]。本研究结果显示:采用SCG 治疗后大鼠脑组织中海马齿状回区DCX 表达水平和BrdU 阳性细胞数升高。
树突棘是信号传递基本单位,与个体认知功能相关[18]。树突棘数、密度和长度的变化可直观反映突触可塑性改变,可以通过电生理信号长时程增强电位显示[21]。I/R 造成大鼠脑组织海马区域树突棘密度降低,长时程增强检测中fEPSP 斜率降低,且Y 型迷宫实验中大鼠正确反应率减少,正确反应时间延长。这是由于大鼠脑组织结构复杂,缺血区虽然恢复了血供,但较长时间缺血和复灌造成神经元不可逆损伤,且脑组织自我修复能力较弱,无法完全逆转I/R 造成的损伤[22]。因此深入探讨发生I/R 损伤后如何采用药物提高缺血区神经元新生具有重要意义。本研究结果显示:SCG干预后,I/R 大鼠脑组织中BrdU 阳性细胞数增多,DCX 蛋白表达水平升高,且树突棘密度明显升高;与I/R 组比较,I/R+高剂量SCG 组大鼠脑组织海马齿状回区树突棘密度明显升高,且fEPSP 斜率升高。
综上所述,SCG 具有中枢神经系统保护作用,其机制可能是通过提高BDNF/TrkB 和NT-3/TrkC 信号通路蛋白表达,促进脑组织海马区神经元增殖,提高树突棘密度,最终起到提高长时程电位和改善I/R 大鼠认知功能的作用。此外,与自体生理修复比较,SCG 可以进一步减少脑梗死区域,减轻大鼠神经功能障碍。但本研究也存在一定局限性,未探讨部分神经元新生指标(如转化生长因子β1和血管内皮生长因子)的变化及其意义。SCG 一方面调控了神经元的分化和增殖[23],另一方面在缺血区血管重构过程中发挥了巨大作用[24]。
