健康人和青光眼患者小梁网-Schlemm管的形态学特征△
2023-11-10徐丽娟韩佳伶冮晓睿梁远波
周 涛 徐丽娟 韩佳伶 冮晓睿 梁远波
青光眼是全球首位不可逆致盲性眼病,随着人口老龄化的加剧,2040年全球青光眼患病人数将超过1.1亿,大部分来自亚洲及非洲地区[1]。高眼压是青光眼发生发展的主要危险因素,而降眼压是目前唯一明确能延缓青光眼进程的治疗措施。房水由睫状体产生后,75%~80%房水经由小梁网(TM)和Schlemm管(SC)为主体组成的传统途径流出[2]。研究证实,房水外流的主要阻力位于TM外侧邻管组织(JCT)区域和SC内壁[3]。既往对房水流出通道的研究证据大多来自离体实验,随着 OCT的发展和应用,研究者们能够在活体中直观地观察到TM和SC的形态,并发现其在不同生理条件下及青光眼中的结构改变与眼压升高相关[4]。本文将对健康人和青光眼患者中TM及SC形态变化进行综述,以探究其生理和病理状态下的特征。
1 健康人不同生理条件下TM-SC的形态变化
TM是以Schwalbe线为前界,巩膜突和SC后终点为后界,SC内壁以内的楔形区域;SC在OCT图像中显现为角巩缘处一黑色椭圆区域[5]。在光学显微镜下,TM为细长小梁束组成的不规则网状结构,含有丰富的小梁细胞(TMC);SC管腔通畅,内皮完整。电子显微镜下可见TM小梁束由胶原纤维核心和覆盖外周的TMC组成,细胞外基质(ECM)丰富,JCT结构较内侧规则排列的葡萄膜小梁及角巩膜小梁更加无序,与SC内壁连接;SC内壁为紧密连接的单层内皮细胞,可形成巨大液泡,含有与房水流出相关的孔隙,下方为不连续的基底膜(图1)[6]。TM和SC的生物力学性质与房水流出阻力大小息息相关,并受以下因素影响。
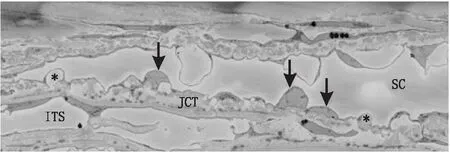
箭头示SC管腔内壁细胞核,*示巨大液泡;ITS:小梁间隙;JCT:邻管组织。图1 TM-SC的连续扫描透射电子显微镜图像(图片来源:Swain等,Exp Eye Res,2021.)
1.1 年龄
TM形态是否存在年龄依赖性改变仍有较大争议。Chen等[7]观察到健康人TM厚度随年龄的增长而增加,但Fernández-Vigo等[8]认为TM厚度变化与年龄无关。Chen等[7]也认为TM长度不随年龄增长而发生改变,但Choi等[9]研究提示TM长度随年龄增长而减小。因此,它们之间的相互关系未来仍需进一步研究。SC呈显著年龄相关性改变。Zhao等[10]发现SC检出率随着年龄增长而降低,老年组SC横截面积显著小于青年组和中年组,说明SC随着衰老而逐渐塌陷。McMenamin等[11]研究表明,TMC随年龄增长而减少,进而导致结构缺损,TM整体形态由长楔形向短菱形演变。衰老眼TMC吞噬色素颗粒增多;SC管腔局部闭合,内皮细胞减少[12-13]。上述结果提示衰老过程中TM-SC的退化和缺损可能是房水流出减少的原因。
电镜下可见TM区域ECM电子致密斑块沉积随年龄增长逐渐增多,可引起弹性纤维鞘增厚[11]。SC内皮巨大液泡密度和体积均随着年龄增长而减小,跨细胞型孔隙减少并引起房水流畅系数降低,而细胞间孔隙数量无明显变化[14-15]。
Morgan等[16]通过原子力显微镜(AFM)测得衰老TMC刚度较原代TMC增大(1.80±0.14)倍(P<0.05,存在血清)或(2.57±0.14)倍(P<0.05,无血清),可能与波形蛋白、F肌动蛋白等细胞骨架成分增多有关。上述结果提示纤维化相关蛋白因衰老增加而使细胞硬化和功能障碍,导致房水流出减少。
1.2 眼部调节刺激
Daniel等[17]分别给予50名健康儿童2.5 D和15 D的调节刺激,发现增大调节刺激后,TM长度、SC内外壁间距及前后径均增大。这与Xiang等[18]在近视儿童中进行的研究结果一致。他们推测调节刺激可引起睫状肌收缩,并通过巩膜突牵拉TM-SC,使得SC扩张。Chen等[19]通过频域OCT 观察到调节过程中巩膜突增长并与SC扩张显著相关,支持上述推测。但调节刺激导致TM-SC改变的持续时间和长远影响尚不明确,需进一步探究。
1.3 昼夜节律
眼压存在昼夜节律波动,正常人24 h眼压波动<8 mmHg(1 kPa=7.5 mmHg),而青光眼波动大于该范围并与其进展密切相关,具体节律机制尚不明确[20]。Liu等[21]证实健康人眼夜间房水流畅系数较日间下降,提示在昼夜节律调控下TM-SC的结构可能发生改变。Li等[22]采用高频超声生物显微镜(UBM)测量了29名健康受试者的SC和眼压,其中,SC在23:30扩张达到峰值,17:30缩小达到谷值,眼压的波动趋势恰好与SC变化相反。但Gao等[23]仅在下象限SC中观察到该负相关性,推测下象限SC更易受房水重力和动力学影响。SC昼夜节律变化除与眼压之间存在因果关系,可能还受自主神经等的调控[22]。上述研究中选择测量的时间点较少每天5次,未来研究中应增加测量的频率以获得更准确的节律变化。
1.4 呼吸模式
眼压波动受不同呼吸模式的影响。日常生活中,举重物、咳嗽等行为会不自觉地进行Valsalva动作(VM)[4];而VM分为4个阶段,主要通过血流压力变化与继发自主神经兴奋影响脉络膜和睫状肌等结构,导致眼压改变[24]。Sun等[25]发现,与VM前相比,VM第2阶段(交感神经兴奋阶段)眼压升高伴SC扩张。值得注意的是,上述VM中眼压升高伴SC扩张的结果和既往传统认知的眼压与SC关系相矛盾[26],研究者认为可能存在自主神经对SC的主导调控,但自主神经是否直接作用于SC尚缺乏足够的研究证据。
1.5 运动
已有研究报道,运动后眼压暂时降低并维持30~60 min,原因包括脱水、渗透压改变、交感神经兴奋等[27]。李木[28]观察到35名健康受试者慢跑20 min后眼压降低,TM厚度和长度均增大,SC扩张;休息后眼压和SC恢复,且SC恢复速度快于眼压,提示可能是SC塌陷导致眼压上升;该研究认为运动主要通过晶状体等毗邻结构位移的机械性牵拉导致TM-SC扩张,同时交感神经兴奋性变化与SC变化在时间上高度吻合,表明交感神经可能也调控其形态改变。为探究运动对青光眼的治疗潜能,Yuan等[29]发现,原发性开角型青光眼(POAG)患者在运动后眼压下降且幅度大于正常人群。目前运动对眼压和TM-SC的确切作用机制和长期影响尚未明晰,未来仍需深入研究。
1.6 头位和体位
研究表明,颈部居中及坐位时眼压最低,其他头位和体位的改变均会引起眼压升高[30]。血流改变引起上巩膜静脉压升高是其主要原因,但上巩膜静脉压每上升0.83 mmHg仅引起眼压升高1 mmHg,提示可能还存在其他机制。Chen等[31]在低头倾斜试验中发现,20°头倾15 min后SC横截面积减小,伴随心率变异性高频域升高,提示副交感神经兴奋,这表明副交感神经兴奋可能会引起SC塌陷及眼压升高。但Selvadurai等[32]利用Schiotz眼压计测量发现,21位受试者坐位与仰卧位房水流畅系数无明显差别。由于样本量少及测量准确性等因素,该相关性仍需进一步证实。
1.7 饮食
大量饮水后可观察到眼压升高,其原因可能是上巩膜静脉压升高与脉络膜充血膨胀。Chen等[33]在饮水试验中观察到眼压升高,SC较饮水前塌陷,伴副交感神经兴奋,推测该过程中自主神经调控SC从而影响了眼压。咖啡因、酒精及茶等其他种类饮食与眼压变化及青光眼发病率相关[4],但对SC形态的影响尚不明确。大部分相关研究属于观察性实验,缺乏对其机制的探究。
2 青光眼患者的TM-SC形态变化
2.1 POAG
2.1.1 影像结构
Yan等[34]采用扫频OCT观察发现,POAG眼TM厚度和长度均小于正常眼;同时该研究通过高频UBM观察到POAG眼SC前后径及内外壁间距均较正常眼减小[35]。Hong等[36]进一步对比了二者的SC横截面积,同样呈现塌陷的趋势。
2.1.2 显微结构
Kuehn等[2]在光镜下观察发现,POAG眼TM厚度减小,小梁束融合,TMC显著减少,推测细胞密度下降使眼压调节能力减弱;同时该研究观察到不同POAG眼之间TM形态差异大,认为与不同的疾病阶段相关。与TM的变化类似,Allingham等[37]观察到POAG眼的SC较正常眼明显塌陷,内皮细胞密度下降。而Swain等[38]则认为是POAG眼巩膜突太短不足以牵拉维持SC形态。上述研究提示TM-SC结构的改变可能源于细胞的减少。
2.1.3 超微结构
POAG眼TMC出现明显退行性改变:细胞核肿胀或皱缩,线粒体水肿和嵴扩张,细胞器减少,细胞膜不完整甚至崩解坏死,推测POAG眼TM早衰,TMC加速凋亡,从而引起整体功能下降,并通过衰老相关β-半乳糖苷酶染色得以验证[39]。ECM成分黏附沉着于弹性纤维鞘使其明显增厚,在横截面上表现为大量“鞘源性斑块”,即“SD斑块”(图2),这是POAG的标志性结构[40]。ECM成分复杂,使纤维鞘的厚度不规则,晚期可形成纤维板阻断房水流出。
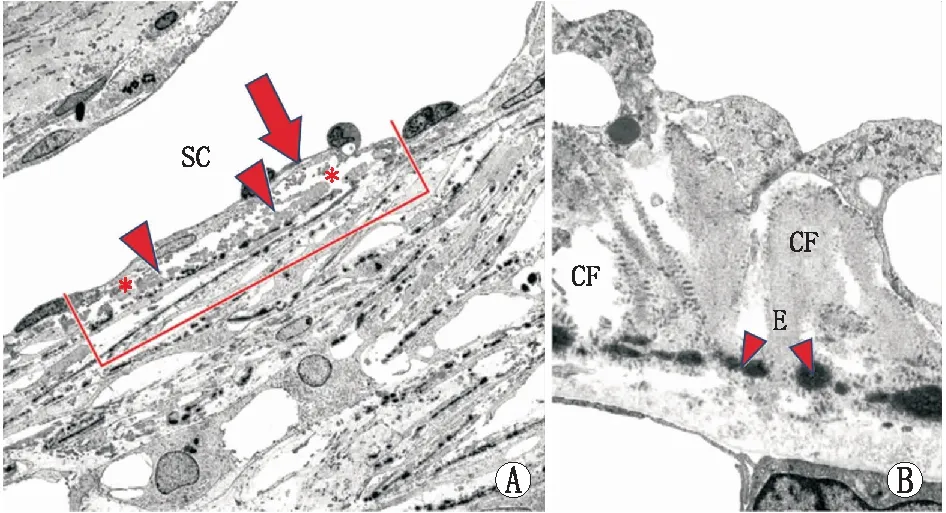
A:红线示SD斑块(红色三角处)、基底膜样物质(红色箭头处)及间隙(红色*处)的测量区域;B:SD斑块放大示意图,筛状弹性纤维网(E红色三角处)及其连接纤维(CF)被均匀的鞘样物质包绕。图2 POAG眼SC内壁及下方TM结构透射电子显微镜图像(图片来源:Tektas等,Exp Eye Res,2009.)
POAG眼SC内皮孔隙密度明显低于正常眼,分布不均匀[41]。孔隙密度下降使房水难以通过SC内壁,增大流出阻力。但人为操作因素,如眼球处理前离体时间、灌注时间及灌注量等均可能产生非生理性孔隙,干扰结果的判断[42]。这意味着探究SC内皮孔隙时,应统一和规范样本的处理,减少研究误差。
POAG的发生和发展与TM-SC刚度密切相关。Last等[43]采用AFM测得POAG眼TM弹性模量大于正常眼,且在同一组织不同间隔处差异很大,侧面印证了房水节段性流出学说。但Camras等[44]则使用微应变分析仪以准静态单轴拉伸形式测量得出青光眼患者TM刚度小于正常眼的结果。2种测量结果的矛盾可能是由于二者测量范围不同从而反映了不同的力学性能。POAG眼SC内壁及下方组织刚度经AFM检测也较正常眼增大[45]。Overby等[46]通过改变培养SC细胞的基底刚度后发现,其会根据局部机械微环境调节自身刚度和相关基因的表达,且在青光眼中该敏感性更高。
2.2 原发性闭角型青光眼
2.2.1 影像结构
Choi等[47]发现,房角关闭眼TM长度小于正常眼,但在Cheung等[48]的研究中,闭角眼和开角眼TM长度无明显差别。人种差别可能是上述差异的主要原因之一。Hong等[36,49]对比原发性闭角型青光眼(PACG)患者及健康受试者SC后认为,PACG患眼SC较正常眼塌陷,行小梁切除术后SC较术前显著扩张。但Mansoori等[50]的研究结果与之相反,该研究观察到急性房角关闭眼SC的横截面积大于正常眼SC和眼压控制后的SC。因此需要进行不同类型与时期PACG患眼SC的对照研究,以明确PACG中SC的形态变化。
2.2.2 显微结构
病理学检查发现,急性PACG眼TM区域色素沉着,分布大量血细胞和巨噬细胞,TMC严重水肿;SC管腔无明显狭窄,腔内可见血细胞[51]。慢性PACG眼随疾病进展程度加重:TM纤维化加重,色素颗粒沉着逐渐增多,TMC减少、形态不规则、分布不均;SC逐渐塌陷,内皮细胞萎缩。可见,急性和慢性PACG的TM-SC结构差异显著:急性PACG以炎症性改变为主,而慢性PACG则以退行性改变为主。
2.2.3 超微结构
急性PACG眼TM布满无定形物,大量炎症细胞浸润;TMC严重肿胀,与基底膜间隙扩大、分离;SC内皮细胞水肿,不规则[52]。慢性PACG眼出现TMC线粒体肿胀、嵴缺失及细胞器减少等,ECM可见大量电子致密斑块沉积;SC不同程度塌陷,管腔内出现胶原蛋白、弹性纤维等成分,SC内皮细胞退变,细胞连接变薄、分离,甚至部分缺失[52-53]。房角关闭带来房水动力学改变,引起TM和SC不可逆性退行改变,或许是慢性PACG房角开放后眼压仍升高的原因。
2.3 原发性先天性青光眼
原发性先天性青光眼(PCG)与TM-SC发育缺陷有关。Gupta等[54]采用OCT在33例PCG患者的TM中均观察到高反射的异常组织膜覆盖;SC检出率远低于正常眼,提示SC狭小或缺失。Shi等[55]进一步证实PCG患眼的SC横截面积小于正常眼。PCG病理结构显示TM发育不全伴睫状肌广泛粘连,SC部分缺失甚至可直接与前房相通[56]。TM-SC发育缺陷致使房水流出通道畸形,增大了房水流出阻力,造成进一步损伤。
2.4 激素性青光眼
2.4.1 影像结构
对激素性青光眼(SIG)房水流出通道的影像结构研究主要为实验动物模型的观察。Li等[57]利用频域OCT观察到地塞米松(DEX)诱导的高眼压小鼠TM和SC大体正常,通过前房插管灌注升高眼压,比较SC横截面积变化,发现DEX组小鼠SC较对照组更不易塌陷。Li等[58]推测这与激素诱导的TM纤维化有关,并通过应用奈他舒地尔逆转了这一现象。
2.4.2 显微结构
Razali等[59]在DEX诱导的高眼压大鼠中观察到TM厚度较正常眼增大,TMC减少。Tawara等[60]对SIG人眼进行免疫组织化学检测,检测到TM中IV型胶原纤维与纤维连接蛋白等大量积累,TM间隙内充满基质物质;SC管腔则开放良好。形态学和免疫组织化学结果表明,DEX通过促进纤维化物质的表达改变TM结构进而影响了房水外流。
2.4.3 超微结构
DEX诱导的高眼压家兔眼TMC核呈异型性,胞浆空泡变性,粗面内质网激活扩张,微丝微管增多[61];Mccartney等[62]在经DEX干预后的TMC细胞膜表面观察到大量呈线性排列的融合囊泡,这提示细胞可能与外界物质交换频繁并引起ECM改变。JCT区ECM中出现指纹状排列的基底膜样物质积累是SIG的标志性结构(图3),已在SIG人眼及激素诱导的高眼压小鼠眼中得到验证[63-64]。此外,Ren等[65]在DEX诱导的高眼压小鼠眼中测量发现,JCT总体厚度减小,SC内壁下基底膜较正常眼更加连续致密,该研究认为上述超微结构的改变降低了有效滤过面积,减少了房水外流。
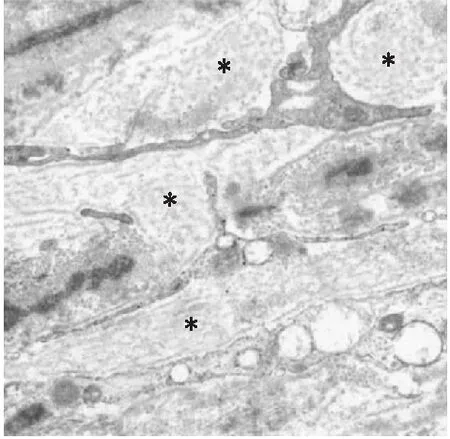
图3 SIG眼TM指纹状排列的基底膜样物质(*处)透射电子显微镜图像(图片来源:Tektas等,Exp Eye Res,2009.)
激素对TM的生物力学性质有重要影响。Li等[57]通过反有限元法计算得到DEX实验组小鼠眼的TM刚度是对照组的2倍。Raghunathan等[66]采用AFM检测到DEX处理后的TMC刚度明显增大,并伴细胞骨架改变与细胞收缩增强等。由此可见,激素通过多种复杂的机制诱导TM硬化致使眼压升高。
2.5 正常眼压性青光眼
目前,对正常眼压性青光眼(NTG)中TM的形态研究较少。光镜下见NTG患眼SC开放与正常眼接近[53]。NTG眼的淋巴管内皮细胞标志物D2-40与血栓调节蛋白等也与正常眼无差异[67]。NTG中TM-SC是否存在形态改变需要进一步的探究。
2.6 葡萄膜炎性青光眼
Yan等[68]通过扫频OCT观察到青光眼睫状体炎综合征高眼压眼TM较正常对侧眼增厚,且与眼压呈正相关,SC扩张;而正常眼压患眼TM-SC与对侧眼无差异。由此推测TM-SC的炎症水肿性阻塞可能是眼压升高的原因。葡萄膜炎性青光眼(UG)的TM区域炎症细胞浸润及纤维物质堵塞伴粘连的组织病理改变支持这一推测[69]。Tektas等[70]观察到3种不同类型的UG眼中TMC均减少且形态不规则,ECM出现类似SD斑块与指纹状物质等大量沉积;SC管腔可正常开放或不同程度闭塞,内壁下大量斑块沉积。上述结果表明,TM-SC的炎症反应和阻塞是UG眼压升高的主要原因。
2.7 新生血管性青光眼
新生血管性青光眼(NVG)的TM存在大量色素沉着,小梁束融合增厚,TMC大量坏死;可见明显的毛细血管样结构伴红细胞和炎症细胞浸润及水肿的纤维血管组织沉积[71-72]。电镜下观察到血管内皮细胞有大量窗孔,这提示着血管通透性增加和炎症反应发生。
2.8 色素性青光眼
色素性青光眼(PG)的TM以含大量色素颗粒为突出表现,研究发现,其体积大小与眼压呈正相关;TMC吞噬大量色素颗粒后因其毒性作用而死亡,导致数量减少及结构缺损[40]。Dang等[73]对猪眼输注色素颗粒后发现,眼压升高早于TMC吞噬功能崩溃,提示可能还存在独立的作用机制。PG患眼的SC存在不同程度闭塞,内壁下SD斑块类似物与纤维物质等沉着增多[74]。色素脱落堵塞可能引起TM-SC形态改变和功能障碍,造成眼压升高。
多种类型青光眼患者TM-SC的形态改变见表1。不同类型青光眼患者TM-SC形态的改变不同程度地影响房水的流出,对临床诊治具有一定的意义,值得更深入研究。
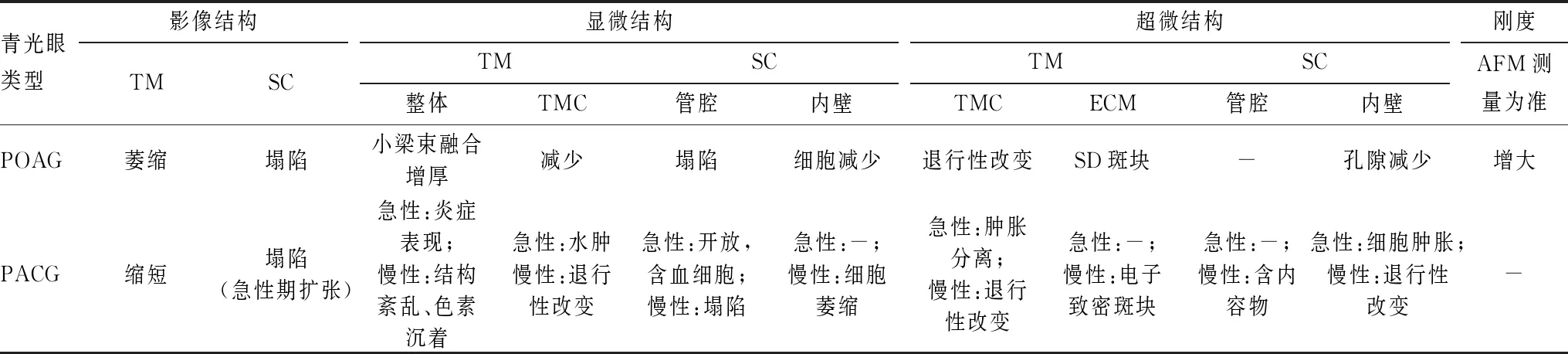
表1 各类型青光眼患者TM-SC的形态改变
3 结束语
TM-SC途径是主要的房水引流通道,维持眼压的动态平衡,并与眼压相互作用:正常眼压范围内,多因素影响TM-SC的结构变化进而引起眼压波动;高眼压引起TM压缩与SC塌陷等形态改变,其形态改变又会引起眼压升高加剧。通过对不同生理状态下健康人和不同类型青光眼患者TM-SC形态改变的探究,TM和SC将有望成为新的眼部用药靶点。
