LncRNA NEAT1调控miR-505-3p/VEGFA对碱烧伤大鼠角膜新生血管的影响△
2023-11-10程新潮吕旭东
程新潮 曹 瑾 杨 洁 吕旭东
角膜新生血管引起的角膜病变不仅是眼科最常见的致盲原因之一,而且是角膜移植术后患者视力丧失和免疫排斥反应发生的主要危险因素,角膜新生血管可由外伤、病原体感染、化学灼伤等因素诱导,与角膜损伤后促血管生成因子和抗血管生成因子之间的平衡被打破有关[1]。目前,尽管已有非甾体类抗炎药物、光动力疗法、激光光凝等多种角膜新生血管治疗方案,但治疗效果仍十分有限,且具有一定副作用[2]。因此,积极探索角膜新生血管的发病机制并寻找抑制角膜新生血管生成的作用靶点,对于开发有效的防治药物具有重要意义。越来越多的研究表明,长链非编码RNA(LncRNA)、微小RNA(miRNA)等非编码RNA在角膜新生血管的生成中发挥重要作用,且其可通过靶向多个信号转导途径参与调节眼部血管生成[3-4]。据报道,LncRNA核旁斑组装转录本1(NEAT1)在角膜新生血管大鼠中表达上调,可靶向miR-1246诱导核因子κB介导的炎症因子分泌,从而促进角膜新生血管进展[5]。但LncRNA NEAT1在角膜新生血管中的作用机制仍未明确。生物信息学分析显示,miR-505-3p与LncRNA NEAT1存在靶向结合位点,同时血管内皮生长因子A(VEGFA)可能是miR-505-3p的下游靶基因之一。此外,角膜新生血管组织中miR-505-3p表达下调,而VEGFA表达上调,且miR-505-3p/VEGFA轴可在LncRNA TUG1的靶向作用下参与调控人脐静脉内皮细胞(HUVECs)的血管生成[6]。然而,LncRNA NEAT1是否可通过调控miR-505-3p/VEGFA轴影响角膜新生血管进展尚有待阐明。基于此,本研究构建了碱烧伤大鼠角膜新生血管模型,旨在探讨LncRNA NEAT1对碱烧伤后角膜新生血管的影响及其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级健康雄性SD大鼠144只(均选取右眼为实验眼),6~7周龄,体重(210±20)g,购自北京北方艾特生物科技有限公司[生产许可证号:SCXK(京)2020-0005],在温度(24±1)℃、相对湿度(55±5)%、12 h/12 h光暗循环以及自由摄食和饮水的条件下统一饲养。实验前所有大鼠进行裂隙灯检查排除眼部病变。本研究动物实验程序均符合《实验动物饲养管理和使用指南》中相关要求,并经咸宁市中心医院伦理委员会批准(批号:202201-073)。
1.1.2 细胞
大鼠角膜上皮细胞购自赛百慷(上海)生物技术股份有限公司。细胞复苏后接种于含体积分数10%胎牛血清和10 g·L-1青-链霉素双抗的DMEM培养基中,置于37 ℃、体积分数5% CO2培养箱中培养,待细胞贴壁融合后消化并传代,取第3代对数生长期细胞进行后续实验。
1.1.3 主要试剂及仪器
短发卡RNA(shRNA)干扰LncRNA NEAT1(sh-NEAT1)及其阴性对照(sh-NC)、miR-505-3p拮抗剂(miR-505-3p antagomir)及其阴性对照(antagomir-NC)、野生型LncRNA NEAT1/VEGFA(WT-NEAT1/WT-VEGFA)和突变型LncRNA NEAT1/VEGFA(MUT-NEAT1/MUT-VEGFA)报告质粒、miR-505-3p模拟物(miR-505-3p mimic)及其阴性对照(miR-NC)、实时荧光定量PCR(qRT-PCR)实验中所用引物均购自上海吉玛制药技术有限公司;QuantiNova SYBR Green PCR试剂盒购自德国QIAGEN公司;苏木素-伊红(HE)染色试剂盒购自北京索莱宝科技有限公司;免疫组织化学试剂盒、DAB试剂盒购自北京百奥莱博科技有限公司;兔抗大鼠VEGFA、CD31、β-actin及HRP标记山羊抗兔IgG抗体购自美国Abcam公司;双荧光素酶报告基因检测试剂盒购自江苏凯基生物技术股份有限公司。裂隙灯显微镜及摄像系统购自卡尔蔡司(中国)有限公司;qRT-PCR仪购自瑞士Roche公司;生物显微镜购自日本Nikon公司;电泳仪、凝胶成像分析系统购自北京六一生物科技有限公司;酶标仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 碱烧伤大鼠模型构建及分组
大鼠适应性饲养1周后眼部滴加左氧氟沙星滴眼液预防感染,24 h后随机选取24只大鼠作为对照组,其余大鼠右眼构建角膜碱烧伤模型[7-8],具体方法为:20 g·L-1戊巴比妥钠腹腔注射麻醉,盐酸奥布卡因滴眼液滴眼3次进行眼部麻醉,直径3 mm的圆形滤纸片于1 mol·L-1NaOH溶液中浸泡10 s,随后将滤纸片贴敷于大鼠右眼角膜中央40 s,之后使用生理盐水冲洗结膜囊2 min,若角膜中央出现灰白色斑且虹膜纹理模糊,则表明造模成功。对照组大鼠除用生理盐水代替NaOH溶液外,其余操作同造模大鼠。造模成功的120只大鼠按随机数字表法分为模型组、sh-NC组、sh-NEAT1组、sh-NEAT1+antagomir-NC组和sh-NEAT1+miR-505-3p antagomir组,每组24只。其中,sh-NC组、sh-NEAT1组大鼠玻璃体内注射4 μL sh-NC或sh-NEAT1;sh-NEAT1+antagomir-NC组、sh-NEAT1+miR-505-3p antagomir组大鼠玻璃体内同时注射sh-NEAT1与antagomir-NC或miR-505-3p antagomir,共4 μL;对照组、模型组大鼠玻璃体内注射等量生理盐水。
1.2.2 大鼠角膜新生血管的定量分析
于碱烧伤后3 d、5 d、7 d使用裂隙灯显微镜观察大鼠角膜新生血管情况,并记录自角膜缘长出的新生血管长度(以连续弯曲度最小时,朝向角膜中央生长的最长血管的垂直长度为准)及数量。根据公式S=C/12×π×[r2-(r-l)2](其中,S为角膜新生血管面积,C为新生血管侵及角膜的圆周钟点数,r为角膜半径,l为新生血管长度)计算角膜新生血管面积。
1.2.3 qRT-PCR检测大鼠角膜中LncRNA NEAT1、miR-505-3p、VEGFA mRNA表达
碱烧伤后7 d,每组随机取6只大鼠采用过量戊巴比妥钠麻醉处死,摘取右眼角膜,Trizol试剂提取角膜中总RNA,将RNA逆转录为cDNA,随后以cDNA为模板配制qRT-PCR反应体系,在qRT-PCR仪上进行扩增,反应程序:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,共35个循环。采用2-ΔΔCt法计算LncRNA NEAT1、miR-505-3p、VEGFA mRNA相对表达量。引物序列:LncRNA NEAT1上游引物为5’-TGGCTAGCTCAGGGCTTCAG-3’,下游引物为5’-TCTCCTTGCCAAGCTTCCTTC-3’;miR-505-3p上游引物为5’-CTACGTGGGTCACCCCCTC-3’,下游引物为5’-CCAAAGGAGACCTCGTAGT-3’;VEGFA上游引物为5’-GGGAGCAGAAAGCCCATGAA-3’,下游引物为5’-GCTGGCTTTGGTGAGGTTTG-3’;β-actin上游引物为5’-CCCGCGAGTACAACCTTCTTG-3’,下游引物为5’-GTCATCCATGGCGAACTGGTG-3’;U6上游引物为5’-CTCGCTTCGGCAGCACA-3’,下游引物为5’-AACGCTTCACGAATTTGCGT-3’。
1.2.4 HE染色观察大鼠角膜病理学改变
碱烧伤后7 d,每组随机取6只大鼠采用过量戊巴比妥钠麻醉处死,摘取右眼角膜,40 g·L-1多聚甲醛固定24 h后制备常规石蜡切片(厚度为4 μm),切片经二甲苯脱蜡,递减浓度梯度乙醇水化后苏木素染色10 min、伊红染色30 s,递增浓度梯度乙醇脱水、二甲苯透明后中性树胶封片,于显微镜下观察各组大鼠角膜病理学改变。
1.2.5 免疫组织化学染色检测大鼠角膜中CD31表达
碱烧伤后7 d,每组随机取6只大鼠采用过量戊巴比妥钠麻醉处死,摘取右眼角膜,40 g·L-1多聚甲醛固定24 h后制备常规石蜡切片(厚度为4 μm),切片脱蜡至水后采用体积分数3% H2O2灭活内源性过氧化物酶,枸橼酸盐缓冲液热修复抗原,正常血清封闭后添加一抗(CD31稀释度为1:50;阴性对照使用PBS代替一抗)4 ℃孵育过夜,生物素标记二抗37 ℃孵育2 h,DAB显色、苏木素复染,于显微镜下观察并拍照。Image-Pro Plus 6.0软件测定阳性染色的积分光密度(IOD),计算平均IOD(MIOD),MIOD=IOD/选择面积,MIOD值越大表示CD31蛋白表达量越高。
1.2.6 Western blot检测大鼠角膜中VEGFA、CD31蛋白表达
碱烧伤后7 d,每组剩余的6只大鼠采用过量戊巴比妥钠麻醉处死,摘取右眼角膜,使用RIPA裂解液提取角膜总蛋白,BCA法检测蛋白浓度后SDS-PAGE凝胶电泳分离等量变性蛋白,并电转移至PVDF膜,50 g·L-1BSA室温封闭1 h后,在一抗(VEGFA稀释度为1:500;CD31稀释度为1:1 000;β-actin稀释度为1:2 000)中4 ℃孵育过夜,次日充分洗涤后在二抗(HRP标记山羊抗兔IgG,稀释度为1:50 000)中室温孵育1.5 h,ECL显色,Image-Pro Plus 6.0软件定量分析各蛋白条带灰度,计算VEGFA、CD31蛋白相对表达量。
1.2.7 双荧光素酶报告基因实验验证LncRNA NEAT1、miR-505-3p、VEGFA间靶向关系
Starbase数据库(http://starbase.sysu.edu.cn/)预测miR-505-3p与LncRNA NEAT1、VEGFA的潜在结合位点,并将LncRNA NEAT1、VEGFA与miR-505-3p结合的序列片段进行突变,构建WT-NEAT1、WT-VEGFA和MUT-NEAT1、MUT-VEGFA荧光素酶报告质粒。大鼠角膜上皮细胞以每孔5×103个接种于96孔板中,培养至70%融合时,采用Lipofectamine 3000将WT-NEAT1、WT-VEGFA和MUT-NEAT1、MUT-VEGFA荧光素酶报告质粒分别与miR-505-3p mimic(miR-505-3p mimic组)、miR-NC(miR-NC组)进行共转染(每种处理设6个复孔),转染48 h后参照双荧光素酶报告基因检测试剂盒说明检测相对荧光素酶活性。
1.3 统计学方法
2 结果
2.1 各组大鼠碱烧伤后不同时间点角膜新生血管面积比较
碱烧伤后3 d、5 d、7 d,对照组大鼠无角膜新生血管。碱烧伤后3 d、5 d、7 d,与对照组比较,模型组大鼠角膜新生血管面积均增加(均为P<0.05);与sh-NC组比较,sh-NEAT1组大鼠碱烧伤后各时间点角膜新生血管面积均减少(均为P<0.05);与sh-NEAT1+antagomir-NC组比较,sh-NEAT1+miR-505-3p antagomir组大鼠碱烧伤后各时间点角膜新生血管面积均增加(均为P<0.05);模型组与sh-NC组、sh-NEAT1组与sh-NEAT1+antagomir-NC组大鼠碱烧伤后各时间点角膜新生血管面积比较,差异均无统计学意义(均为P>0.05)(表1)。

表1 各组大鼠碱烧伤后不同时间点角膜新生血管面积比较 (n=6)
2.2 各组大鼠角膜中LncRNA NEAT1、miR-505-3p、VEGFA mRNA相对表达水平比较
碱烧伤后7 d,与对照组比较,模型组大鼠角膜中LncRNA NEAT1、VEGFA mRNA相对表达水平均升高,miR-505-3p相对表达水平降低(均为P<0.05);与sh-NC组比较,sh-NEAT1组大鼠角膜中LncRNA NEAT1、VEGFA mRNA相对表达水平均降低,miR-505-3p相对表达水平升高(均为P<0.05);与sh-NEAT1+antagomir-NC组比较,sh-NEAT1+miR-505-3p antagomir组大鼠角膜中VEGFA mRNA相对表达水平升高,miR-505-3p相对表达水平降低(P<0.05);模型组与sh-NC组、sh-NEAT1组与sh-NEAT1+antagomir-NC组大鼠角膜中LncRNA NEAT1、miR-505-3p、VEGFA mRNA相对表达水平比较,差异均无统计学意义(均为P>0.05)(表2)。
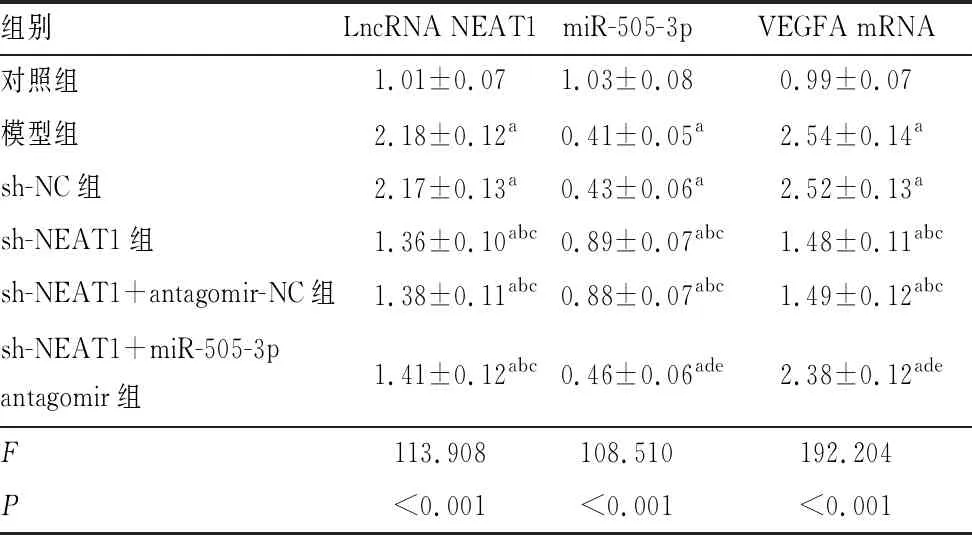
表2 各组大鼠角膜中LncRNA NEAT1、miR-505-3p、VEGFA mRNA相对表达水平比较 (n=6)
2.3 各组大鼠角膜病理学改变
碱烧伤后7 d,对照组大鼠角膜结构清晰、无炎症细胞浸润、上皮细胞无破坏;模型组大鼠角膜组织结构紊乱,可见中性粒细胞等炎症细胞浸润,上皮细胞缺损;sh-NC组大鼠角膜组织病理学改变与模型组相似;与sh-NC组比较,sh-NEAT1组大鼠角膜组织炎症细胞浸润、上皮细胞缺损等病理学损伤均有所改善;sh-NEAT1+antagomir-NC组大鼠角膜组织病理学改变与sh-NEAT1组相似;与sh-NEAT1+antagomir-NC组比较,sh-NEAT1+miR-505-3p antagomir组大鼠角膜组织病理学损伤加重(图1)。

A:对照组;B:模型组;C:sh-NC组;D:sh-NEAT1组;E:sh-NEAT1+antagomir-NC组;F:sh-NEAT1+miR-505-3p antagomir组。图1 HE染色示各组大鼠角膜病理学改变
2.4 各组大鼠角膜中CD31表达情况比较
对照组大鼠角膜组织中CD31呈阴性表达(MIOD 为0)。与对照组比较,模型组大鼠角膜中CD31表达水平(MIOD为0.89±0.08)升高(P<0.05);与sh-NC组大鼠角膜中CD31表达水平(MIOD为0.88±0.07)比较,sh-NEAT1组大鼠角膜中CD31表达水平(MIOD为0.54±0.06)降低(P<0.05);与sh-NEAT1+antagomir-NC组大鼠角膜中CD31表达水平(MIOD为0.55±0.05)比较,sh-NEAT1+miR-505-3p antagomir组大鼠角膜中CD31表达水平(MIOD为 0.81±0.07)升高(P<0.05);模型组与sh-NC组、sh-NEAT1组与sh-NEAT1+antagomir-NC组大鼠角膜中CD31表达水平比较,差异均无统计学意义(均为P>0.05)(图2)。
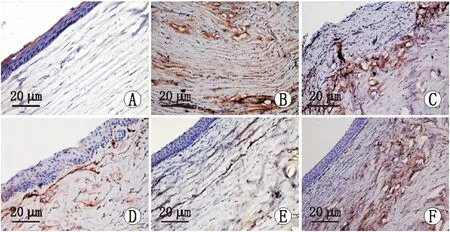
A:对照组;B:模型组;C:sh-NC组;D:sh-NEAT1组;E:sh-NEAT1+antagomir-NC组;F:sh-NEAT1+miR-505-3p antagomir组。图2 免疫组织化学染色示各组大鼠角膜CD31表达情况
2.5 各组大鼠角膜中VEGFA、CD31蛋白相对表达水平比较
与对照组比较,模型组大鼠角膜中VEGFA、CD31蛋白相对表达水平均升高(均为P<0.05);与sh-NC组比较,sh-NEAT1组大鼠角膜中VEGFA、CD31蛋白相对表达水平均降低(均为P<0.05);与sh-NEAT1+antagomir-NC组比较,sh-NEAT1+miR-505-3p antagomir组大鼠角膜中VEGFA、CD31蛋白相对表达水平均升高(均为P<0.05);模型组与sh-NC组、sh-NEAT1组与sh-NEAT1+antagomir-NC组大鼠角膜中VEGFA、CD31蛋白相对表达水平比较,差异均无统计学意义(均为P>0.05)(图3、表3)。

A:对照组;B:模型组;C:sh-NC组;D:sh-NEAT1组;E:sh-NEAT1+antagomir-NC组;F:sh-NEAT1+miR-505-3p antagomir组。图3 Western blot检测示各组大鼠角膜VEGFA、CD31蛋白表达情况
2.6 双荧光素酶报告基因实验结果
Starbase数据库预测显示,miR-505-3p与LncRNA NEAT1、VEGFA均存在靶向结合位点(图4)。

图4 miR-505-3p与LncRNA NEAT1、VEGFA的靶向结合位点
与miR-NC组比较,miR-505-3p mimic组共转染WT-NEAT1、WT-VEGFA的大鼠角膜上皮细胞相对荧光素酶活性均降低(均为P<0.05),而共转染MUT-NEAT1、MUT-VEGFA的大鼠角膜上皮细胞相对荧光素酶活性差异均无统计学意义(均为P>0.05)(表4)。

表4 各组大鼠角膜上皮细胞相对荧光素酶活性比较 (n=6)
3 讨论
目前,角膜新生血管仍是一种严重威胁视力的疾病,可导致角膜水肿、持续性炎症和视力丧失,故探寻抑制血管生成因子合成与分泌的分子途径至关重要[9]。有研究表明,LncRNA除参与恶性肿瘤等疾病的血管生成外,与角膜新生血管中血管生成亦密切相关,例如,LncRNA Meg3在碱烧伤模型小鼠和VEGF诱导的HUVECs中过表达,而抑制LncRNA Meg3表达可降低角膜损伤程度及血管生成标志物VEGFA和CD31表达,同时减少VEGF诱导的HUVECs中血管生成[10];LncRNA SNHG1敲低通过调控miR-195-5p/VEGF-A抑制角膜血管生成[3];LncRNA H19通过抑制miR-29c并上调VEGFA来增强角膜新生血管进展[11]。因此,靶向调节LncRNA可能是治疗角膜新生血管的一种途径。
多项研究结果显示,LncRNA NEAT1是一种促进血管生成的LncRNA,可通过靶向miR-495-3p在烧伤败血症发生过程中调节血管生成[12],通过miR-125a-5p/VEGF途径促进肝癌血管生成[13]。本研究中,碱烧伤大鼠角膜中LncRNA NEAT1表达水平、新生血管面积、血管内皮细胞标记物CD31蛋白表达水平均显著升高,提示LncRNA NEAT1参与碱烧伤大鼠角膜新生血管的生成,这与Bai等[5]报道的LncRNA NEAT1可促进炎症反应并诱导角膜新生血管形成相一致;且碱烧伤大鼠角膜组织存在炎症细胞浸润、上皮细胞缺损等病理学损伤,而注射sh-NEAT1干扰碱烧伤大鼠角膜中LncRNA NEAT1表达后,角膜中LncRNA NEAT1表达水平降低的同时,角膜新生血管面积和CD31蛋白表达水平亦显著降低,角膜组织病理学损伤有所改善,提示干扰 LncRNA NEAT1可能抑制碱烧伤大鼠炎症细胞浸润和角膜新生血管生成。
众所周知,促血管生成因子和抑制血管生成因子的失衡是角膜新生血管形成的一个最主要因素,角膜新生血管发生时VEGF表达上调,而应用VEGF拮抗剂也是目前防治角膜新生血管中血管生成的策略之一[14]。miRNA在角膜新生血管形成中的作用亦日益受到重视,且多个miRNA分子与VEGF密切相关[15-16]。VEGF家族成员VEGFA已被报道在角膜新生血管形成有关的LncRNA-miRNA-mRNA相互作用网络中作为mRNA扮演着关键角色[3,6,10-11]。miR-505-3p是一种研究较多的肿瘤抑制因子,可作为LncRNA的作用靶点参与调控肿瘤进展[17-18]。本研究结果显示,相比于对照组,模型组大鼠角膜中miR-505-3p相对表达水平降低,VEGFA mRNA和蛋白表达升高,表明miR-505-3p、VEGFA均参与碱烧伤大鼠角膜新生血管生成,提示miR-505-3p下调、VEGFA上调可促进角膜新生血管生成。此外,双荧光素酶报告基因实验验证显示,大鼠角膜上皮细胞中miR-505-3p与LncRNA NEAT1、VEGFA均存在靶向关系;而干扰LncRNA NEAT1可上调碱烧伤大鼠角膜中miR-505-3p表达水平,并下调VEGFA mRNA和蛋白表达水平,提示干扰 LncRNA NEAT1抑制碱烧伤大鼠角膜新生血管生成的机制可能与靶向上调miR-505-3p并下调VEGFA表达有关。已有研究证实,VEGFA mRNA是miR-505-3p的下游靶点,LncRNA TUG1通过竞争性结合miR-505-3p减轻对VEGFA mRNA的抑制,从而促进VEGFA的表达和血管生成[6]。本研究进一步在干扰LncRNA NEAT1表达基础上抑制miR-505-3p表达发现,抑制miR-505-3p表达可减弱干扰LncRNA NEAT1表达对碱烧伤大鼠角膜新生血管面积和VEGFA、CD31表达水平的抑制作用,并加重角膜组织病理学损伤。该结果更加充分地表明LncRNA NEAT1可能通过调控miR-505-3p/VEGFA轴促进碱烧伤大鼠角膜新生血管生成。
4 结论
干扰LncRNA NEAT1可能通过靶向上调miR-505-3p并下调VEGFA表达,抑制碱烧伤大鼠角膜新生血管生成,靶向抑制LncRNA NEAT1可能是角膜新生血管的一个潜在治疗方法。本研究为角膜新生血管的发病机制研究和治疗靶点选择提供了新的实验证据,但本研究仅通过体内动物实验进行了初步探索,仍有待通过体外细胞实验进一步验证LncRNA NEAT1/miR-505-3p/VEGFA在角膜新生血管中的作用机制。
