亚低温治疗对猪心脏骤停体外心肺复苏后凝血功能及炎性因子的影响
2023-11-08王晋祥续国武靳衡贺斌柴艳芬
王晋祥 续国武 靳衡 贺斌 柴艳芬
摘要:目的 探討亚低温治疗对猪心脏骤停(CA)体外心肺复苏(ECPR)后凝血功能及炎性因子的影响。方法 采用随机数字表法将12只巴马香猪分为对照组、常温组和亚低温组,每组4只。常温组和亚低温组经右心室诱颤建立CA模型,随后采用体外膜肺氧合(ECMO)进行ECPR,常温组目标体温37 ℃,亚低温组目标体温34 ℃,对照组仅进行造模常规置管。24 h后处死动物,取静脉血检测凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)及D-二聚体(D-D)水平。采用酶联免疫吸附试验(ELISA)测定肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)的表达水平。结果 常温组和亚低温组PT、APTT、TT、FIB、D-D、TNF-α及IL-6表达水平均高于对照组,亚低温组各指标低于常温组(P<0.05)。结论 亚低温治疗可显著改善猪CA经ECPR后凝血功能,并降低炎性因子表达水平,从而减轻ECPR相关并发症及炎症反应的发生。
关键词:亚低温;心脏骤停;体外心肺复苏;凝血功能;炎性因子
中图分类号:R459.7文献标志码:ADOI:10.11958/20230001
Effects of mild hypothermia treatment on coagulation function and inflammatory factors in a swine model after cardiac arrest and extracorporeal cardiopulmonary resuscitation
WANG Jinxiang XU GuowuJIN Heng HE Bin CHAI Yanfen
1 Department of Emergency Medicine, Tianjin Medical University General Hospital,Tianjin 300052, China; 2 Department of Oncology, the First Affiliated Hospital of Tianjin University of Traditional Chinese Medicine
Corresponding Author E-mail: chaiyanfen2012@126.com
Abstract: Objective To investigate effects of mild hypothermia treatment on coagulation function and inflammatory factors in a swine model of extracorporeal cardiopulmonary resuscitation (ECPR) after cardiac arrest (CA). Methods Using random number table method, twelve Bama pigs were divided into the control group, the normal temperature group and the mild hypothermia group with four pigs in each group. CA model was established by right ventricular fibrillation in the normal temperature group and the mild hypothermia group, and then ECPR was performed by extracorporeal membrane oxygenation (ECMO). The target temperature of the normal temperature group was 37 ℃, and the mild hypothermia group was 34 ℃. Control group was only given conventional tube placement. Pigs were killed 24 hours later, and venous blood was taken to detect levels of prothrombin time (PT), activated partial thromboplastin time (APTT), thrombin time (TT), fibrinogen (FIB) and D-dimer antigen (D-D). Expression levels of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) were detected by enzyme linked immunosorbent assay (ELISA). Results Compared with the control group, PT, APTT, TT, FIB, D-D and expression levels of TNF-α and IL-6 were significantly increased in the normal temperature group and the mild hypothermia group. Compared with the normal temperature group, the above indicators were decreased significantly in the mild hypothermia group (P<0.05). Conclusion Mild hypothermia treatment can significantly improve coagulation function and reduce the release of inflammatory factors in a swine model of ECPR after CA, so as to alleviate the occurrence of ECPR-related complications and inflammatory reactions.
Key words: mild hypothermia;cardiac arrest;extracorporeal cardiopulmonary resuscitation;coagulation function;inflammatory factor
心脏骤停(cardiac arrest,CA)是一个全球性的重大公共卫生问题[1]。研究显示我国每年因CA死亡的人数高达103万例[2]。而院外心脏骤停(out-of-hospital cardiac arrest,OHCA)复苏存活率仅为2%~12%[3]。体外心肺复苏(ECPR)较传统心肺复苏(CPR)能够有效恢复自主循环(return of spontaneous circulation,ROSC),并将复苏成功率和出院成活率提升至47%和34.8%[4]。目标体温管理(targeted temperature management,TTM)是应用物理和(或)化学方法将核心体温快速降到目标温度,维持一定时间后缓慢升温至正常生理体温的过程[5]。美国心脏协会心肺复蘇和心血管急救指南推荐CPR复苏成功后应采取亚低温治疗以恢复重要脏器功能,减少严重并发症的发生[6]。目前关于亚低温治疗在CA患者CPR中的应用研究广泛,且已证实亚低温可减轻CA患者全身炎症反应,保护重要脏器功能[7]。而亚低温在CA患者ECPR中的相关研究较少。另外,亚低温对凝血功能的影响尚存争议,其可通过影响生理凝血过程及其代谢物质缓解或者加重凝血功能障碍[8]。本研究通过探讨亚低温治疗对猪心脏骤停体外心肺复苏后凝血功能及炎性因子的影响,为其临床应用提供实验依据。
1 资料与方法
1.1 一般资料
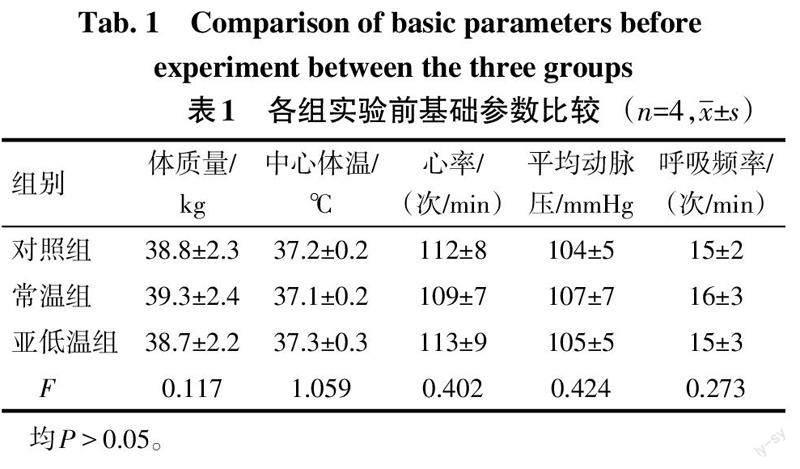
1.1.1 实验动物和分组 选取健康实验用普通级巴马香猪12只,13~15月龄,雄性,体质量35~45 kg,均购自天津市百农实验动物繁育科技有限公司,动物生产许可证号:SCXK(津)2020-0002;实验于天津中医药大学实验动物中心完成,动物使用许可证号:SYXK(津)2020-0005。实验前禁食24 h,不禁水。采用随机数字表法将其分为对照组、常温组和亚低温组,每组4只。记录各组动物实验前体质量、中心体温、血流动力学参数(心率、平均动脉压)及呼吸频率。常温组和亚低温组经右心室诱颤建立CA模型,随后采取ECPR,常温组控制目标体温至37 ℃,亚低温组控制目标体温至34 ℃;对照组仅进行常规麻醉、气管插管与CA模型置管,采用控温毯控制目标体温至37 ℃。本研究通过天津中医药大学实验动物伦理委员会审批(批准号:TCM-LAEC2022039)。
1.1.2 实验设备 实验体外膜肺氧合(ECMO)系统,包括:滚压式血泵、WEL-1000Wplus热交换水箱(天津汇康医用设备有限公司);膜式氧合器、配套管路及股动脉插管15F、股静脉插管17F(德国Maquet公司);心电监护仪、大动物呼吸麻醉一体机、纤维支气管镜、除颤仪、心肺复苏机、手术床、吊塔吊灯、控温毯(深圳迈瑞生物医疗电子股份有限公司);便携式超声仪(Philips);高频电刀及电凝设备(北京索吉瑞);电子磅秤(上海鼎拓实业有限公司);外科手术器械。
1.1.3 麻醉及术前准备 实验猪称体质量后给予戊巴比妥钠30 mg/kg肌内注射,诱导麻醉成功后持续泵入丙泊酚4~6 mg/(kg·h)维持麻醉。经纤维支气管镜辅助下行气管插管,呼吸机辅助机械通气(潮气量10 mL/kg,频率15次/min,吸入氧浓度40%);同时辅以1%~3%异氟烷持续吸入麻醉。连接心电监护仪,将体温探头经润滑后置入肛门5 cm,实时监测体温变化。床旁超声引导于一侧股动脉置入脉波指示剂连续心输出量监测(pulse-indicator continuous cardiac output,PiCCO)动脉4F测压导管,用于实时监测有创血压变化。给予乳酸钠林格、5%葡萄糖氯化钠注射液10~15 mL/(kg·h)交替持续静脉补液。
1.1.4 ECMO安装与预充 ECMO由滚压泵、膜式氧合器及配套管路组成。ECMO管路采用无血预充,预充液采用0.9%无菌生理盐水。预充完毕后调整为待机状态。ECMO导管置入:床旁超声引导下行股动静脉穿刺置管,动脉插管置管深度10~15 cm,静脉插管置管深度30~45 cm(以导管尖端达右心房为准)。确认插管位置后用管道钳夹闭,静脉推注1 mg/kg肝素钠注射液预抗凝,妥善缝合固定。
1.2 方法
1.2.1 建立CA模型 床旁超声引导下经颈内静脉将双极起搏电极送入右心室,当电极置入深度18~22 cm时,心电监护仪提示出现室性期前收缩或室性心动过速,提示电极位置抵达右心室心内膜。开始予以电流刺激(9 V直流电),持续3~5 s,参照评估标准[9][出现室颤心律;收缩压下降至25 mmHg(1 mmHg = 0.133 kPa)]确认成功诱导室颤致心脏骤停后,停止机械通气,观察5~10 min,期间不予任何干预,随后启动ECPR抢救流程。
1.2.2 实施ECPR 持续胸外按压,按压频率120次/min,按压深度为3~4 cm;立即恢复机械通气(吸入氧浓度100%,潮气量10 mL/kg,频率15次/min,);实施非同步直流电击除颤(双向200 J),间断静脉注射肾上腺素(0.02 mg/kg)、胺碘酮(2.5 mg/kg)直至心搏恢复,重新建立循环。同时将实验动物股动静脉插管分别连接预充好的ECMO管路,ECMO流量调整为20~40 mL/(kg·min),氧流量调整为1.0~1.5 mL/min。维持平均动脉压>65 mmHg,并适当补充复方氯化钠、羟乙基淀粉及调整电解质、酸碱平衡。
1.2.3 体温管理 各组实验均在25 ℃恒定室温下进行操作;亚低温组通过ECMO变温水箱将目标温度保持34 ℃;常温组通过ECMO变温水箱将目标温度保持37 ℃;对照组采用控温毯将目标体温保持37 ℃;亚低温组和常温组动物维持治疗24 h后按伦理规定处死,对照组动物继续进行后续实验。
1.2.4 标本收集与指标检测 (1)凝血功能指标。取静脉血5 mL,3 000 r/min离心15 min,取上清液。采用全自动凝血分析仪(美德太平洋公司),利用光电学原理方法[10]测定凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)及D-二聚体(D-Dimer)水平。(2)炎性因子。采用酶联免疫吸附试验(ELISA)测定肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)表达水平。试剂盒购自上海轩泽抗生物有限公司,实验步骤严格按照试剂盒说明书操作。
1.3 统计学方法 采用SPSS 20.0软件进行数据分析。符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组实验前基础参数对比 各组动物实验前体质量、中心体温、血流动力学参数(心率、平均动脉压)、呼吸频率比较差异无统计学意义(P>0.05),见表1。其中常温组和亚低温组均成功经右心室诱颤制作CA模型,并成功实施ECPR,复苏成功率100%。
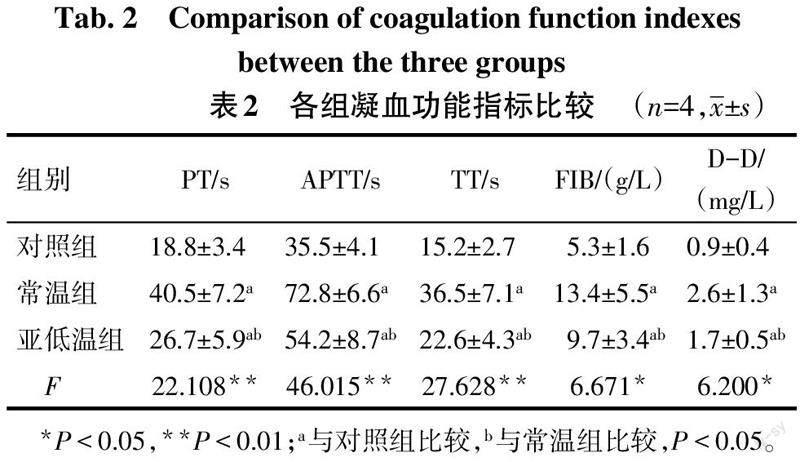
2.2 各组凝血功能指标比较 与对照组相比,常温组和亚低温组PT、APTT、TT、FIB及D-D水平升高(P<0.05);与常温组相比,亚低温组PT、APTT、TT、FIB及D-D水平降低(P<0.05),见表2。
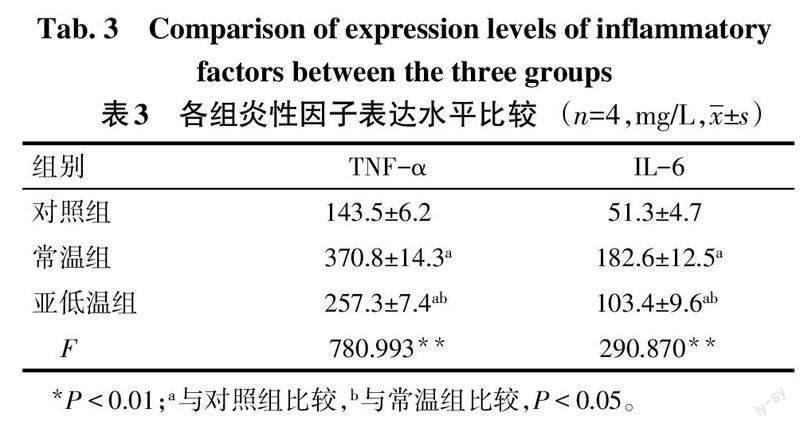
2.3 各组炎性因子表达水平比较 与对照组相比,常温组和亚低温组TNF-α、IL-6表达水平升高(P<0.05);与常温组相比,亚低温组TNF-α、IL-6表达水平降低(P<0.05),见表3。
3 讨论
CA是目前临床最常见的危急重症之一[11]。美国心脏协会心肺复苏指南推荐对CA患者行高质量CPR应在早期使用ECMO,称为ECPR[12]。ECPR治疗可将CA患者的ROSC从47%提高至95%[13]。研究证实亚低温治疗在ECPR中发挥保护作用,能夠有效改善复苏后神经功能和远期生存率[14]。美国心脏协会和国际复苏联合协会(ILCOR)联合推荐目标温度为32~36 ℃,达到目标温度后TTM保持24 h,可改善ECPR预后[15]。目前针对行ECPR的患者给予亚低温治疗的具体方式尚未明确。在CHEER研究[16]中,快速经静脉给予30 mL/kg冰盐水诱导体内低温,34 ℃维持24 h,结果显示,96%的患者达到ROSC,54%的患者神经功能完好出院。有研究提出采用体外膜肺的控温系统进行体温管理,易于监控和调节,并能达到可靠稳定的降温目标[17]。本研究采用ECMO的变温水箱进行亚低温治疗,将目标体温设为34 ℃,达到指定温度后持续治疗24 h,可有效实现TTM。
CA患者经ECPR后,机体重要脏器在经历快速完全缺血后遭受缺血-再灌注损伤,涉及全身凝血、纤溶系统的紊乱,以及炎症反应、氧化应激等多种机制[18]。而固有免疫、炎症反应及凝血反应三者之间存在紧密联系[19]。机体受创后,血管内细胞发生的免疫反应会触发特异性凝血通路,使机体从高凝继发低凝性凝血功能障碍[20]。Mezger等[21]研究发现,亚低温对凝血功能的影响是双面的,不同的治疗深度和持续时间可能改善或加重凝血功能障碍。Kim等[22]研究表明,轻度低温(34~36 ℃)对应激状态下的凝血功能具有改善作用,但体温过低会抑制纤溶酶原激活物,导致血小板功能障碍,波及凝血酶动力学,进而造成凝血功能障碍。本研究中常温组和亚低温组PT、APTT、TT、FIB及D-D水平均较对照组升高,提示CA经ECPR后出现凝血、纤溶系统的紊乱,导致凝血功能障碍;亚低温组凝血功能指标较常温组降低,提示通过亚低温治疗后可改善凝血功能障碍,其可能与合理把控亚低温治疗深度、持续时间和有效保护的时间治疗窗有关。
CA后会引发多种炎性因子的过度释放,通过多种机制引起细胞损伤和凋亡。TNF-α不仅可激活炎症反应,还可诱导细胞因子、炎性介质的释放,进而激活炎症级联反应[23];IL-6是一种T细胞活化免疫调节因子,参与体内炎症反应及免疫应答过程,其升高幅度与ECPR后机体炎症反应程度有关[24]。有研究表明,亚低温治疗能降低CA经ECPR成功后患者血清TNF-α、IL-6水平,改善患者预后[25]。本研究发现,常温组和亚低温组TNF-α、IL-6表达水平较对照组升高,提示实验动物CA经ECPR后机体释放大量炎性因子;亚低温组炎性因子表达水平较常温组降低,与杨小红等[26]研究结果一致,提示亚低温治疗可减少实验动物CA经ECPR后炎性介质和细胞因子的释放,从而减轻缺血-再灌注损伤诱发的全身炎症反应。
综上所述,亚低温治疗可有效改善猪CA经ECPR后的凝血功能,降低炎性因子表达水平,从而减轻炎症反应,这一发现可为CA经ECPR后的临床治疗提供参考。
参考文献
[1] KALRA R,KOSMOPOULOS M,GOSLAR T,et al. Extracorporeal cardiopulmonary resuscitation for cardiac arrest[J]. Curr Opin Crit Care,2020,26(3):228-235. doi:10.1097/MCC.0000000000000717.
[2] XIE X,ZHENG J Q,ZHENG W,et al. Efforts to improve survival outcomes of out-of-hospital cardiac arrest in China:BASIC-OHCA[J]. Circ Cardiovasc Qual Outcomes,2023,16(2):e008856. doi:10.1161/CIRCOUTCOMES.121.008856.
[3] INOUE A,HIFUMI T,SAKAMOTO T,et al. Extracorporeal cardiopulmonary resuscitation for out-of-hospital cardiac arrest in adult patients[J]. J Am Heart Assoc,2020,9(7):e015291. doi:10.1161/JAHA.119.015291.
[4] SANDRONI C,CRONBERG T,SEKHON M. Brain injury after cardiac arrest:pathophysiology,treatment,and prognosis[J]. Intensive Care Med,2021,47(12):1393-1414. doi:10.1007/s00134-021-06548-2.
[5] 逄利,穆宇航,邢吉紅. 心肺复苏后的目标体温管理[J]. 中华急诊医学杂志,2023,32(1):13-16. PANG L,MU Y H,XING J H. Target temperature management after cardiopulmonary resuscitation[J]. Chin J Emerg Med,2023,32(1):13-16. doi:10.3760/cma.j.issn.1671-0282.2023.01.004.
[6] FERNANDO S M,DI SANTO P,SADEGHIRAD B,et al. Targeted temperature management following out-of-hospital cardiac arrest:a systematic review and network Meta-analysis of temperature targets[J]. Intensive Care Med, 2021,47(10): 1078-1088. doi:10.1007/s00134-021-06505-z.
[7] 赵旭岩,隋欣. 亚低温治疗在心肺复苏后患者中的应用进展[J]. 医学综述,2021,27(7):1380-1384. ZHAO X Y,SUI X. Application progress of therapeutic hypothermia in patients after cardiopulmonary resuscitation[J]. Medical Recapitulate,2021,27(7):1380-1384. doi:10.3969/j.issn.1008-5971.2017.09.017.
[8] TR?BKA-ZAWICKI A,TOMALA M,ZELIA? A,et al. Adaptation of global hemostasis to therapeutic hypothermia in patients with out-of-hospital cardiac arrest:Thromboelastography study[J]. Cardiol J,2019,26(1):77-86. doi:10.5603/CJ.a2017.0080.
[9] 王智渊,褚莉莉,刘伯夫,等.心脏骤停-心肺复苏猪模型的构建与应用[J]. 中华急诊医学杂志,2022,31(3):407-413. WANG Z Y,CHU L L,LIU B F,et al. Cardiac arrest-Construction and application of cardiopulmonary resuscitation a swine model [J]. Chin J Emerg Med,2022,31(3):407-413. doi:10.3760/cma.j.issn.1671-0282.2022.03.029.
[10] 张媛,赵昕亚,何帮顺,等. 3种凝血功能检测方法的参数差异及在临床应用中的比较[J].临床检验杂志,2022,40(6):405-408,437. ZHANG Y,ZHAO X Y,HE B S,et al. Comparison of parameters of three blood coagulation assays in clinical application[J].Chin J Clin Lab Sci,2022,40(6):405-408,437. doi:10.13602/j.cnki.jcls.2022.06.02.
[11] LUDWIN K,SAFIEJKO K,SMEREKA J,et al. Systematic review and meta-analysis appraising efficacy and safety of adrenaline for adult cardiopulmonary resuscitation[J]. Cardiol J,2021,28(2):279-292. doi:10.5603/CJ.a2020.0133.
[12] KLEINMAN M E,BRENNAN E E,GOLDBERGER Z D,et al. Part 5:adult basic life support and cardiopulmonary resuscitation quality:2015 American heart association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation,2015,132(18 Suppl 2):S414-S435. doi:10.1161/CIR.0000000000000259.
[13] OLASVEENGEN T M,MANCINI M E,PERKINS G D,et al. Adult basic life support:2020 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations[J]. Circulation,2020,142(16_suppl_1):S41-S91. doi:10.1161/CIR.0000000000000892.
[14] 李佩娟,龚平. 心肺复苏后目标温度管理的最新评价[J]. 中华急诊医学杂志,2022,31(4):432-435. LI P J,GONG P. The latest evaluation of target temperature management after cardiopulmonary resuscitation[J]. Chin J Emerg Med,2022,31(4):432-435. doi:10.3760/cma.j.issn.1671-0282.2022.04.002.
[15] MORRISON L J,THOMA B. Translating targeted temperature management trials into postarrest care[J]. N Engl J Med,2021,384(24):2344-2345. doi:10.1056/NEJMe2106969.
[16] TACCONE F S,PICETTI E,VINCENT J L. High quality targeted temperature management (TTM) after cardiac arrest[J]. Crit Care,2020,24(1):6. doi:10.1186/s13054-019-2721-1.
[17] WU C S,XU J F,JIN X H,et al. Effects of therapeutic hypothermia on cerebral tissue oxygen saturation in a swine model of post-cardiac arrest[J]. Experimental and therapeutic medicine,2020,19(2):1189-1196. doi:10.3892/etm.2019.8316.
[18] SANDRONI C,CRONBERG T,SEKHON M. Brain injury after cardiac arrest:pathophysiology,treatment,and prognosis[J]. Intensive Care Med,2021,47(12):1393-1414. doi:10.1007/s00134-021-06548-2.
[19] NGUYEN S M T,RUPPRECHT C P,HAQUE A,et al. Mechanisms governing anaphylaxis:inflammatory cells,mediators,endothelial gap junctions and beyond[J]. Int J Mol Sci,2021,22(15):7785. doi:10.3390/ijms22157785.
[20] BORTOLOTTI P,FAURE E,KIPNIS E. Inflammasomes in tissue damages and immune disorders after trauma[J]. Front Immunol,2018,9:1900. doi:10.3389/fimmu.2018.01900.
[21] MEZGER M,NORDING H,SAUTER R,et al. Platelets and immune responses during thromboinflammation[J]. Front Immunol,2019,10:1731. doi:10.3389/fimmu.2019.01731.
[22] KIM H J,PARK K N,KIM S H,et al. Time course of platelet counts in relation to the neurologic outcome in patients undergoing targeted temperature management after cardiac arrest[J]. Resuscitation,2019,140:113-119. doi:10.1016/j.resuscitation.2019.05.019.
[23] WANG W Y,XIE L,ZOU X S,et al. Pomelo peel oil suppresses TNF-α-induced necroptosis and cerebral ischaemia-reperfusion injury in a rat model of cardiac arrest[J]. Pharm Biol,2021,59(1):401-409. doi:10.1080/13880209.2021.1903046.
[24] WANG W Y,XIE L,ZOU X S,et al. Pomelo peel oil suppresses TNF-α-induced necroptosis and cerebral ischaemia-reperfusion injury in a rat model of cardiac arrest[J]. Pharm Biol,2021,59(1):401-409. doi:10.1080/13880209.2021.1903046.
[25] HASSAN M I,ALI F E,SHALKAMI A G S. Role of TLR-4/IL-6/TNF-α,COX-Ⅱ and eNOS/iNOS pathways in the impact of carvedilol against hepatic ischemia reperfusion injury[J]. Hum Exp Toxicol,2021,40(8):1362-1373. doi:10.1177/0960327121999442.
[26] 杨小红,张颖. 亚低温治疗对心脏骤停体外心肺复苏成功后患者血清TNF-α、IL-6水平的影响[J]. 现代医学与健康研究电子杂志,2020,4(1):82-83. YANG X H,ZHANG Y. Effect of mild hypothermia treatment on serum levels of TNF-α and IL-6 in patients with successful extracorporeal cardiopulmonary resuscitation after cardiac arrest[J]. Medicine and Health Research,2020,4(1):82-83. doi:2096-3718.2020.01.0082.02.
(2023-01-05收稿 2023-04-18修回)
(本文編辑 陈丽洁)
