硫化铼纳米颗粒在能谱CT成像及光热治疗中的应用研究
2023-11-08王笑一王欣宇张雪宁李敬
王笑一 王欣宇 张雪宁 李敬

摘要:目的 探讨硫化铼(ReS2)纳米颗粒的能谱CT成像性能及其在乳腺癌细胞中的光热治疗效果。方法 采用一锅法在室温下合成ReS2纳米颗粒;利用X射线光电子能谱、高分辨透射电镜、紫外吸收光谱对ReS2纳米颗粒进行材料学基本性质的表征。比较等效浓度的ReS2纳米颗粒和碘海醇在不同能量下(60~140 keV)的能谱CT成像能力。通过测定不同质量浓度的ReS2纳米颗粒水溶液(0、50、100、250和500 mg/L)在体外光热升温效果来评估纳米颗粒的光热转换能力。取小鼠乳腺癌细胞4T1与不同质量浓度的ReS2纳米颗粒水溶液(0、20、40、80和100 mg/L)共孵育,并通过MTT实验评估纳米颗粒的细胞毒性;通过细胞荧光染色法可视化观察分析ReS2纳米颗粒的光热细胞杀伤效果。结果 高分辨透射电镜观察到制备的纳米颗粒粒径<10 nm,紫外吸收光谱证实ReS2在808 nm处具有较强的吸收能力。当能量在60~140 keV时,等效浓度下ReS2纳米颗粒的CT成像效果明显优于碘海醇溶液。在功率密度为3 W/cm2的808 nm激光照射下,500 mg/L ReS2溶液的温度可提高44.90 °C±1.2 °C,而在相同條件下,纯水的温度仅提高了9.27 °C±0.74 °C。细胞学实验表明,在无激光照射的情况下,40~100 mg/L的ReS2纳米颗粒处理后,细胞存活率均>85%;在激光照射下,ReS2纳米颗粒浓度>40 mg/L时,生存率已<30%。结论 ReS2纳米颗粒制备简单,具有良好的生物相容性和光热治疗性能,且能谱CT成像效果显著,极具临床转化潜力。
关键词:造影剂;纳米粒子;CT成像;硫化铼;光热治疗
中图分类号:R817.12文献标志码:ADOI:10.11958/20230209
Study of rhenium sulfide nanoparticles in spectral CT imaging and photothermal therapy
WANG Xiaoyi WANG Xinyu ZHANG XueningLI Jing
1 Department of Ultrasound, the Second Hospital of Tianjin Medical University, Tianjin 300211, China; 2 Department of Radiology, Tianjin Key Laboratory of Functional Imaging, Tianjin Medical University General Hospital;
3 Department of Radiology, the Second Hospital of Tianjin Medical University
△Corresponding Author E-mail: luckyxn@126.com
Abstract: Objective To investigate the spectral CT imaging performance of Rhenium sulfide (ReS2) nanoparticles and their effect on photothermal therapy in breast cancer cells. Methods ReS2 nanoparticles were synthesized by one-pot method at room temperature. The basic materialistic properties of ReS2 nanoparticles were characterized by X-ray photoelectron spectroscopy, high-resolution transmission electron microscopy and UV absorption spectroscopy. The spectral CT imaging capability of ReS2 nanoparticles with the same molar concentration of iodine at different energies (60-140 keV) was compared. The photothermal conversion ability of nanoparticles was evaluated by measuring the in vitro photothermal warming of aqueous solutions of ReS2 nanoparticles with different mass concentrations (0、20、40、80 and 100 mg/L). Mouse breast cancer cells 4T1 were co-incubated with different mass concentrations of ReS2 nanoparticle aqueous solution (0, 20, 40, 80 and 100 mg/L). The cytotoxicity of nanoparticles was evaluated by MTT experiment and cell photothermal killing experiment. The photothermal cell killing effect of ReS2 nanoparticles was visually observed and analyzed by cytofluorescent staining. Results High-resolution transmission electron microscopy observed that the particle size of the prepared nanoparticles was less than 10 nm. The UV absorption spectrum confirmed the strong absorption of ReS2 at 808 nm. When the energy was in the range of 60-140 keV, the CT imaging effect of ReS2 nanoparticles at equivalent molar concentration was significantly better than that of iohexol solution. The temperature of 500 mg/L ReS2 solution could be increased by 44.90 °C ± 1.2 °C under 808 nm laser irradiation with a power density of 3 W/cm2, while the temperature of pure water was only increased by 9.27 °C ± 0.74 °C under the same conditions. Cellular experiments showed that in the absence of laser irradiation, the survival rate of 4T1 cells treated with ReS2 nanoparticles at concentrations of 40-100 mg/L were all greater than 85%. The cell survival rate was also reduced at ReS2 nanoparticle concentrations of 40-100 mg/L compared to the 0-40 mg/L case under laser irradiation, but the survival rate was already less than 30%. Conclusion ReS2 nanoparticles are simple to prepare, have good biocompatibility and photothermal therapeutic properties, and have strong killing effect on breast cancer cells under NIR laser irradiation, which have good clinical translation potential.
Key words: contrast media; nanoparticles; CT imaging; rhenium sulfide; photothermal therapy
利用碘基对比剂的CT增强成像已经有20余年的历史,且迄今为止在临床中仍未开发出可替代碘的新型CT对比剂[1-3]。然而,碘元素的低K-edge值(33.2 keV)导致了影像的信噪比不佳,这使得碘小分子和碘基成像对比剂不能满足能谱CT的成像需求[4]。近几年,研究人员将高原子序数的金属元素作为基质,合成了新型的CT敏感型纳米颗粒,并且成功应用于增强CT成像[5-6]。高原子序数使这些含金属的纳米颗粒在CT以及能谱CT成像中具有独特的优势,并在较高的能量下仍保持较强的X射线吸收能力。但这类纳米材料在临床应用中仍存在巨大的生物安全问题[7]。因此,亟需开发具有高X线吸收能力和良好的生物安全性的新型能谱CT对比剂。硫化铼(ReS2)纳米颗粒作为近年来新型的CT对比剂,因Re元素较高的原子序数(Z=75),故具有较强的X线吸收能力[8-9]。ReS2材料曾被用于与99Tcm配合进行前哨淋巴结检测以及放射性滑膜切除术的临床前研究,具有一定的生物安全性[10-12]。目前,ReS2纳米颗粒在能谱CT成像及光热治疗领域鲜有研究。本研究旨在评估ReS2纳米颗粒的能谱CT成像效果及光热性能并初步探讨其在乳腺癌细胞中的光热杀伤作用。
1 材料与方法
1.1 材料
所用试剂均至少属于分析级。高铼酸钠(NaReO4)购自美国Thermo Scientific公司。硫代硫酸钠(Na2S2O3·5H2O)、氢氧化钠(NaOH)、盐酸(HCl)、乙二醇(EG)、磷酸氢二钠(Na2HPO4)和磷酸二氢钠(NaH2PO4),噻唑蓝(MTT)均购于上海阿拉丁试剂有限公司。钙黄绿素乙酰氧基甲酯(Calcein-AM)碘化丙啶(PI)购自上海东仁化学科技有限公司。二甲基亚砜(DMSO)购自天津康科德科技有限公司。胰酶购于上海阿拉丁生化科技股份有限公司。DMEM培养基购于美国Gibco公司。小鼠乳腺癌4T1细胞购自ATCC细胞库。X射线光电子能谱仪(英国克雷斯托分析仪器公司,Axis Ultra DLD);高分辨率透射电子显微镜(荷兰飞利浦公司,Tecnai G2 F20);紫外-可见-近红外分光光度计(日本日立高新技术公司,UV-3600 plus);红外热值相机(美国菲力尔公司,E50);酶标仪(山东博科生物有限公司,BK-EL10C);808 nm近红外激光器(北京海特光电有限责任公司,LOS-BLD-808nm-15W-C/P);能谱CT成像系统(德国西门子医疗系统有限公司,SOMATOM Force)。
1.2 ReS2纳米颗粒的合成
采用一锅法在室温下合成ReS2纳米颗粒。首先,将22 mg的NaReO4和64 mg的Na2S2O3·5H2O混合到8 mL的EG中,然后加入250 ?L的HCl(6 mol/L)。搅拌40 min,当淡黄色溶液变为黑色时,用1 mol/L的NaOH溶液调节pH=7时终止反应,得到的ReS2纳米颗粒水溶液在截流量3.5 kDa的透析袋中透析以去除未反应的试剂。纯化后的ReS2纳米颗粒于4 ℃环境下保存并用于后续研究。
1.2.1 ReS2纳米颗粒的表征
(1)X射线光电子能谱(XPS)。将制备好的ReS2纳米颗粒经冻干处理后研磨并制样,然后上机测定其元素组成。(2)高分辨透射电镜观察。将制备好的ReS2纳米颗粒稀释并在铜网上制样并上机观察分布及粒径。(3)紫外-可见-近红外吸收光谱。将不同质量浓度的ReS2纳米颗粒(10、20、50、80、100、200、250和500 mg/L)放入紫外-可见-近红外光谱仪中,测定其在808 nm波长处的光密度(OD)值,并确定OD值与ReS2浓度的关系。
1.2.2 能谱CT成像效果分析
分别在1.5 mL离心管中加入ReS2纳米颗粒的水溶液和碘海醇稀释液(Re与I元素等浓度35 mmol/L),然后进行CT扫描。扫描参数:管电压90/Sn150 kV,自适应管电流,视野范围80 mm×80 mm。以高级建模迭代重建(ADMIRE)算法重建能谱CT影像(层厚0.5 mm,重建增量0.25 mm)。在60~140 keV的电子能量范围内,以10 keV的增量重建了虚拟的单能量影像。并通过syngo.via软件分析能谱CT影像和能谱CT的HU值。
1.2.3 光热性能评估
利用808 nm激光以3 W/cm2的功率密度辐照不同质量濃度(0、50、100、250和500 mg/L)的ReS2纳米颗粒的水溶液10 min,测量溶液温度。热值相机拍摄红外热值图像。
1.2.4 细胞毒性评估及光热杀伤效果评价
(1)MTT法评估ReS2纳米颗粒的细胞毒性。将4T1细胞接种在96孔板中(5×104个细胞/孔),并在含10%胎牛血清(FBS)、1%青霉素-链霉素和89%的DMEM中培养24 h。弃去原始培养基,加入0(对照)、20、40、80和100 mg/L的ReS2纳米颗粒与细胞共孵育24 h。ReS2处理后的4T1细胞分为无激光照射组和激光照射组。无激光照射组正常培养,激光照射组使用功率密度为3 W/cm2的808 nm激光器照射10 min。照射结束后弃去细胞上清液,PBS洗涤后添加10 μL的MTT溶液共孵育4 h,之后添加120 μL的DMSO以溶解紫色晶体,在酶标仪上测量溶液在490 nm波长处的OD值。最后通过公式计算细胞存活率,细胞存活率=OD处理组/OD对照组×100%。每组实验重复3次。
(2)细胞荧光染色法可视化评估光热的细胞杀伤效果。无激光照射组和激光照射组细胞参照上述分组处理后加入Calcein AM/PI试剂,在37 ℃避光孵育30 min。孵育结束后,在避光环境下用荧光显微镜下观察染色效果。
1.3 統计学方法
采用SPSS 25.0软件进行数据分析。符合正态分布的计量数据以x±s表示,多组间比较采用单因素方差分析,组间多重比较用Bonferroni法校正。P<0.05为差异有统计学意义。
2 结果
2.1 ReS2纳米颗粒的表征
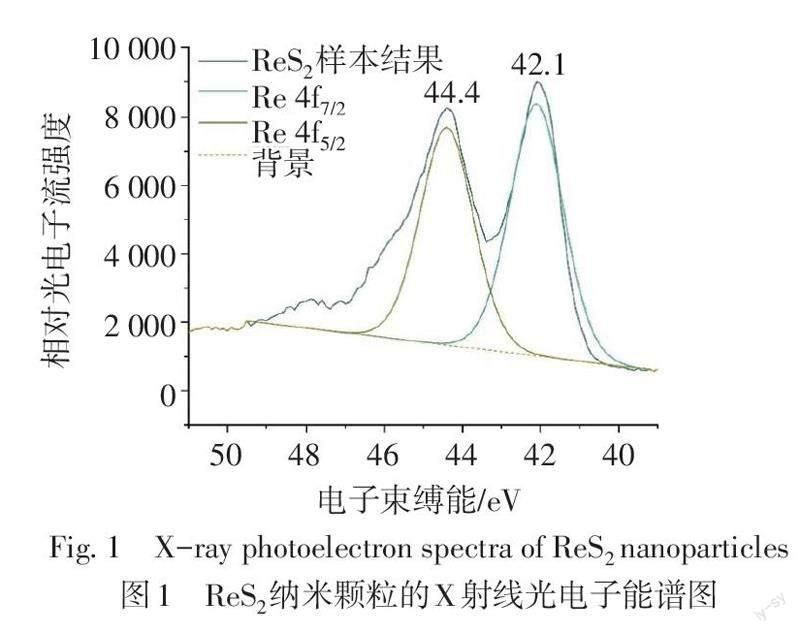
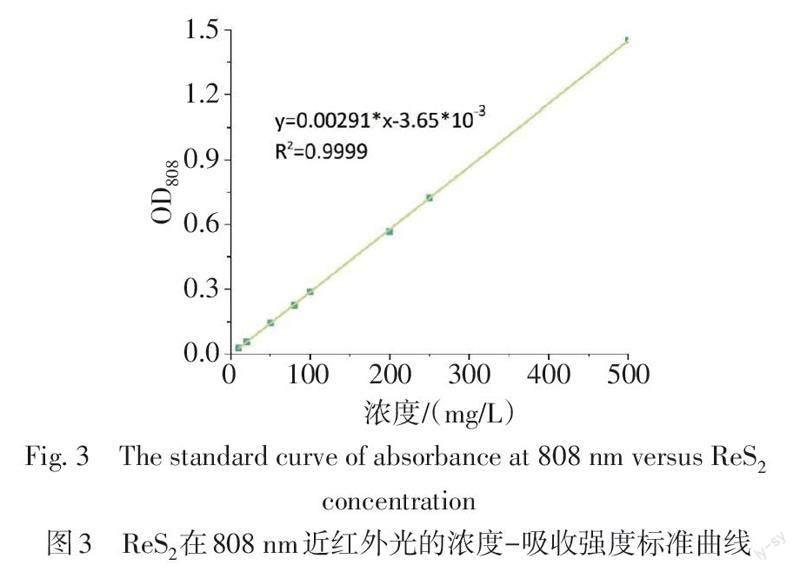
ReS2纳米颗粒外观呈黑色,常温常压下性质稳定,经过XPS表征,本实验合成的ReS2纳米颗粒的Re光谱在44.4 eV和42.1 eV处有2个明显的峰,这2个峰分别对应Re 4f5/2和Re 4f7/2状态,证明四价Re元素的形成,进一步说明ReS2纳米结构的成功合成(图1)。高分辨透射电镜下可见ReS2纳米颗粒粒径分布均匀,粒径均小于10 nm(图2)。紫外吸收光谱结果显示,ReS2纳米颗粒在808 nm处的吸光度与ReS2纳米颗粒浓度呈良好的线性关系,证实其具有较强且稳定的近红外吸收能力(图3)。
2.2 ReS2纳米颗粒的能谱CT成像效果
通过CT体外成像显示,当能量从60 keV增加到140 keV时,相较于碘海醇溶液的CT影像亮度随着能量的增加而急剧变暗,ReS2的CT影像亮度随着能量的增加其变暗幅度较小(图4)。等效浓度下ReS2纳米颗粒与碘海醇溶液之间的CT值差异越来越明显(图5)。
2.3 ReS2纳米颗粒的光热性能评估
在功率密度为3 W/cm2的808 nm激光照射下,500 mg/L的ReS2溶液的温度升高了44.90 ℃±1.2 ℃,而在相同条件下,纯水的温度提高了9.27 ℃±0.74 ℃,见图6。
2.4 ReS2纳米颗粒的细胞毒性和光热杀伤效果
无激光照射组ReS2纳米颗粒浓度≥40 mg/L时,4T1细胞存活率较0 mg/L下降,但细胞存活率均>85%。激光照射组ReS2纳米颗粒浓度>40 mg/L时,4T1细胞存活率亦较0 mg/L下降,但存活率已小于30%,见表1。细胞荧光染色结果亦显示,只有将ReS2纳米颗粒孵育和激光照射相结合才能造成破坏性的细胞消融,见图7。
3 讨论
近年来,研究人员通过对纳米材料的设计和合成将目前临床上诊断和治疗两个功能集成于一个纳米载体,能够实时、精确诊断病情并同步进行治疗,而且在治疗过程中能够监控疗效并随时调整给药方案,有利于达到最佳治疗效果,并减少不良反应[13-15]。在CT成像方面,相对于常用的碘对比剂,高原子序数对比剂能够在高能量下呈现稳定的成像效果,进而有着对病变进行更清晰的成像潜力[16]。
本研究通过一锅法制备ReS2纳米颗粒,方法简单,制备的ReS2纳米颗粒粒径较小且分布均匀,通过紫外吸收光谱证实其具有较强且稳定的近红外吸收能力。为了探究ReS2作为能谱CT成像对比剂的可行性,本研究将ReS2与等效摩尔浓度的碘海醇进行能谱CT成像效果的对比,结果表明,在60 keV的能量水平下,碘海醇的成像效果与ReS2相近,而随着能量的升高,碘海醇的成像效果远不如与相同元素摩尔浓度的ReS2,提示ReS2纳米颗粒在高能量下的CT成像能力优于等效摩尔浓度的碘海醇。细胞毒性结果显示,100 mg/L的ReS2浓度下4T1细胞仍有较高的细胞存活率(>85%),证实ReS2纳米颗粒有较低的细胞毒性和较好的生物安全性。基于ReS2良好的生物安全性,本研究进一步探究其光热治疗的应用前景。细胞实验结果表明,在单纯应用激光照射或单纯ReS2干预的情况下,4T1细胞的存活率仍然较高,均未达到明显的杀灭肿瘤细胞效果。当ReS2与用激光照射联合使用时,激光激发ReS2后产生的热量明显抑制了4T1细胞的存活,ReS2浓度达到80 mg/L时,绝大部分肿瘤细胞被有效抑制;ReS2浓度达到100 mg/L时,肿瘤细胞被有效杀伤,肉眼见不到任何细胞存活。上述结果证实ReS2溶液吸收近红外激光的能量后将光能转化为热能,升高的溶液温度杀死了4T1乳腺癌细胞,杀灭效果显著,效果持续时间较长,实现了基于ReS2的肿瘤细胞光热杀伤疗法。
综上所述,ReS2纳米颗粒制备方法简便,生物安全性较好,具有优秀的能谱CT成像效果和光热治疗潜力。这为肿瘤性病变的诊疗一体化提供了新的途径,具有临床转化及应用价值。
参考文献
[1] SHU Y,MA M,PAN X,et al. Cobalt protoporphyrin-induced nano-self-assembly for CT imaging,magnetic-guidance,and antioxidative protection of stem cells in pulmonary fibrosis treatment[J]. Bioact Mater,2023,21:129-141. doi:10.1016/j.bioactmat.2022.08.008.
[2] XU J W,CHENG X J,CHEN F X,et al. Fabrication of multifunctional polydopamine-coated gold nanobones for PA/CT imaging and enhanced synergistic chemo-photothermal therapy[J]. J Mater Sci Technol,2021,63:97-105. doi:10.1016/j.jmst.2020.04.060.
[3] YANG M,LIU Y,WANG M,et al. Biomineralized Gd/Dy composite nanoparticles for enhanced tumor photoablation with precise T-1/T-2-MR/CT/thermal imaging guidance[J]. Chem Eng J,2020,391:123562. doi:10.1016/j.cej.2019.123562.
[4] YEH B M,FITZGERALD P F,EDIC P M,et al. Opportunities for new CT contrast agents to maximize the diagnostic potential of emerging spectral CT technologies[J]. Adv Drug Deliv Rev,2017,113:201-222. doi:10.1016/j.addr.2016.09.001.
[5] LI Y,YOUNIS M H,WANG H,et al. Spectral computed tomography with inorganic nanomaterials: state-of-the-art[J]. Adv Drug Deliv Rev,2022,189:114524. doi:10.1016/j.addr.2022.114524.
[6] ZHANG C,ZHOU L,ZHANG J,et al. One-pot synthesis of flower-like Bi2S3 nanoparticles for spectral CT imaging and photothermal therapy in vivo[J]. New J Chem,2022,46(21),10458-10469. doi:10.1039/d2nj00426g.
[7] LI X,ZHANG Y,LIU G,et al. Recent progress in the applications of gold-based nanoparticles towards tumor-targeted imaging and therapy[J]. RSC Adv,2022,12(13):7635-7651. doi:10.1039/d2ra00566b.
[8] DE LA VEGA J C,ESQUINAS P L,GILL J K,et al. Comparison of rhenium and iodine as contrast agents in X-ray imaging[J]. Contrast Media Mol Imaging,2021,2021:1250360. doi:10.1155/2021/1250360.
[9] MIAO Z H,LV L X,LI K,et al. Liquid exfoliation of colloidal rhenium disulfide nanosheets as a multifunctional theranostic agent for in vivo photoacoustic/CT imaging and photothermal therapy[J]. Small,2018,14(14):e1703789. doi:10.1002/smll.201703789.
[10] HUANG Y J,DENG H P,ZHANG J T,et al. A photoelectrochemical immunosensor based on ReS2 nanosheets for determination of collagen III related to abdominal aortic aneurysm[J]. Microchem J,2021,168:106363. doi:10.1016/j.microc.2021.106363.
[11] LI Y P,LUO Z Y,SONG Y W,et al. Rhenium disulfide nanosheets as a promising probe for intracellular two-photon luminescence imaging[J]. Sensor Actuat B-Chem,2022,362:131781. doi:10.1016/j.snb.2022.131781.
[12] SHEN S D,CHAO Y,DONG Z L,et al. Bottom-up preparation of uniform ultrathin rhenium disulfide nanosheets for image-guided photothermal radiotherapy[J]. Adv Funct Mater,2017,27(28):1700250. doi:10.1002/adfm.201700250.
[13] SONG Y,YUAN Y,PENG X,et al. Promising colloidal rhenium disulfide nanosheets: preparation and applications for in vivo breast cancer therapy[J]. Nanomaterials (Basel),2022,12(11):1937. doi:10.3390/nano12111937.
[14] HAN H H,WANG H M,JANGILI P,et al. The design of small-molecule prodrugs and activatable phototherapeutics for cancer therapy[J]. Chem Soc Rev,2023,52(3):879-920. doi:10.1039/d2cs00673a.
[15] 赵妍,赵晶晶,康莉,等. 吲哚菁绿光热治疗耐甲氧西林葡萄球菌感染的研究[J]. 天津医药,2022,50(5):466-470. ZHAO Y,ZHAO J J,KANG L,et al. Experimental study of indocyanine green photothermal in the treatment of methicillin-resistant Staphylococcus Aureus infection[J]. Tianjin Med J,2022,50(5):466-470. doi:10.11958/20212254.
[16] HE H,ZHANG X,DU L,et al. Molecular imaging nanoprobes for theranostic applications[J]. Adv Drug Deliv Rev,2022,186:114320. doi:10.1016/j.addr.2022.114320.
(2023-02-21收稿 2023-03-28修回)
(本文編辑 胡小宁)
