下调细胞膜调控蛋白Paralemmin-3表达对肺泡巨噬细胞极化的调控作用▲
2023-11-07陈旭昕李虎明韩志海
陈旭昕 唐 璐 王 凡 刘 梦 李虎明 韩志海
(1 中国人民解放军总医院第六医学中心呼吸与危重症医学科, 北京市 100037; 2 北京泰康燕园康复医院老年内科, 北京市 102200)
肺泡巨噬细胞是“肺微环境”中数量最多的炎症细胞,其作为机体固有免疫系统的“第一道防线”,在诸多肺部疾病(如慢性阻塞性肺疾病、急性呼吸窘迫综合征等)中发挥着重要作用[1-2]。极化是决定巨噬细胞功能状态最重要的亚细胞事件,调控肺泡巨噬细胞的极化方向是治疗炎症失控性疾病的潜在方案[3-4]。细胞膜调控蛋白Paralemmin-3(PALM3)是Paralemmin蛋白家族成员之一,我们在前期研究中发现PALM3表达于巨噬细胞系NR8383细胞的细胞膜,调控PALM3表达可以影响巨噬细胞的炎症反应[5],但PALM3能否调控巨噬细胞的极化方向目前尚未见文献报告。因此,本研究拟在体外诱导NR8383细胞极化为M1型肺泡巨噬细胞和M2型肺泡巨噬细胞,比较不同极化状态下NR8383细胞中PALM3的表达差异,并利用小干扰RNA(small interfering RNA,siRNA)下调PALM3在NR8383细胞中的表达,观察下调PALM3表达对NR8383细胞极化方向的影响,以期为巨噬细胞极化失衡相关疾病的诊疗提供更多的实验室依据。
1 材料与方法
1.1 细胞株及主要试剂 大鼠肺泡巨噬细胞系NR8383细胞来源于美国典型培养物保藏中心。Control-siRNA、PALM3-siRNA、抗大鼠PALM3多克隆抗体购于Santa Cruz Biotechnology公司(批号分别为sc-37007、sc-97537、sc-248213),TRIzol裂解液(批号:12183555CN)、转染试剂LipofectamineTM2000和Opti-MEMTM减血清培养基购于Invitrogen 公司(批号分别为11668019、31985062),脂多糖(E.coil 0111:B4)购于Sigma-Aldrich Lab &Production Materials公司(批号:297-473-0),Ham′s F12培养基和胎牛血清购自Gibco公司(批号分别为21127022、10100-147-FBS),大鼠肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-10 ELISA试剂盒购自R&D Systems公司(批号分别为RTA00、R1000),4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)、细胞总蛋白提取试剂盒、Cy3标记的相应二抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记的相应二抗、增强型ECL发光试剂盒购自上海碧云天生物技术有限公司(批号分别为C1002、P0013、A0502、A0181、P0018S),反转录试剂(TaKaRa PrimeScript RT Reagent Kit)及实时荧光定量PCR试剂(SYBR Green qPCR Master Mix-SYBR Advantage)购自宝生物工程(大连)有限公司(批号分别为RR037A、639676)。
1.2 实验方法
1.2.1 细胞培养:在37.0 ℃、5% CO2、95%湿度条件下,将NR8383细胞培养于含10%胎牛血清的Ham′s F12培养基,每隔1 d换液1次,2~3 d传代1次。取处于对数生长期的细胞用于实验。
1.2.2 免疫荧光法检测NR8383细胞中PALM3的表达:将对数生长期NR8383细胞按3×106个/孔的密度接种至铺有载玻片的6孔板中,按照前述细胞培养方案培养细胞。待细胞融合为70%时吸取培养基终止培养,加入含4%多聚甲醛的PBS室温固定20 min。用含100 mmol/L甘氨酸的PBS清洗后,加入含0.3% Triton X-100的PBS处理细胞20 min。用PBST润洗细胞3次,滴加牛血清白蛋白封闭液后于室温下封闭30 min。加入稀释后(1 ∶100)的抗大鼠PALM3多克隆抗体,4 ℃孵育过夜。用PBS充分洗脱后再在载玻片上滴加Cy3标记的二抗,避光孵育2 h,DAPI 染核。用PBST润洗3 次,滴加防荧光猝灭剂后,盖上盖玻片并封片,在荧光显微镜(Leica公司,型号:DM2500)下观察并拍照。
1.2.3 细胞分组与处理:(1)按照1.2.2的方法将NR8383细胞接种至24孔板中,待细胞融合为70%时,分别给予100 ng/mL脂多糖、20 ng/mL IL-4刺激12 h[6],然后更换含10%胎牛血清的Ham′s F12培养基继续培养24 h,经脂多糖、IL-4刺激的NR8383细胞分别被认定为M1型、M2型肺泡巨噬细胞。将未经干预的正常NR8383细胞作为M0型肺泡巨噬细胞。提取M0型、M1型和M2型肺泡巨噬细胞的总RNA和总蛋白,用实时荧光定量PCR、Western blot分别检测PALM3的mRNA、蛋白相对表达水平,每组设置3个复孔,实验重复3次。(2)按照1.2.2的方法将NR8383细胞接种至24孔板中,待融合度达70%时用于质粒转染。将NR8383细胞分为Control-siRNA组、PALM3-siRNA组和正常对照组进行实验。按照说明书中的操作步骤,用50 μL Opti-MEMTM减血清培养基分别稀释20 pmoL Control-siRNA、20 pmoL PALM3-siRNA及1μL LipofectamineTM2000,再将siRNA和LipofectamineTM2000均匀混合,共同孵育20 min。然后将含Control-siRNA、PALM3-siRNA的混合液分别加入Control-siRNA组、PALM3-siRNA组的NR8383细胞,在37 ℃、5% CO2、95%湿度条件下孵育6 h后,更换为含10%胎牛血清的Ham′s F12培养基继续培养48 h。正常对照组NR8383细胞除常规换液外,不给予其他额外操作。取3组部分NR8383细胞,用实时荧光定量PCR、Western blot分别检测PALM3的mRNA、蛋白相对表达水平;取3组剩余细胞,分别给予100 ng/mL脂多糖或20 ng/mL IL-4刺激12 h后,收集上清液和NR8383细胞,采用ELISA检测上清液中TNF-α及IL-10含量,采用实时荧光定量PCR检测NR8383细胞中CD80、诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)、CD206、精氨酸酶1(arginase 1,ARG1)的mRNA相对表达水平。每组设置3个复孔,实验重复3次。
1.2.4 实时荧光定量PCR检测PALM3、CD86/iNOS、CD206/ARG1 mRNA相对表达水平:收集经过上述分组处理的NR8383细胞,使用PBS充分冲洗细胞后,加入TRIzol裂解液提取总RNA,然后根据反转录试剂说明书制备cDNA。参照实时荧光定量PCR 试剂说明书进行检测,所使用的仪器为QIAGEN公司Rotor Gene 3000型实时荧光定量PCR仪。PCR反应体系为cDNA 2 μL、330 ng/μL的上下游引物各0.5 μL、2×SYBR Green 反应液10 μL,加ddH2O至20 μL。反应条件:94 ℃ 3 min;94 ℃ 10 s,55 ℃ 20 s,72 ℃ 20 s,共40个循环;溶解曲线温度为65 ℃~95 ℃,每5 s增加0.5 ℃,读板。以GAPDH为内参。引物由宝生物工程(大连)有限公司设计及合成,引物序列见表1。

表1 引物序列
1.2.5 Western blot检测PALM3蛋白相对表达水平:收集经过上述分组处理的NR8383细胞,利用细胞总蛋白提取试剂盒提取各组NR8383细胞总蛋白,采用Bradford法测定总蛋白浓度,取等量总蛋白行SDS-PAGE,经半干电转至PVDF膜上,将PVDF膜放入封闭袋中,然后在封闭袋中加入由TBST配制的5%脱脂奶粉封闭液,37 ℃放置2 h后,加入稀释后(1 ∶500)的抗大鼠PALM3多克隆抗体10 μL,4 ℃放置过夜。次日将膜取出,用TBST洗膜3次(10 min/次)后,再放入另一个洁净的封闭袋中,加入相对应的5%脱脂奶粉稀释的HRP标记二抗(1 ∶2 500)10 μL,37 ℃放置2 h。用增强型ECL发光试剂盒显影、曝光后,使用AlphaImager 2200型成像系统(Alpha Innotech公司)扫描,用ImageJ图像分析软件进行灰度值分析。
1.2.6 ELISA检测上清液TNF-α及IL-10含量:收集经过上述分组处理的细胞培养上清液,采用ELISA检测TNF-α及IL-10含量,参照说明书进行操作。每个样本设置3个复孔,实验重复3次。
1.3 统计学分析 应用SPSS 16.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,多重比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 NR8383细胞中PALM3的表达情况 免疫荧光检测结果提示,PALM3在NR8383细胞中有表达,且主要分布于NR8383细胞的细胞膜上,见图1。

图1 NR8383细胞中PALM3的免疫荧光检测结果(×200)
2.2 3种肺泡巨噬细胞中的PALM3 mRNA和蛋白相对表达水平的比较 M1型肺泡巨噬细胞、M0型肺泡巨噬细胞、M2型肺泡巨噬细胞中PALM3的mRNA和蛋白相对表达水平依次降低(P<0.05),见表2和图2。

图2 PALM3 蛋白在M0型、M1型及M2型肺泡巨噬细胞中的表达情况
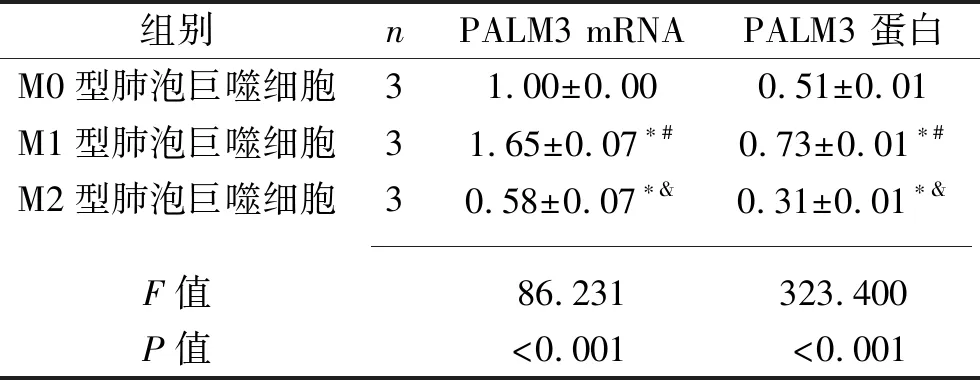
表2 3种NR8383肺泡巨噬细胞中PALM3 mRNA和蛋白相对表达水平的比较(x±s)
2.3 下调PALM3表达对NR8383细胞中PALM3 mRNA和蛋白表达水平的影响 PALM3-siRNA组NR8383细胞中PALM3 mRNA和蛋白相对表达水平低于正常对照组及Control-siRNA组(P<0.05),而正常对照组及Control-siRNA组上述指标的差异无统计学意义(P>0.05),提示转染成功,见表3和图3。

图3 3组NR8383细胞中的PALM3 蛋白表达情况

表3 3组NR8383细胞中PALM3的mRNA和蛋白相对表达水平比较(x±s)
2.4 下调PALM3表达对NR8383细胞极化为M1型肺泡巨噬细胞及分泌促炎因子的影响 经转染siRNA及脂多糖刺激后,与正常对照组及Control-siRNA组相比,PALM3-siRNA组NR8383细胞M1型表面标志物CD86和iNOS的mRNA相对表达水平下调,上清液TNF-α含量降低 (P<0.05),见表4。

表4 3组NR8383细胞中CD86和iNOS mRNA相对表达水平及上清液TNF-α含量的比较(x±s)
2.5 下调PALM3表达对NR8383细胞极化为M2型肺泡巨噬细胞及抗炎因子的影响 经转染siRNA及IL-4刺激后,与正常对照组及Control-siRNA组相比,PALM3-siRNA组NR8383细胞M2型表面标志物CD206和ARG1 mRNA相对表达水平上调,上清液IL-10含量升高(P<0.05),见表5。

表5 3组NR8383细胞中CD206和ARG1 mRNA相对表达水平及上清液IL-10含量的比较(x±s)
3 讨 论
成熟的巨噬细胞在各种因素下出现表型及形态变化,即巨噬细胞的极化现象,不同极化状态的巨噬细胞在维持免疫稳态及宿主防御中起着不同的作用[7]。肺泡巨噬细胞具有较强的可塑性和功能异质性,容易受到表观遗传学和免疫代谢微环境等因素的影响而分化为具有不同功能表型的巨噬细胞[8-9]。M1/M2二分法是巨噬细胞极化经典的分型方式,M1型巨噬细胞具有强大的促炎及抗原提呈能力,对病原体及肿瘤发挥宿主免疫清除功能[10];M2型巨噬细胞具有抗炎、促进伤口愈合和纤维化、修复组织、促进肿瘤生长和浸润的作用[11-12]。M1型巨噬细胞过度浸润时可分泌大量一氧化氮、活性氧簇、IL及TNF-α等因子从而引起强烈的炎症反应,同时其可分泌基质金属蛋白酶(matrix metalloproteinase,MMP)2、MMP9等因子从而降解细胞外基质,引发更多炎症细胞浸润到损伤组织周围而加重炎症反应[13]。促进M1型巨噬细胞向M2型巨噬细胞转变,增加损伤组织中M2型巨噬细胞的数量可缓解炎症反应从而改善疾病的预后[14]。因此,调控巨噬细胞的极化方向是治疗炎症失控性疾病的潜在方案。
巨噬细胞极化是多种因子相互作用的过程,受胞内多种信号分子及其通路的调控[15]。PALM3属于Paralemmin蛋白家族,于1992年首次在非洲爪蛙中发现,也被称为Xlgv7/Xlcaax-1[16]。本研究结果显示,PALM3在肺泡巨噬细胞系NR8383细胞中有表达,主要定位于细胞膜上,且其在不同极化状态的肺泡巨噬细胞中的表达存在差异,在M1型肺泡巨噬细胞中呈现高表达,而在M2型肺泡巨噬细胞中呈现低表达,提示PALM3的表达丰度与肺泡巨噬细胞极化状态有关,PALM3可能成为M1型肺泡巨噬细胞的新型特征性标志物,有助于巨噬细胞亚群的分析和鉴定。但鉴于巨噬细胞的高度异质性,PALM3分子是否能影响M1/M2型以外的其他巨噬细胞亚群,仍有待进一步研究。
本研究进一步下调PALM3表达,观察其对肺泡巨噬细胞极化方向及分泌炎症因子的影响,结果显示,经转染siRNA及脂多糖刺激后,与正常对照组及Control-siRNA组相比,PALM3-siRNA组NR8383细胞M1型表面标志物表达水平下调,上清液TNF-α含量降低,这提示PALM3是促进肺泡巨噬细胞发生M1型极化的重要分子。此外,经转染siRNA及IL-4刺激后,与正常对照组及Control-siRNA组相比,PALM3-siRNA组NR8383细胞的M2型表面标志物表达水平上调,上清液IL-10含量升高(P<0.05)。上述结果提示下调PALM3表达可促进肺泡巨噬细胞向M2型极化,有助于抑制促炎因子、促进抗炎因子的释放。此外,研究表明,PALM3可能与膜蛋白的靶向运输有关,可能作为“接头分子”参与信号转导[17]。而我们在前期的研究中发现,PALM3可作为“接头分子”参与Toll样受体信号通路的转导[16],但PALM3是否能通过Toll样受体信号通路调控肺泡巨噬细胞的极化方向,尚需深入探究。
综上所述,PALM3定位表达于肺泡巨噬细胞的细胞膜,其表达丰度与NR8383的极化状态有关,在M1型肺泡巨噬细胞中呈高表达;下调PALM3表达可抑制脂多糖诱导的M1型肺泡巨噬细胞极化,同时可促进IL-4诱导的M2型肺泡巨噬细胞极化,有助于抑制促炎因子、促进抗炎因子的释放。调控PALM3的表达有望成为治疗巨噬细胞相关炎性疾病的新型靶点。
