基于广泛靶向代谢组学的血橙枯水时柠檬酸降解途径研究
2023-11-06张皓月杨相政曾凯芳姚世响
张皓月, 侯 娇, 杨相政, 李 健, 曾凯芳, 姚世响,*
(1.西南大学 食品科学学院/国家柑桔工程技术研究中心/川渝共建特色食品重庆市重点实验室, 重庆 400715;2.中华全国供销合作总社 济南果品研究所, 山东 济南 250204;3.北京工商大学 北京市食品添加剂工程技术研究中心, 北京 100048)
枯水是柑橘果实常见的生理性病害,主要发生于采前成熟阶段或采后贮藏阶段[1]。大部分柑橘栽培品种均有枯水发生的报道,如三红蜜柚和琯溪蜜柚等柚类[2-3]、丰脐和伦晚脐橙等甜橙类[4-5]、椪柑和沙糖桔等宽皮柑橘类[6-7]、尤力克(Eureka)和里斯本(Lisbon)等柠檬类[8]、黄果柑和大雅柑等杂柑类[9-10],以及胡柚和葡萄柚等[1,11]。柑橘枯水后,果实糖酸风味寡淡,严重时丧失食用品质和商品价值。柑橘果实枯水时,汁胞呈高度异质化状态,粒化和萎缩是主要的2种类型[1]。汁胞枯水类型与柑橘品种有一定关系,比如柚类通常以粒化为主,宽皮柑橘和甜橙则粒化和萎缩均比较常见[1]。粒化汁胞呈膨大硬化表型,萎缩汁胞呈萎缩塌陷表型,2种汁胞具有相似的糖酸风味寡淡表型。
相关学者在揭示汁胞枯水时糖酸快速消耗机制方面做了大量工作。张百超等[12]提出“果皮过度衰老诱导枯水”假说,果皮过度衰老导致汁胞糖酸急剧消耗和枯水。陈昆松等[13]提出“果皮相对再生长诱导枯水”假说,果皮相对再生长诱发汁胞糖酸耗竭和枯水。这2种假说均有一定的生理数据支撑,同时这2种假说相互存在矛盾,这反映了柑橘枯水这一生理性病害高度复杂的特点。Huang等[1,4,6,14-15]基于汁胞的大量生理证据提出“细胞壁代谢紊乱诱导枯水”假说,果胶代谢紊乱和细胞壁物质大量合成诱导汁胞糖酸物质耗竭和枯水,该假说为柑橘枯水的分子机制研究提供了概念性基础[1,11,16]。此外,汁胞枯水时有机酸(主要组分为柠檬酸)的急剧消耗更为显著,其降解途径也开始被阐明[3]。其中,柑橘果实成熟时柠檬酸降解有2条主要途径——乙酰辅酶A合成途径和GABA支路,第1条途径在枯水时被显著激活[3]。目前枯水进程中糖酸消耗机制的研究主要是在粒化型汁胞中进行的,对萎缩型汁胞关注较少。
塔罗科血橙(Citrussinensiscv. Tarocco)在我国主要栽培于三峡库区(万州等地),是晚熟柑橘的重要品种,在1月底至2月中旬成熟,通过留树保鲜技术延长至3~5月上市,在冬季极端低温的年份易发生采前枯水[17]。本团队前期研究发现,塔罗科血橙枯水时汁胞呈萎缩状态,是典型的萎缩型枯水。近期研究揭示血橙汁胞萎缩型枯水进程中,果胶代谢紊乱和木质素合成途径激活是柑橘枯水的主要诱因,为本研究分析汁胞柠檬酸消耗机制奠定了基础[14-15]。本研究以塔罗科血橙为实验材料,采用广泛靶向代谢组学技术系统分析汁胞枯水时初生代谢物质的变化,进一步综合运用生理、生物信息学和基因分析技术对枯水时柠檬酸消耗的机制进行解析。
1 材料与方法
1.1 材料与试剂
塔罗科血橙(C.sinensiscv. Tarocco)果实采于2021年4月中旬重庆三峡库区的柑橘果园,当天运回位于重庆市西南大学的实验室,选择成熟度和大小一致的果实(约200个)用于实验,正常汁胞和枯水汁胞分别取自正常和枯水血橙果实,用液氮速冻后,-80℃储存备用。
次氯酸钠,分析纯,成都市科隆化学品有限公司;甲醇、乙腈,色谱纯,美国Merck公司;磺基水杨酸,分析纯,北京索莱宝生物科技公司;PBS溶液(磷酸盐缓冲液),分析纯,重庆跃翔化工有限公司。
BC0915谷氨酰胺合酶(glutamine synthetase,GLN)活性检测试剂盒,北京索莱宝生物科技公司;BS-E18788O2植物谷氨酰胺脱羧酶(glutamine decarboxylase,GAD)ELISA试剂盒,江苏博深生物科技有限公司。
1.2 仪器与设备
Scientz-100F型冻干机,宁波新芝生物科技股份有限公司;MM400型研磨仪,德国Retsch公司;TGL-18MS型冷冻离心机,上海卢湘仪离心机仪器有限公司;Nexera X2型系列超高效液相色谱仪,日本岛津公司;SB-C18液相色谱柱,美国Agilent公司;4500 QTRAP型串联质谱仪,美国Applied Biosystems公司;L-8900型全自动氨基酸分析仪,日本日立公司;SYNERGY H1型多功能酶标仪,美国伯腾仪器有限公司。
1.3 实验方法
1.3.1代谢组学样本制备及超高效液相色谱串联质谱分析
参考Zhu等[18]的方法进行代谢组学样品制备及超高效液相色谱串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)分析。将汁胞样本用冻干机冷冻干燥,使用研磨仪充分研磨(30 Hz,1.5 min)成粉末;称取100 mg粉末,溶解于体积分数70%甲醇提取液中,振荡30 s,每30 min振荡1次,共振荡6次,样品置于4 ℃过夜提取。12 000 r/min离心10 min后,用直径0.22 μm的微孔滤膜过滤上清液,然后存于进样瓶中。正常汁胞样本记为N组,枯水汁胞样本记为VC组,质控样本记为mix组,3组样本均设置3个生物学重复,用于UPLC-MS/MS分析。
液相条件:样品进样量为4 μL,流速为0.35 mL/min,每个样品分析时间约为15 min。液相色谱柱2.1 mm×100 mm×1.8 μm,柱温40 ℃;流动相A相为水(含体积分数0.1%甲酸),B相为乙腈(含体积分数0.1%甲酸);洗脱梯度为0 min时B相体积比例为5%,在9 min内B相体积比例线性增加至95%,并在95%维持1 min,然后在1.1 min内B相比例降至5%,并在5%维持3 min。
质谱条件:电喷雾离子源温度为550 ℃;离子喷雾电压分别为5 500 V(正离子模式)和4 500 V(负离子模式);离子源气体Ⅰ压力为344.75 kPa、离子源气体Ⅱ压力为413.69 kPa、气帘气(curtain gas)压力为172.37 kPa;碰撞诱导电离参数设置为高;三重四极杆(triple quadrupole)扫描使用多重反应监测(multiple reaction monitoring,MRM)模式。
1.3.2代谢物质定性与定量分析
将二级质谱信息与MWDB数据库信息比对鉴定代谢物质;用MRM模式进行代谢物质定量分析。使用软件Analyst 1.6.3处理获得的样本质谱分析数据,对物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱峰进行积分校正。代谢组数据使用MetaX进行正交偏最小二乘判别分析(partial least squares-discriminant analysis),VIP(variable important in projection)≥1、fold change ≥2(或≤0.5)和P<0.05作为代谢物质含量具有显著性差异的判断标准。
1.3.3氨基酸定量分析
氨基酸定量分析参考Wang等[3]的方法并略有修改。称取0.5 g汁胞粉末,加入1.5 mL体积分数为6%磺基水杨酸,40 kHz超声提取30 min;4 ℃,12 000 r/min离心15 min,收集上清液后用微孔滤膜(孔径0.22 μm)过滤,用全自动氨基酸分析仪测定氨基酸含量(ng·g-1),设置4个生物学重复。
1.3.4柠檬酸降解相关酶活性测定
GLN和GAD活性分别用相应活性检测试剂盒测定。粗酶液分别在540 nm和450 nm处测定吸光度,酶活表示为U/mg,GLN活性设置3个生物学重复,GAD活性设置4个生物学重复。
1.3.5脂代谢相关基因的生物信息学分析
基因的生物信息学鉴定参考Wang等[3]的方法。从TAIR11数据库(Arabidopsis Information Resource)下载拟南芥脂代谢基因家族序列,用本地Blast软件比对甜橙基因组(C.sinensisV1)数据库,得到的基因序列用Pfam分析验证蛋白质是否存在保守结构域,最终鉴定甜橙的相关基因家族成员。
将甜橙脂代谢基因家族序列用TBtools软件分析其基因家族成员的染色体定位,并根据定位及拟南芥同源基因名称命名基因。用Expasy工具分析基因编码蛋白的长度、分子质量和等电点等理化特性。用基因结构显示工具(gene structure display server,GSDS)分析基因的外显子和内含子结构信息,用Pfam软件鉴定及显示蛋白质结构域。
1.3.6基因转录水平分析
基因表达分析参考Wang等[3]的方法。提取血橙汁胞总RNA后构建cDNA文库,用Illumina Hiseq平台测序。用TopHat v2.0.12软件将测序数据比对甜橙基因组(C.sinensis),用FPKM(fragments per kilobase per million mapped reads)表示基因表达水平。差异基因用DESeq2 R package软件分析(P<0.05),设置4个生物学重复。
1.4 数据处理
除代谢物质和基因表达数据,其他实验数据均用Graphpad Prism 9.0(美国GraphPad Software公司)进行统计分析,用t检验(P<0.05)判别显著性差异。用Adobe Illustrator 2021软件(美国Adobe公司)绘图。
2 结果与分析
2.1 气温与血橙枯水相关性的观察
柑橘采前成熟阶段的气温是影响果实品质的重要因素。以三峡库区主要城市万州为例,三峡库区血橙采前阶段的气温变化和果实枯水表型见图1。低温天气在12月至次年2月出现,部分年份甚至会低于0 ℃[图1(a)]。在2020年冬季,万州血橙果园出现一段时间-8~0 ℃的寒潮,次年果实出现大面积枯水现象。本研究对枯水果实进行深入观察后发现,枯水汁胞呈萎缩塌陷表型,为典型的汁胞萎缩型枯水[图1(b)]。

图1 三峡库区血橙采前阶段的气温变化和果实枯水表型Fig.1 Temperature variation of blood orange preharvest in Three Gorges Reservoir area and phenotype of fruit affected by segment drying
2.2 血橙枯水时汁胞的广泛靶向代谢组学分析结果
2.2.1样本主成分分析及代谢物质鉴定结果
为了判断组间样本总体差异和组内样本变异度,对代谢组学数据进行主成分分析(principal component analysis,PCA),见图2。第一主成分PC1和第二主成分PC2的解释率分别为62.73%和9.53%,提示正常和枯水血橙组样本存在明显差异[图2(a)]。组内样本的皮尔逊相关系数均大于0.95,提示重复样本间相关性强,变异小[图2(b)]。 这些数据表明代谢组学的数据可信度高,可用于后续分析。
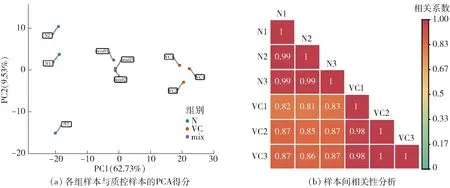
N表示正常汁胞样本,VC表示枯水汁胞样本,mix表示质控样本。图2 血橙正常和枯水样本的主成分分析Fig.2 Principal component analysis of normal and segment drying samples of blood orange
广泛靶向代谢组学从血橙汁胞中共鉴定到480种初生代谢物。这些代谢物质可分为11类,包括110种氨基酸及其衍生物、93种有机酸、76种糖及醇类、60种游离脂肪酸、55种核苷酸及其衍生物、29种溶血磷脂酰胆碱、21种维生素、23种溶血磷脂酰乙醇胺、9种甘油酯、3种鞘脂及1种磷脂酰胆碱。
2.2.2代谢物质的定量分析结果
代谢物质的定量分析结果见图3。广泛靶向代谢组学共鉴定了193种代谢物质在血橙枯水时差异积累[图3(a)]。其中,165种上调,28种下调。差异代谢物质的聚类结果显示,脂类和氨基酸等多类物质含量在枯水时上调[图3(b)]。将差异代谢物质与KEGG(kyoto encyclopedia of genes and genomes)数据库比对,用KOBAS (KEGG orthology based annotation system)分析差异代谢途径。结果发现,亚油酸代谢通路是唯一的显著富集通路(P<0.05)[图3(c)]。进一步对亚油酸代谢相关脂类物质的组成及枯水时的含量变化特征进行分析,66种脂类代谢物质在枯水时都显著富集,包括39种游离脂肪酸、11种溶血磷脂酰胆碱、9种溶血磷脂酰乙醇胺、6种甘油酯和1种鞘脂。这些结果表明,亚油酸代谢可能是血橙枯水时汁胞代谢物质变化的主要特征。亚油酸合成是柑橘果实柠檬酸降解关键途径——乙酰辅酶A合成途径的主要部分,说明该途径是血橙果实枯水时柠檬酸降解的主要途径。
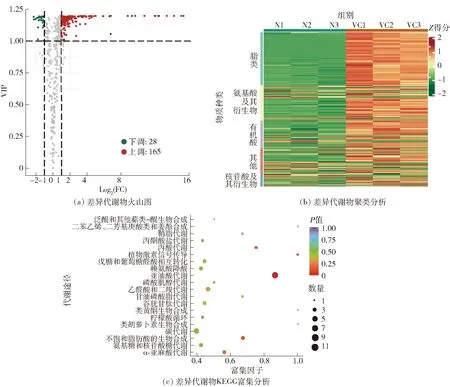
Z得分表示差异代谢物相对含量归一化处理后的数值,反映含量的高低(红色为高含量,绿色为低含量)。N表示正常汁胞样本,VC表示枯水汁胞样本。图3 血橙汁胞枯水时的差异代谢物分析Fig.3 Differential metabolite analysis in juice vesicles of blood orange during segment drying
2.2.3柠檬酸降解途径相关代谢物质的含量变化
为系统了解血橙枯水时柠檬酸的消耗机制,本研究对代谢组学揭示的柠檬酸降解相关代谢物质进行了深入挖掘。血橙汁胞枯水时柠檬酸降解途径相关代谢物质的变化见图4。血橙枯水时,柠檬酸含量下降了53.1%(P<0.05)[图4(a)]。乙酰辅酶A合成途径是通过将柠檬酸裂解生成乙酰辅酶A,再参与合成亚油酸、氨基酸及次生代谢物质。枯水时,亚油酸及脂类物质含量显著上调(P<0.05)[图4(b)],丝氨酸含量显著上调(P<0.05)[图4(c)]。结果证实乙酰辅酶A合成途径是血橙枯水时降酸的主要途径。
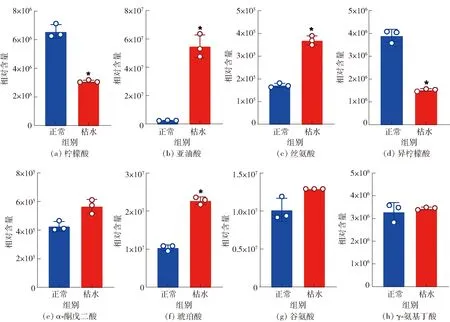
*表示组间数据差异显著(P<0.05)。图4 血橙汁胞枯水时柠檬酸降解途径相关代谢物质变化Fig.4 Changes of metabolites relating to citric acid degradation in juice vesicles of blood orange during segment drying
异柠檬酸、α-酮戊二酸和琥珀酸等三羟酸(TCA)循环的中间代谢物质在枯水时呈现出不一致的变化特征。其中,异柠檬酸含量下降了61%(P<0.05)[图4(d)],α-酮戊二酸含量没有显著变化(P>0.05)[图4(e)],琥珀酸含量则增加了120%(P<0.05)[图4(f)]。这些结果表明,TCA循环在血橙枯水时发生了变化,但其活性不是简单的增加关系。α-酮戊二酸一方面可通过生成谷氨酸,进一步合成谷氨酰胺从而进入氮循环;另一方面也可通过生成γ-氨基丁酸(GABA),进入GABA支路。血橙枯水时,谷氨酸和GABA含量没有显著变化(P>0.05)[图4(g)至图4(h)],说明GABA支路没有被激活。
2.3 血橙枯水时氨基酸的变化
为全面了解氨基酸组分在枯水时的变化,判断柠檬酸的降解途径,本研究分析了16种常见氨基酸枯水时的变化,见图5。其中,15种氨基酸(异亮氨酸、蛋氨酸、亮氨酸、半胱氨酸、甘氨酸、酪氨酸、缬氨酸、苯丙氨酸、组氨酸、丙氨酸、赖氨酸、苏氨酸、丝氨酸、谷氨酸、天冬氨酸)在血橙枯水时含量显著增加(P<0.05)。血橙枯水时,含量最高的前5种氨基酸分别是精氨酸、天冬氨酸、谷氨酸、丝氨酸和苏氨酸,除精氨酸没有显著(P>0.05)变化外,其余4种氨基酸在枯水时分别增加了101.3%、66.2%、229.7%和634.3%。天冬氨酸可以通过催化生成草酰乙酸进一步合成柠檬酸,枯水时天冬氨酸含量的升高提示氨基酸裂解合成柠檬酸途径的活性受抑制。乙酰辅酶A合成途径可以将柠檬酸降解为乙酰辅酶A和草酰乙酸,乙酰辅酶A进一步生成赖氨酸,同时草酰乙酸可以催化合成甘氨酸、苏氨酸和丝氨酸,这些氨基酸的含量在枯水时均显著增加,由此进一步证实乙酰辅酶A合成途径在血橙枯水时被显著激活,是汁胞柠檬酸降解的主要途径。
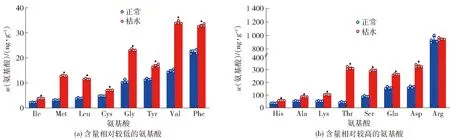
Ile:异亮氨酸;Met:蛋氨酸;Leu:亮氨酸;Cys:半胱氨酸;Gly:甘氨酸;Tyr:酪氨酸;Val:缬氨酸;Phe:苯丙氨酸;His:组氨酸;Ala:丙氨酸;Lys:赖氨酸;Thr:苏氨酸;Ser:丝氨酸;Glu:谷氨酸;Asp:天冬氨酸;Arg:精氨酸。*表示正常和枯水汁胞的游离氨基酸含量具有显著性差异(P<0.05)。图5 血橙汁胞枯水时氨基酸质量比Fig.5 Amino acid mass ratio in juice vesicles of blood orange during segment drying
2.4 血橙枯水时柠檬酸降解关键酶活性变化
为探讨血橙枯水时柠檬酸降解途径是否在酶活水平受调控,本研究分析了柠檬酸降解的2个关键酶(谷氨酰胺合酶GLN和谷氨酰胺脱羧酶GAD)活性,见图6。其中,GLN催化谷氨酸生成谷氨酰胺,其活性在枯水时增加了75.3%(P<0.05)[图6(a)]。表明谷氨酰胺合成途径在酶活性水平被激活。GAD催化谷氨酸脱羧生成GABA,其活性在枯水时没有显著变化(P>0.05)[图6(b)],说明GABA支路的酶活水平在枯水时没有激活,与代谢物质变化规律一致。
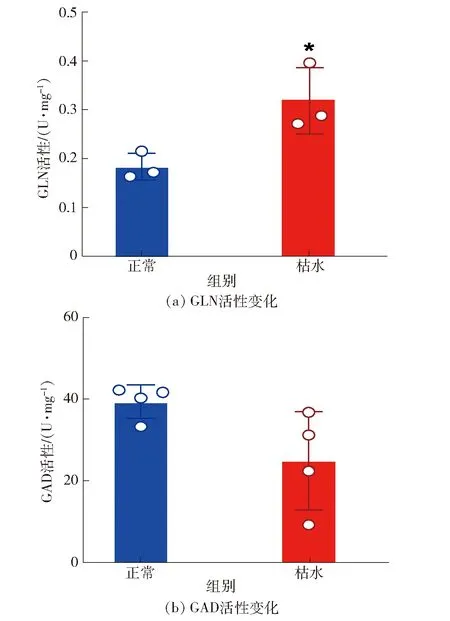
*表示正常和枯水汁胞酶活性具有显著差异(P<0.05)。图6 血橙汁胞枯水时柠檬酸降解关键酶的活性Fig.6 Key enzymes activities of citric acid degradation in juice vesicles of blood orange during segment drying
2.5 血橙枯水时柠檬酸降解途径相关基因表达分析
综合代谢组学、氨基酸定量分析及GLN、GAD酶活数据,乙酰辅酶A合成途径是血橙枯水时柠檬酸降解的主要途径。
2.5.1脂代谢相关基因在甜橙中的生物信息学鉴定结果
脂代谢是本研究代谢组学揭示的枯水时相关主要差异代谢途径,是柠檬酸通过乙酰辅酶A合成途径降解后的重要去向。乙酰辅酶A在乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACCase)作用下催化生成丙二酰辅酶A,硬脂酰-ACP去饱和酶(stearyl-ACP desaturase,FAB)催化硬脂酸生成油酸,然后油酸被脂肪酸去饱和酶(fatty acid desaturase,FAD)催化成亚油酸和α-亚麻酸,最后由脂氧合酶(lipoxygenase,LOX)催化合成13-氢过氧化亚麻酸。甜橙脂代谢相关基因的生物信息学鉴定与分析见图7。生物信息学方法从甜橙基因组鉴定了2个编码ACCase的基因(命名为CsaccA和CsaccC)、6个编码FAB的基因(命名为CsFAB1~6)、8个编码FAD的基因(命名为CsFAD1~8)和12个编码LOX的基因(命名为CsLOX1~12)。这些基因分布在8条染色体上,包括chr1、3、4、6、7、8、9及Un[图7(a)]。对脂代谢基因编码的氨基酸序列进行分析,见表1。由表1可知,6个CsFAB编码的蛋白质包含322~396个氨基酸,8个CsFAD编码的蛋白质包含306~447个氨基酸,12个CsLOX编码的蛋白质包含603~932个氨基酸。
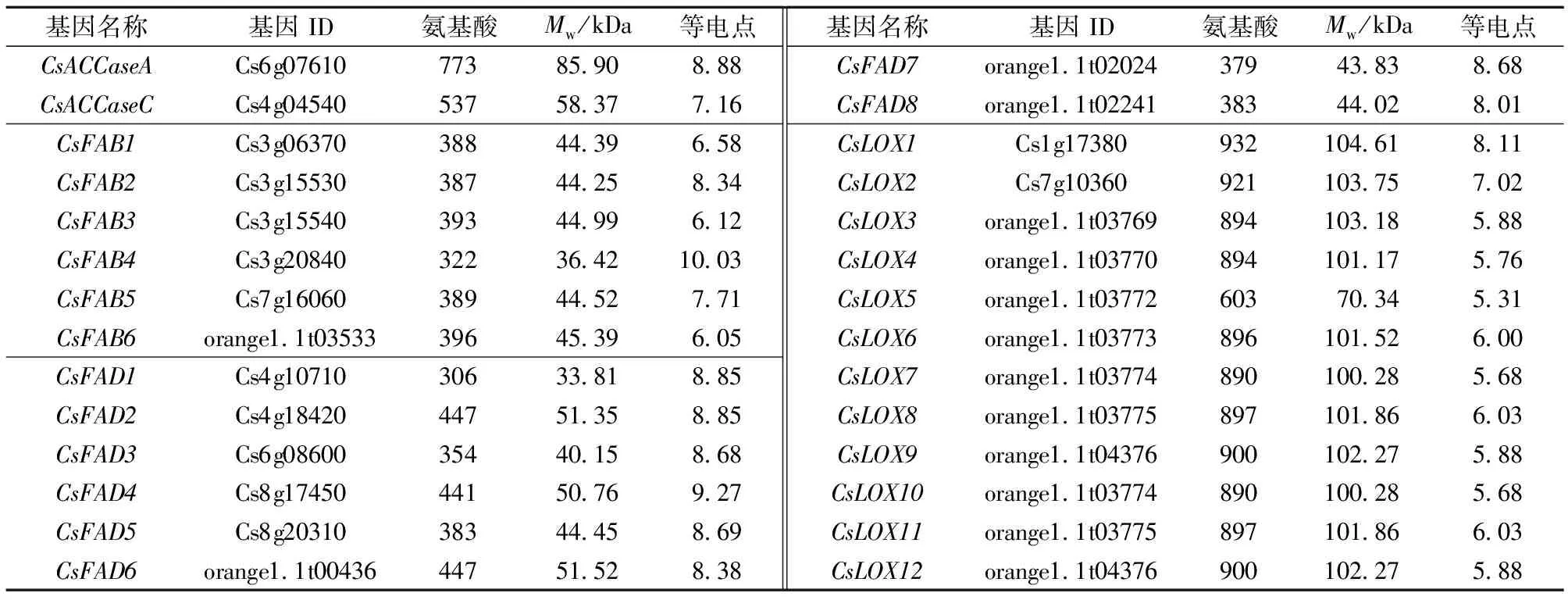
表1 脂代谢基因编码蛋白的基本特性
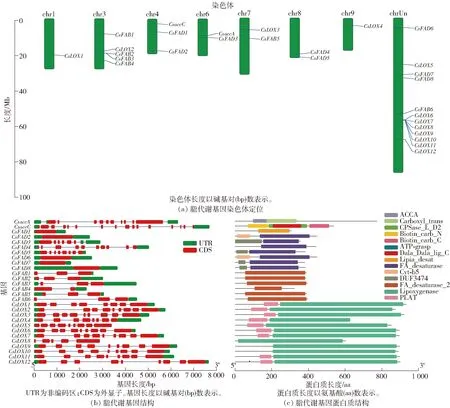
图7 甜橙脂代谢相关基因的生物信息学鉴定与分析Fig.7 Identification and analysis of bioinformatics of lipid metabolism related genes in sweet orange
甜橙脂代谢相关基因的基因结构和蛋白质结构分析结果见图7(b)、图7(c)。结果发现,同一基因家族内不同成员的外显子数量有明显差异[图7(b)]。CsaccA和CsaccC分别有16个和10个外显子;除CsFAB4含有2个外显子外,其余CsFABs均有3个外显子;CsFAD1~2和CsFAD6~8没有内含子,CsFAD3含有7个外显子,CsFAD4有10个外显子,CsFAD5有8个外显子;对于CsLOX家族,CsLOX8有5个外显子,其余成员则含有8~9个外显子[图7(b)]。甜橙脂代谢基因家族编码的蛋白质结构域分析显示,同一家族的蛋白质结构域高度保守[图7(c)]。
2.5.2脂代谢基因在血橙枯水时的表达规律分析
血橙汁胞枯水时脂代谢相关基因的表达见图8。 28个脂代谢基因的19个成员在血橙汁胞中有表达(FPKM>1),包括2个CsACCase、5个CsLOX、7个CsFAD和5个CsFAB。其中,CsaccA在枯水时表达量显著上调(P<0.05)[图8(a)];CsLOX家族有4个基因差异表达,表达量变化最大的成员为CsLOX2,在枯水时上调了206.4%,另外,CsLOX1在枯水时表达量增加了179%(P<0.05)[图8(b)];CsFAB家族中,共有3个枯水差异表达基因,其中CsFAB2和CsFAB6在枯水时表达量显著上调(P<0.05)[图8(c)];共有7个CsFAD家族成员在枯水时差异表达,其中CsFAD1~6显著上调(P<0.05)。尽管有部分CsLOX、CsFAD和CsFAB家族成员在枯水时下调,但脂代谢基因家族在枯水时整体呈上调趋势,提示脂代谢的转录被激活。
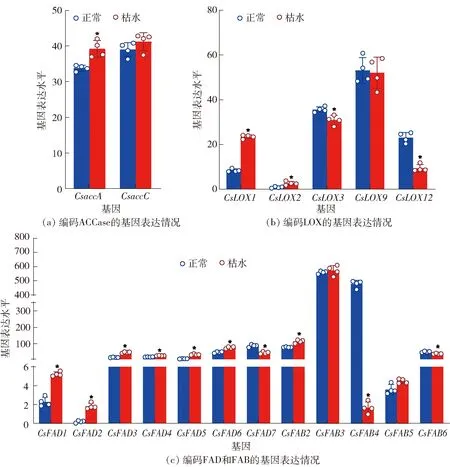
*表示组间数据差异显著(P<0.05)。图8 血橙汁胞枯水时脂代谢相关基因的表达Fig.8 Expression of genes related to lipid metabolism in juice vesicles of blood orange during segment drying
2.5.3其他柠檬酸代谢相关基因在血橙枯水时的表达规律分析
血橙汁胞枯水时柠檬酸代谢相关基因的表达见图9。柑橘果实柠檬酸合成主要包括天冬氨酸氨基转移酶(aspartate aminotransferase,AAT)和柠檬酸合成酶(citrate synthase,CS)2个关键酶;其中丰度最高的CsAATs成员Cs4g16050在枯水时表达量降低了47.9%(P<0.05)[图9(a)];2个CsCSs成员在血橙枯水时表达均没有显著差异(P>0.05)[图9(b)]。综合CsAATs和CsCSs家族成员在枯水时的表达量可以判断,血橙枯水时柠檬酸合成途径的转录整体呈被抑制的状态。
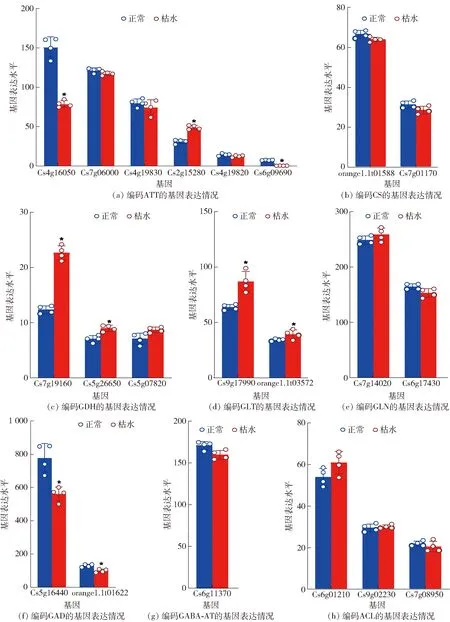
*表示组间数据差异显著(P<0.05)。图9 血橙汁胞枯水时柠檬酸代谢相关基因的表达Fig.9 Expression of genes related to citric acid metabolism in juice vesicles of blood orange during segment drying
谷氨酸脱氢酶(glutamate dehydrogenase,GDH)、谷氨酰胺合酶(glutamine synthetase,GLN)、谷氨酸合酶(glutamate synthase,GLT)和谷氨酰胺脱羧酶(glutamine decarboxylase,GAD)是柑橘果实柠檬酸降解途径中的4个关键酶。CsGDHs家族成员共2个差异表达基因均在枯水时显著上调(P<0.05)[图9(c)];2个CsGLTs家族成员在枯水时均显著上调表达(P<0.05)[图9(d)];CsGLNs在枯水时无显著变化(P>0.05)[图9(e)]。这些结果提示谷氨酸合成途径在枯水时被激活,这也可能是汁胞谷氨酸含量增加的原因。2个CsGADs家族成员在枯水时均显著下调(P<0.05)[图9(f)],CsGABA-AT在枯水没有显著变化(P>0.05)[图9(g)]。这说明GABA途径的转录在枯水时被抑制。乙酰辅酶A合成途径关键酶——ATP-柠檬酸裂解酶(ATP-citrate lyase,ACL)编码基因CsACLs家族共有3个成员,在枯水时没有显著的差异表达(P>0.05)[图9(h)]。推测ACL的调控可能主要不是发生在转录水平,有待于进一步深入研究。
3 讨 论
柠檬酸是柑橘果实的主要有机酸,在成熟和衰老阶段缓慢降解,而在枯水时则快速降解[1,19-21]。柠檬酸耗竭是柑橘枯水的典型特征,本研究发现乙酰辅酶A途径在血橙汁胞萎缩型枯水时被激活,而GABA支路活性在枯水时相对稳定。
乙酰辅酶A合成途径是柑橘果实成熟和衰老时柠檬酸消耗的主要途径[20-21]。柠檬酸经ACL催化降解为草酰乙酸和乙酰辅酶A,其中乙酰辅酶A进一步进入氨基酸、脂肪酸和次生代谢物合成等途径[20]。本研究的代谢组学数据(包括代谢物质变化及代谢途径变化规律)和氨基酸含量结果提供了强有力的证据,支持乙酰辅酶A合成途径是血橙汁胞萎缩型枯水时柠檬酸降解的主要机制。转录水平的证据提示,尽管乙酰辅酶A合成途径关键酶ACL的表达在枯水时没有被激活,但脂代谢相关基因整体呈上调趋势。Wang等[3]对蜜柚汁胞粒化型枯水的糖酸代谢进行了系统研究,结果发现乙酰辅酶A合成途径是其柠檬酸降解的主要途径。在椪柑中也发现乙酰辅酶A合成途径是其枯水时柠檬酸降解的主要机制[6]。可以推测,乙酰辅酶A合成途径是汁胞萎缩型和粒化型枯水中都存在的保守降酸途径。
目前对柑橘果实乙酰辅酶A合成途径的转录水平等调控机制研究较少。本研究揭示该途径关键酶ACL在转录过程中没有被激活,暗示枯水时存在其他水平的调控机制。动物实验研究结果揭示,ACL在转录后特别是翻译后表达被调控[22-23],这进一步证实了本研究的猜想。在粒化型枯水中,蜜柚编码ACL的基因CgACL表达量显著上调[3],椪柑中也有类似的结果[6]。这说明乙酰辅酶A合成途径的调控机制或许在2种枯水类型中不同,2种枯水类型在形态及生理方面存在差异,需要进一步深入研究。
GABA支路是近年被发现的柑橘柠檬酸降解途径,主要发生在果实成熟和衰老阶段[24-25]。本研究的代谢组学数据、酶活数据和转录水平证据均表明,GABA支路在枯水时没有被激活,甚至可能被抑制。这意味着GABA支路不是血橙枯水时柠檬酸快速降解的主要途径。该结果与蜜柚粒化型枯水中的结果一致[3],说明在2种枯水类型中,GABA支路都不是主要的降酸途径。柠檬酸降解内在的调控机制还不清楚,但考虑到柑橘枯水时,细胞壁合成途径的异常激活同样也导致柠檬酸的快速消耗,研究推测细胞壁代谢途径和GABA支路可能存在某种拮抗关系,有待未来深入研究。
4 结 论
本研究以塔罗科血橙为实验材料,研究了汁胞萎缩型枯水的柠檬酸降解机制。结果表明:血橙在采前遭遇低温时易发生汁胞萎缩型枯水,枯水汁胞中的柠檬酸含量显著下降,丝氨酸、亚油酸及其他脂类物质等乙酰辅酶A途径代谢产物的含量显著升高,同时脂代谢基因在枯水时呈上调表达趋势,编码ACL的基因CsACLs的表达没有明显变化。GABA含量和GAD活性在枯水时变化不明显,编码GAD的基因CsGADs的表达呈下调趋势。GLN活性在血橙枯水进程中显著升高。结果表明,血橙枯水时柠檬酸快速降解的主要机制是乙酰辅酶A合成途径,而不是GABA支路,此外,谷氨酰胺合成及TCA循环可能也参与血橙枯水时柠檬酸降解。本研究揭示了柑橘萎缩型枯水进程中柠檬酸降解机制,对于理解柑橘枯水的生理基础具有一定的意义。
