基于芳香烃受体探讨青黛及其主要成分缓解溃疡性结肠炎的作用机制
2023-11-03高阳顾思臻薛艳刘晓雯窦丹波
高阳 ,顾思臻 ,薛艳 ,刘晓雯 ,窦丹波
1.上海中医药大学附属曙光医院,上海 201203; 2.同济大学附属养志康复医院,上海 201619
溃疡性结肠炎(ulcerative colitis,UC)是一种局限于黏膜及黏膜下层的非特异性肠道炎症性疾病,具有慢性、难治性、复发性的特点,临床表现为腹痛、腹泻、黏液脓血便、里急后重及不同程度的全身症状[1]。UC全球发病率有逐年升高趋势[2]。目前其发病机制尚未明确,主要与遗传、环境、感染、免疫等因素有关。现代医学治疗UC存在疗效不稳定、不良反应较多等问题[3]。
研究显示,口服青黛治疗活动期UC临床疗效显著[4],基础研究表明,青黛发挥作用可能与激活AHR/CYP1A1通路有关[5]。课题组前期通过网络药理学分析筛选出青黛治疗UC的9个主要成分,包括靛蓝、靛玉红和色胺酮等,并通过分子对接发现靛蓝、靛玉红和色胺酮均为芳香烃受体(AHR)的配体[6]。因此,本研究以AHR及其下游关键分子为切入点,采用葡聚糖硫酸钠(DSS)诱导C57BL/6小鼠UC模型,明确青黛及其主要成分靛蓝、靛玉红和色胺酮对UC的影响及作用机制。
1 实验材料
1.1 动物
SPF级雄性C57BL/6小鼠42只,体质量18~25 g,上海吉辉实验动物有限公司提供,动物生产许可证号SCXK(沪)2022-0009。饲养于上海中医药大学动物实验中心,温度22~25 ℃,湿度50%,自由摄食饮水。每日清洁饲养笼,隔日更换垫料,适应性饲养7 d。本实验经上海中医药大学动物实验伦理委员会审批(PZSHUTCM200821015)。
1.2 药物及制备
建青黛[7],为爵床科植物马蓝Baphicacanthus cusia(Nees)Bremek.的叶或茎叶经加工制成的干燥粉末,购于福建省德龙药业,批号FJ20180005,中国GMP药品证书FJ20180005;靛蓝,北京索莱宝公司,货号SI8050,纯度≥98%;靛玉红,北京索莱宝公司,货号SI8060,纯度≥98%;色胺酮,上海源叶公司,货号S31557,纯度≥98%。以上药物分别用0.5%羧甲基纤维素钠溶解,制成建青黛、靛蓝、靛玉红、色胺酮浓度分别为0.06、0.03、0.001、0.03 g/mL溶液。
1.3 主要试剂与仪器
羧甲基纤维素钠,北京索莱宝公司,货号c8621;多聚甲醛固定液,北京索莱宝公司,货号p1110;细胞色素P4501A1(CYP1A1)抗体,美国Proteintech,货号13241-1-AP;AHR 抗体,美国CST 公司,货号83200S;白细胞介素(IL)-10抗体,美国Proteintech公 司, 货 号20850-1-AP; IL-22 抗 体, 美 国Proteintech,货号13462-1-AP;TB Green qPCR 试剂盒,日本TAKARA,货号RR420A。
蛋白电泳仪(上海天能,型号VE-180),蛋白转膜仪(上海天能,型号VE-186),5417R台式冷冻高速离心机(德国Eppendorf公司,型号5417R),电热恒温水浴锅(上海精宏,型号DK-S26),分光光度计(美国Thermo,型号NanoDrop 2000),PCR仪(德国Analytik Jena公司,型号SL96),qPCR仪(美国ABI公司,型号Stepone plus),凝胶成像系统(上海天能,型号GIS2009)。
2 实验方法
2.1 分组及造模
按随机区组法将42只小鼠随机分为空白组、模型组、青黛组、靛蓝组、靛玉红组和色胺酮组,每组7只。空白组正常饮水,其余各组饮用4%DSS溶液(将DSS用纯水溶解,现配现用)制备急性UC模型,连续10 d。
2.2 给药
造模第4日开始,青黛组予青黛溶液600 mg/kg灌胃,靛蓝组予靛蓝溶液300 mg/kg灌胃[8],靛玉红组予靛玉红溶液10 mg/kg灌胃[9],色胺酮组予色胺酮溶液300 mg/kg灌胃[10-11],均相当于临床成人等效剂量。空白组和模型组予等体积生理盐水灌胃,连续7 d。
2.3 取材
末次给药后小鼠禁食24 h,2%戊巴比妥钠腹腔注射麻醉小鼠,75%乙醇消毒腹部,沿腹部中线剪开,充分暴露腹膜和腹腔,用镊子分离结肠和回肠,将结肠置于冰上,PBS冲洗结肠组织,剥离多余脂肪,用标尺测量结肠长度。纵剖结肠,取出结肠内容物,PBS冲洗,滤纸吸去多余水分,用剪刀剪取病变最明显处结肠组织,置于4%多聚甲醛中固定。其余结肠组织放于EP管内,置于-80 ℃冰箱保存。
2.4 一般状况观察
造模及给药期间,每日记录各组小鼠体质量、精神活动状态、毛发色泽、进食量和饮水量、大便性状及存活情况。
2.5 结肠组织病理观察
结肠组织置于多聚甲醛溶液中固定24 h,石蜡包埋,制成5 μm切片,常规HE染色,光学显微镜下观察结肠组织形态变化。
2.6 Western blot检测
取结肠组织,加入适量RIPA 裂解液(含1%PMSF)提取总蛋白,BCA法测定蛋白浓度,10%电泳分离90 min,湿转法转膜(300 mA、60 min),用5%脱脂牛奶室温封闭1 h,滴加CYP1A1 一抗(1∶1 000)、AHR一抗(1∶1 000)、IL-10一抗(1∶1 000)、IL-22一抗(1∶2 000),4 ℃孵育过夜。PBST洗膜4次,每次8 min,加二抗(1∶5 000),室温孵育1 h。PBST洗膜4次,超敏ECL液显影。以GAPDH为内参,采用Image J软件分析目的蛋白相对灰度值。
2.7 RT-PCR检测
参照总RNA提取试剂盒提取结肠组织总RNA,测定RNA浓度后将其反转录成cDNA,进行实时荧光定量PCR 检测。反应条件:95 ℃、30 s,95 ℃、5 s,60 ℃、34 s,共40个循环。以GAPDH为内参,2-ΔΔCt法计算目的基因相对表达量。引物序列见表1。

表1 各基因PCR引物序列
3 统计学方法
采用SPSS22.0 统计软件进行分析。计量资料以±s表示,符合正态分布且方差齐组间比较用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 青黛及其主要成分对模型小鼠一般状况的影响
空白组小鼠毛色光泽,活动灵敏,饮食量、饮水量及粪便情况正常。模型组小鼠毛发粗糙,活动量减少,体质量下降,饮食量减少,出现肉眼可见的肛周血便、稀便;青黛组、靛蓝组、靛玉红组和色胺酮组小鼠毛色、体质量、精神状态和血便等情况较模型组有不同程度改善。与空白组比较,模型组小鼠体质量明显降低(P<0.01);与模型组比较,青黛组、靛蓝组、靛玉红组和色胺酮组小鼠体质量明显升高(P<0.01)。见表2。
表2 各组小鼠体质量比较(±s,g)

表2 各组小鼠体质量比较(±s,g)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01
体质量22.37±0.67 15.16±0.63**19.99±0.23##20.09±1.15##20.04±0.63##20.06±0.62##组别空白组模型组青黛组靛玉红组靛蓝组色胺酮组只数7 7 7 7 7 7
4.2 青黛及其主要成分对模型小鼠结肠长度及结肠形态的影响
与空白组比较,模型组小鼠结肠长度明显缩短(P<0.01);与模型组比较,青黛组、靛玉红组和色胺酮组小鼠结肠长度明显增加(P<0.01,P<0.05)。见表3。
表3 各组小鼠结肠长度比较(±s,cm)
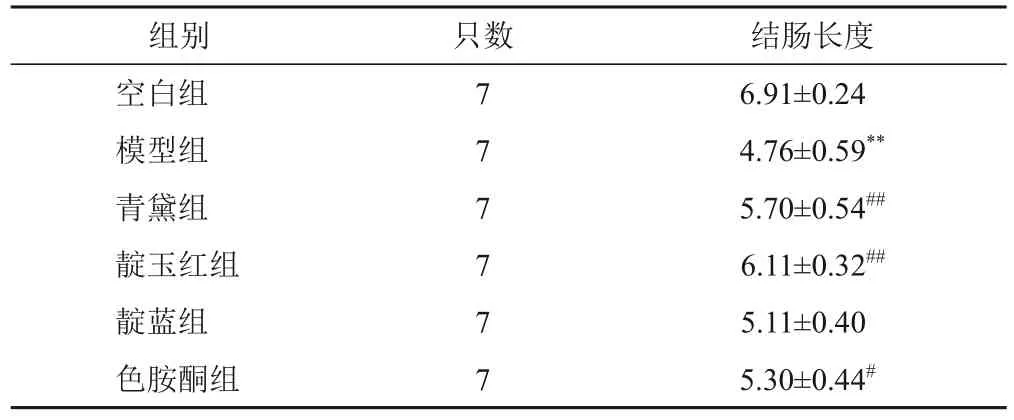
表3 各组小鼠结肠长度比较(±s,cm)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
结肠长度6.91±0.24 4.76±0.59**5.70±0.54##6.11±0.32##5.11±0.40 5.30±0.44#组别空白组模型组青黛组靛玉红组靛蓝组色胺酮组只数7 7 7 7 7 7
HE染色显示,空白组小鼠结肠黏膜、腺体完整,隐窝正常,无水肿及炎性细胞浸润;模型组小鼠结肠黏膜缺损,腺体不完整,隐窝缩短或消失,杯状细胞减少,出现炎性细胞浸润及黏膜下层水肿等变化;青黛组、靛蓝组、靛玉红组和色胺酮组小鼠结肠组织溃疡及黏膜损伤程度明显减轻,水肿和炎性细胞浸润有不同程度改善。见图1。
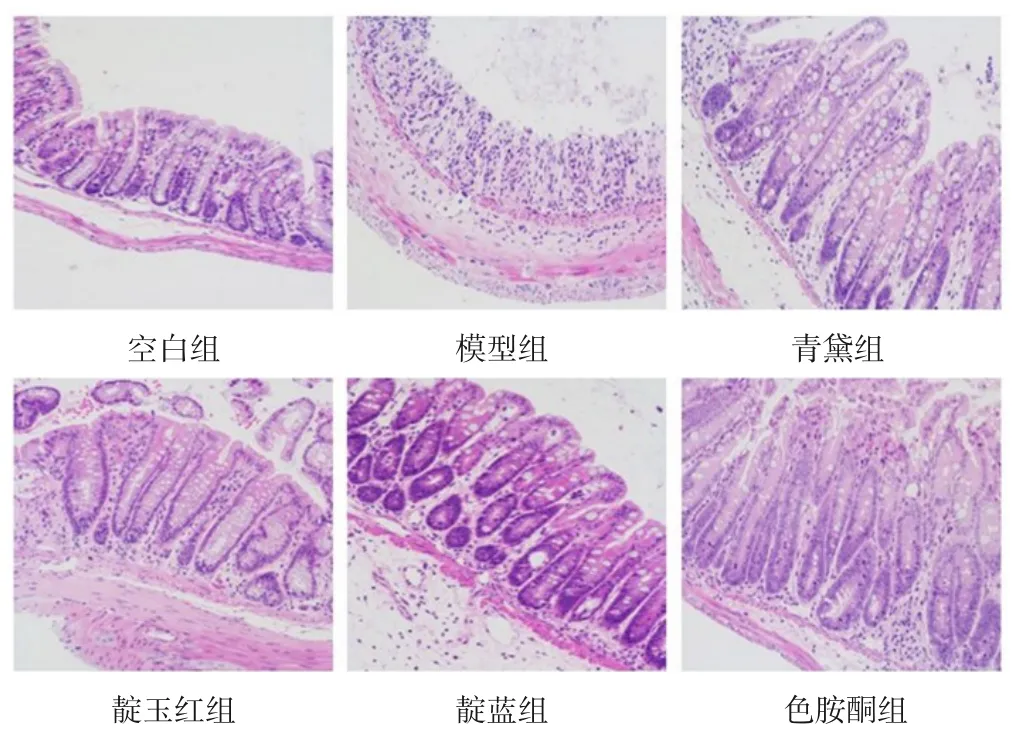
图1 各组小鼠结肠组织形态(HE染色,×200)
4.3 青黛及其主要成分对模型小鼠结肠组织芳香烃受体、细胞色素P4501A1、白细胞介素-10、白细胞介素-22蛋白表达的影响
与空白组比较,模型组小鼠结肠组织CYP1A1、IL-10、IL-22蛋白表达明显降低,差异有统计学意义(P<0.01,P<0.05);与模型组比较,各给药组小鼠结肠组织AHR、CYP1A1、IL-10、IL-22蛋白表达明显升高,差异有统计学意义(P<0.01)。见图2、图3。
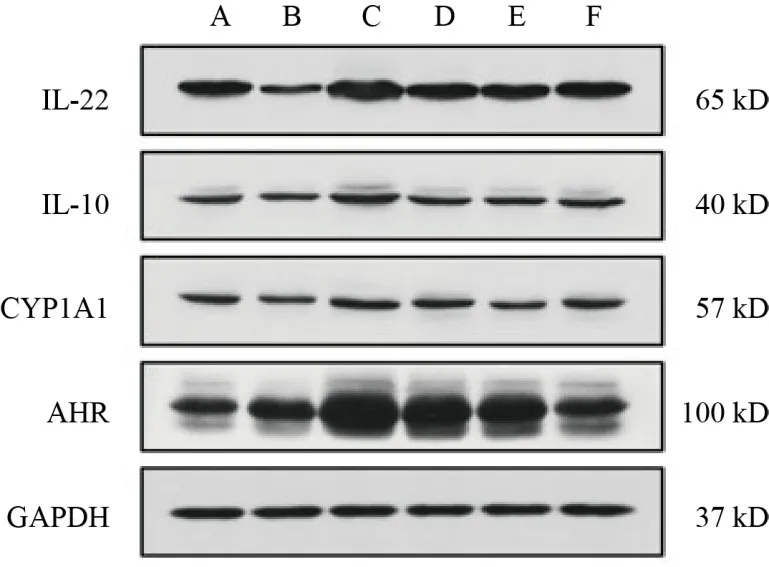
图2 各组小鼠结肠组织AHR、CYP1A1、IL-10、IL-22蛋白免疫印迹
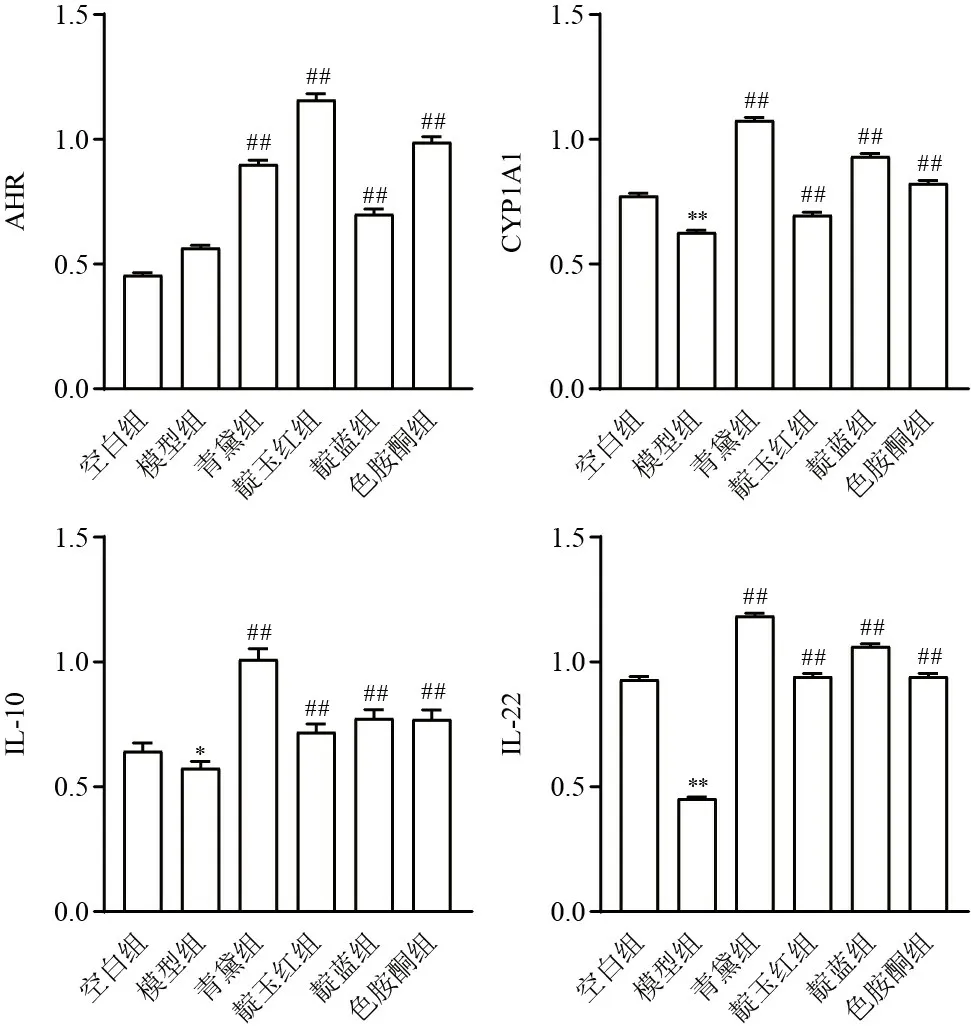
图3 各组小鼠结肠组织AHR、CYP1A1、IL-10、IL-22蛋白表达比较(±s,每组7只)
4.4 青黛及其主要成分对模型小鼠结肠组织芳香烃受体、细胞色素P501A1、白细胞介素-10、白细胞介素-22 mRNA表达的影响
与空白组比较,模型组小鼠结肠组织AHR、IL-10、IL-22 mRNA 表 达 明 显 降 低(P<0.01),CYP1A1 mRNA表达有降低趋势(P>0.05);与模型组比较,靛玉红组和色胺酮组小鼠结肠组织AHR、CYP1A1、IL-10、IL-22 mRNA表达明显升高(P<0.01),靛蓝组小鼠结肠组织AHR、CYP1A1、IL-22 mRNA表达明显升高(P<0.01),青黛组小鼠结肠组织AHR、IL-10 mRNA表达明显升高(P<0.01)。见表4。
表4 各组小鼠结肠组织AHR、CYP1A1、IL-10、IL-22 mRNA表达比较(±s)

表4 各组小鼠结肠组织AHR、CYP1A1、IL-10、IL-22 mRNA表达比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01
组别空白组模型组青黛组靛蓝组靛玉红组色胺酮组IL-22 73.12±19.76 3.56± 2.27**19.97± 6.94 34.56± 3.18##143.46± 8.62##207.05±13.02##只数7 7 7 7 7 7 AHR 3.31±0.25 0.46±0.06**2.14±0.64##1.78±0.18##3.42±1.01##5.59±0.53##CYP1A1 69.18±15.36 22.89± 3.30 36.20± 4.78 166.96±85.04##117.42±17.09##259.51± 6.17##IL-10 53.59± 2.81 11.87± 1.58**69.53± 7.42##19.65± 0.71 85.28± 6.94##126.50±25.48##
5 讨论
青黛有清热解毒、凉血消斑、泻火定惊等功效。口服青黛方药多用于治疗血证,包括血热吐衄、胸痛咳血、温毒发斑等,如《端效方》青金散治吐血不止,“青黛二钱,新水调下”;《本经逢原》谓其能“散郁火,治温毒发斑及产后热痢下重”;《本草求真》言:“青黛,大泻肝经实火及散肝经火郁……痢血等症。”UC发作以便脓血为主,镜下表现为肠黏膜溃疡、糜烂、出血等,属中医学“久痢”“血证”等范畴。临床研究显示,口服青黛对UC患者有良好的治疗效果[12],对于中度UC活动期患者病情缓解效果显著[4],不同剂量青黛联合西药治疗后,其临床有效率、缓解率和黏膜愈合率均显著高于安慰剂组[13]。实验研究表明,青黛能下调UC模型小鼠脾脏CD4+T细胞表达[14],抑制小鼠炎症反应并促进黏膜修复[15],升高短链脂肪酸受体GPR41、GPR43表达,调节Treg/Th17平衡,发挥治疗UC作用[16];体外实验显示,青黛能通过降低炎症因子IL-6表达发挥抗炎效果[17]。以上结果均提示青黛具有治疗UC潜能,但相关机制仍需进一步探索。
AHR是由805个氨基酸组成的胞质转录因子[18],非活性状态的AHR可被其配体激活,活化的AHR从复合态转变为游离态,进一步与细胞核内AHR核转位蛋白结合为二聚体,从而促进下游基因转录[19]。AHR可以调节细胞分化和细胞凋亡,发挥抗炎作用[20]。研究显示,UC患者AHR mRNA表达明显低于对照组[21]。动物实验显示,使用AHR拮抗剂后,UC小鼠结肠炎症程度进一步加重;AHR基因敲除UC小鼠出现不同程度的结肠组织损害、隐窝结构变形、上皮细胞坏死水肿及中性粒细胞和淋巴细胞浸润[22],提示上调AHR表达能缓解结肠炎症状态。AHR与配体结合后能上调CYP1A1 表达,CYP1A1 表达升高是AHR 活化的标志[5],激活AHR/CYP1A1信号通路可能是抑制UC炎症的作用机制。IL-10作为一种抗炎因子,其表达水平与UC疾病进展有关。AHR/CYP1A1信号通路活化后能促进IL-10表达和分泌,进而诱导肠上皮细胞IL-10受体(IL-10R1)表达[23]。IL-10 与IL-10R1 结合后,介导信号传导与转录激活因子3(STAT3)磷酸化,p-STAT3通过上调抗凋亡和增殖相关基因转录促进肠黏膜愈合。临床研究发现,中重度UC 患者结肠黏膜IL-10表达明显低于轻度UC患者及正常组[24],而IL-10基因敲除小鼠可出现自发性肠炎[25]。IL-22在UC发病中起重要作用,可通过诱导产生多种抗菌肽保护肠道上皮细胞屏障功能。IL-22由多种细胞产生,包括自然杀伤细胞、活化T细胞、辅助性T细胞17等。肠道中IL-22主要由维甲酸相关孤儿受体γt 相关的固有淋巴细胞ILC3产生[26]。此外,肠道微生物能通过激活AHR影响IL-22表达。
本研究通过DSS自由饮用建立UC小鼠模型,并分别予青黛、靛蓝、靛玉红及色胺酮进行干预,结果表明,模型小鼠结肠长度缩短和体质量下降有所恢复,同时结肠组织病理变化明显减轻,黏膜损伤、水肿、溃疡情况好转,炎性细胞浸润减少。进一步采用Western blot检测AHR/CYP1A1信号通路相关蛋白表达,青黛组、靛蓝组、靛玉红组和色胺酮组小鼠结肠组织AHR、CYP1A1、IL-10、IL-22 蛋白表达显著上调。PCR结果显示,靛玉红组和色胺酮组小鼠结肠组织AHR、CYP1A1、IL-10、IL-22 mRNA表达显著升高。提示青黛及其主要成分靛蓝、靛玉红、色胺酮可能通过激活AHR/CYP1A1通路上调抗炎因子IL-10和IL-22表达,进而改善UC。其中以靛玉红和色胺酮改善各项指标作用最明显。本研究对青黛及其主要成分治疗UC的作用机制进行探讨,可为中医药治疗UC提供实验依据。
