中药多糖治疗阿尔茨海默病药理作用及其机制研究进展
2023-11-03汪麟双杨思霞李敏程卫东卫东锋
汪麟双 ,杨思霞 ,李敏 ,程卫东 ,卫东锋
1.中国中医科学院中医临床基础医学研究所,北京 100700;2.南方医科大学中医药学院,广东 广州 510515;3.北京师范大学认知神经科学与学习国家重点实验室,北京 100875
阿尔茨海默病(Alzheimer disease,AD)又称老年性痴呆,是一种常见的中枢神经系统退行性疾病,临床主要表现为进行性记忆和认知功能下降、行为异常及社交障碍等。随着老龄化社会的发展,AD患病率、病残率及病死率持续增长[1]。AD发病机制尚不完全清楚,目前主流的发病假说有β-淀粉样蛋白(Aβ)级联假说、胆碱能学说、炎症与能量代谢学说等,多数研究者认为AD由多种致病因素共同导致。常用的西药如乙酰胆碱酯酶抑制剂、抗谷氨酸能药物、钙通道阻滞剂等主要是对症治疗,且存在不良反应,临床应用有一定局限性[2]。中医药防治AD历史悠久、疗效显著、安全性较高,具有一定优势[3-4]。生物活性多糖作为众多中药提取物的主要活性成分,以其安全、无毒、多靶点的治疗特点备受关注。研究表明,中药多糖对AD的防治作用通过多种药理机制实现,包括提高学习记忆能力、减缓Aβ沉积、抑制神经细胞凋亡、改善中枢胆碱能系统、清除自由基、抗氧化、保护神经细胞和突触、抑制Tau蛋白过度磷酸化等,与AD病理机制相契合。本文综述近年来中药多糖改善学习记忆能力和治疗AD方面的药理作用及其机制研究进展,为研究开发相关药物提供参考。
1 中药多糖组成
中药多糖作为治疗AD的有效物质,是药物研发的重点[5]。AD动物和细胞模型研究显示,中药多糖能通过改善学习记忆能力、减缓Aβ沉积、抑制神经凋亡、抗氧化应激和自由基损伤、抗炎和改善能量代谢等多靶点、多通路、多机制方式干预AD的不同病理环节,延缓或减轻病情发展[6-9]。研究显示,中药多糖主要由葡萄糖、鼠李糖、甘露糖、半乳糖、木糖及阿拉伯糖等多种单糖成分组成(见表1)。
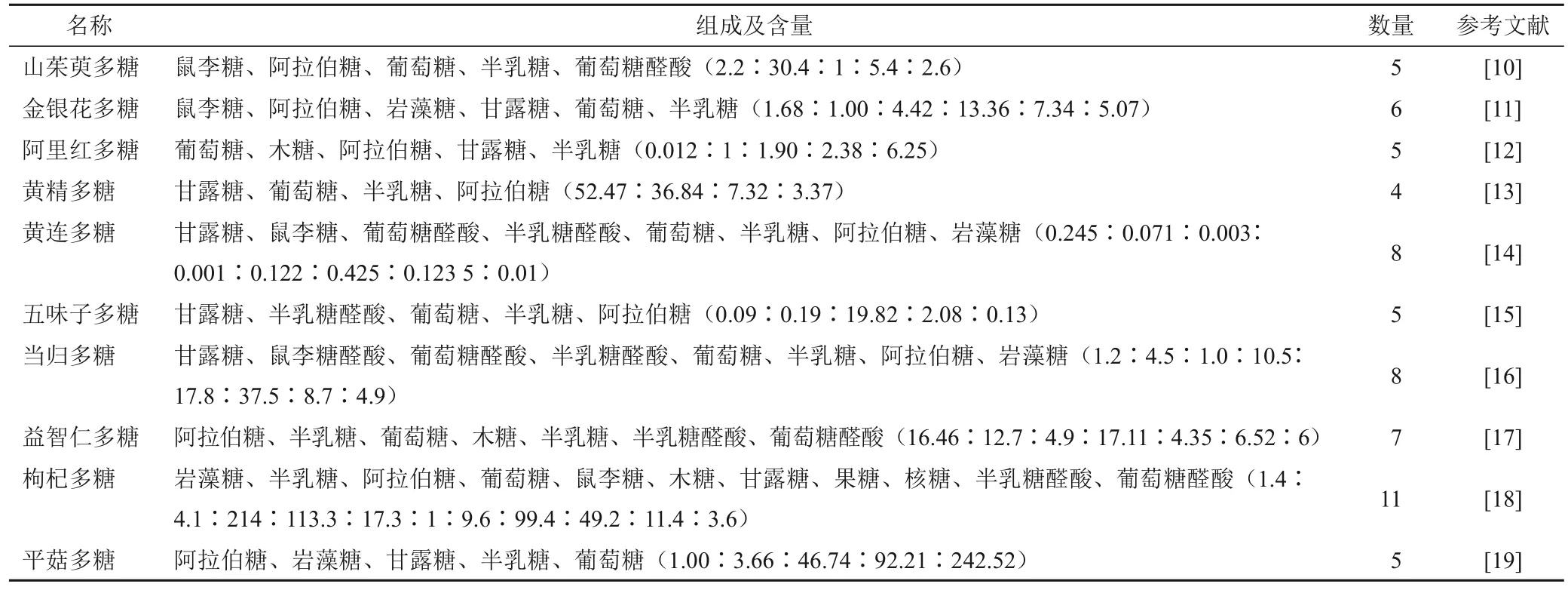
表1 10种中药多糖中单糖和糖醛酸组成
2 药理作用及机制
2.1 提高学习和记忆能力
已有研究表明,随着患者皮层与海马中Aβ与Tau蛋白过度沉积,AD患者学习和记忆能力出现明显障碍,病情后期患者生活不能自理,给家庭和社会带来极大的生活和经济负担[20-21]。大量研究表明,中药多糖对AD学习和记忆能力具有一定改善作用。欧芹等[22]采用Morris水迷宫实验研究山茱萸多糖对D-半乳糖诱导的AD模型大鼠学习记忆能力的影响,结果显示,山茱萸多糖能缩短AD大鼠在定位航行能力测试中的逃避潜伏期,增加空间探索实验中大鼠在目标象限的游泳时间、游泳路程和穿越平台次数,表明山茱萸多糖能提高AD大鼠对空间定位的学习和记忆能力。胡美变等[23]研究花椒多糖对D-半乳糖联合三氯化铝诱导的AD小鼠认知行为的影响,Morris水迷宫实验结果显示,花椒多糖能缩短小鼠在空间探索实验中的逃避潜伏期,增加穿越平台次数和目标象限停留时间,表明花椒多糖能明显改善AD小鼠的学习和记忆能力。
2.2 减缓β-淀粉样蛋白沉积
细胞外老年斑和细胞内神经原纤维缠结是AD的典型病理学表现。老年斑的主要成分Aβ及淀粉样蛋白前体(APP)的积累会产生神经毒性,激活各种细胞信号通路并最终导致神经元细胞死亡[24-25]。Li等[26]研究海参多糖对Aβ40聚集和细胞毒性的影响,硫黄素T染色实验结果显示,海参多糖可抑制Aβ40聚集,分解原纤维前体;噻唑蓝比色法检测结果显示,海参多糖可抑制Aβ40诱导的N2a 细胞的细胞毒性,提高细胞存活率。Liu等[27]研究金银花多糖对PC12细胞的影响,结果显示,金银花多糖能降低Aβ42含量,抑制Aβ42聚集、低聚反应及纤维形成,促进神经突起延长。李珍等[28]研究阿里红多糖的纯化组分a与b对APP/PS1双转基因小鼠的影响,结果显示,阿里红多糖能减少转基因小鼠海马区APP、Aβ1-42和GSK3α mRNA和蛋白表达,降低AD小鼠脑内APP上游调控蛋白GSK3α的活性,抑制APP转变为不溶性Aβ,减缓斑块沉积,表明阿里红多糖能通过减缓Aβ沉积,缓解神经毒性,发挥神经保护作用。
2.3 抑制细胞凋亡
细胞凋亡介导的凋亡性神经元在AD的发生发展中发挥重要作用。AD患者大脑皮层和海马区神经元丢失与神经细胞凋亡密切相关[29],通过药物干预抑制细胞凋亡能有效减缓AD早期神经元死亡[30]。Zhang等[31]研究黄精多糖对Aβ25-35诱导的PC12细胞神经毒性的影响,结果显示,黄精多糖能显著降低细胞死亡率和Bax/Bcl-2比例,抑制细胞色素C释放和Caspase-3活性,提高细胞内Akt磷酸化水平,且黄精多糖对AD模型细胞凋亡的抑制作用可被PI3K抑制剂(LY294002)完全消除,表明黄精多糖可通过激活PI3K/Akt信号通路抑制Aβ诱导的PC12细胞凋亡。Li等[32]研究黄连多糖对Aβ诱导的PC12细胞的影响,结果显示,黄连多糖能提高细胞活力,抑制乳酸脱氢酶、核碎片和线粒体细胞色素C释放,抑制JNK 磷酸化,降低Bax 和Caspase-3 蛋白表达,升高Bcl-2蛋白表达,表明黄连多糖能通过JNK信号通路减轻Aβ诱导的细胞毒性和细胞凋亡,改善线粒体功能障碍。
2.4 改善中枢胆碱能系统
乙酰胆碱(ACh)是脑组织内重要的神经递质,脑内细胞外液中ACh含量变化与认知功能改变具有密切关系。乙酰胆碱酯酶(AchE)和胆碱乙酰转移酶(ChAT)分别是ACh的水解和合成酶,共同维持脑内ACh活性,两者活性变化对认知功能有重要影响[33]。Du等[34]研究当归多糖对Aβ25-35诱导的AD大鼠模型的影响,结果显示,当归多糖能降低大鼠海马AchE含量,增加Ach和ChAT含量。Liu等[35]研究五味子多糖对Aβ25-35诱导的AD大鼠模型的影响,结果显示,五味子多糖能降低AD大鼠海马AchE、GSK-3β、一氧化氮合酶(NOS)表达,降低γ-氨基丁酸(GABA)、ACh、甘氨酸、去甲肾上腺素(NE)、牛磺酸、血清素和多巴胺含量,增加谷氨酸和天冬氨酸含量,表明五味子多糖具有中枢神经系统保护作用。王虎平等[36]研究当归多糖对Aβ25-35诱导的AD小鼠海马炎症的影响,结果显示,当归多糖能提高血清ACh含量及ChAT、超氧化物歧化酶(SOD)活性,抑制AchE活性,降低胆碱酯酶含量,表明当归多糖能通过改善小鼠中枢胆碱能系统治疗AD。Su等[37]研究金针菇多糖对东莨菪碱诱导的AD小鼠的影响,结果显示,金针菇多糖能改善AD小鼠学习记忆能力,抑制AchE活性,升高小鼠海马及大脑皮层ACh、BACE1和GSK-3β蛋白表达,降低PP2A蛋白表达,表明金针菇多糖能通过提高连接蛋白36及CaMKⅡ表达,改善AD小鼠学习记忆能力,调节胆碱能神经递质,缓解认知功能障碍。
2.5 清除自由基、抗氧化
在AD 发生发展过程中,Aβ 与氧化应激关系密切[38]。Aβ可通过多种途径产生过氧化物和自由基,从而加剧过氧化作用对神经细胞的损伤[39]。钟芳芳等[40]研究化橘红多糖对Aβ25-35诱导的AD小鼠模型的影响,结果显示,化橘红能改善CA1区神经元损伤和神经细胞凋亡,降低胆碱酯酶、一氧化氮(NO)和Bax含量,抑制NOS活性,升高血清SOD活性,表明化橘红多糖可通过减轻氧化损伤、抑制凋亡起到神经保护作用。
2.6 抗炎症反应
神经炎症是中枢神经系统对退化、感染、创伤和毒素等各种因素的复杂反应,在维持大脑稳态方面发挥重要作用。长时间持续的神经炎症会抑制神经发生,导致突触功能障碍和神经元死亡[41]。Du等[34]研究当归多糖对Aβ25-35诱导的AD大鼠模型的影响,结果显示,当归多糖能增加AD大鼠海马CA1、CA3和DG区神经元数量,抑制白细胞介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-α蛋白表达,促进脑源性神经影响因子(BDNF)、TrkB、p-Art、p-CREB蛋白表达,表明当归多糖能通过激活BDNF/TrkB/CREB通路抑制促炎细胞因子表达,改善AD大鼠记忆损伤。Xu等[42]研究五味子多糖对Aβ1-40诱导的AD大鼠的影响,结果显示,五味子多糖可提高AD大鼠学习记忆能力,减少Aβ1-40沉积,降低海马CA1区IL-1β,IL-6及TNF-α蛋白水平,抑制神经胶质细胞活力、MAPKs通路相关蛋白(p38 MAPK、ERK1/2和JNK)表达和MAPKs磷酸化,改善核因子(NF)-κB核位移,表明五味子多糖能改善小鼠认知能力损伤和组织病理改变,并通过激活NF-κB/MAPK通路减轻神经细胞炎症。Shi等[43]研究益智仁多糖对东莨菪碱诱导的AD小鼠模型和脂多糖诱导的BV2小胶质细胞的影响,结果显示,益智仁多糖能减少AD小鼠血清和小胶质细胞NO、IL-6、TNF-α的含量,表明益智仁多糖能改善AD小鼠记忆学习能力,通过抑制促炎因子表达发挥抗神经炎症作用。
2.7 保护神经细胞和突触
研究表明,Aβ淀粉样蛋白沉积能与Tau蛋白病变协同作用,造成突触缺失、突触功能紊乱和突触可塑性降低等一系列反应,导致神经细胞死亡[44]。Aβ沉积导致的突触功能紊乱和缺失是AD早期发生的主要病理机制。Tau蛋白聚集引起的突触退化是导致AD发生的决定性因素之一[45]。因此,保护神经细胞和突触对防治AD具有重要意义。Zhou等[46]研究枸杞多糖对APP/PS1转基因小鼠的影响,结果显示,枸杞多糖能提高小鼠学习记忆能力,减少成熟淀粉样沉积物(6E10)和神经胶质纤维酸性蛋白含量,降低APP/PS1小鼠皮层与海马中可溶性及不溶性Aβ40和Aβ42水平,降低神经元细胞(SK-N-SH)和AD 模型细胞(HEK293-APPswe)的细胞外Aβ总量,增加BrdU/NeuN双阳性细胞比例,改善海马CA3-CA1区的突触功能障碍,表明枸杞多糖可通过减少Aβ毒性、恢复突触可塑性和增加神经发生等治疗AD。李珍等[47]研究阿里红多糖对APP/APS双基因小鼠的影响,结果显示,阿里红多糖能提高小鼠学习记忆能力,减轻海马神经元水肿,增加神经细胞数量,提高海马中AKT蛋白表达,降低GSK3β、Tau、p-Tau蛋白表达;HE染色结果显示,阿里红多糖能增加神经元数量及体积,结果表明阿里红多糖能改善小鼠学习记忆能力,通过减少海马区神经元纤维缠结修复神经元损伤,减少神经元坏死沉积,保护海马组织结构完整性,发挥治疗AD作用。
2.8 改善能量代谢
脑组织神经细胞能量代谢障碍是AD早期的重要病理特征,可直接导致内质网内环境紊乱,影响炎症及氧化应激病理进程,造成Aβ过量产生和积累。因此,针对能量代谢障碍的干预手段可有效提高AD 疗效。Liu等[35]研究五味子多糖对Aβ25-35诱导的AD大鼠模型影响,结果显示,五味子多糖能改善大鼠学习记忆能力,增加AD大鼠正常神经细胞数量,通过调节硫磺酸代谢降低Aβ表达和p-Tau蛋白表达,降低海马内NOS、GSK-3β和AchE水平,提高SOD活性,降低海马内谷氨酸、天冬氨酸含量,增加5-HT、NE、多巴胺、ACh、Tau、GABA和甘氨酸含量,表明五味子多糖能改善AD大鼠脑内能量代谢,调节神经递质,修复神经损伤,发挥治疗AD作用。
2.9 抑制Tau蛋白过度磷酸化
Tau蛋白过度磷酸化是导致神经纤维缠结的主要原因之一,也是痴呆发病的重要机制[48-49]。李贺等[50]研究北五味子酸性多糖对Aβ25-35诱导的AD大鼠影响,结果显示北五味子多糖能改善小鼠学习记忆能力,降低海马组织p-Tau(Ser199)、Tau(Ser396)及Tau(Ser404)表达,降低GSK-3β(Ser9)、GSK-3β(Tyr216)位点磷酸化及GSK-3β表达,升高p-GSK-3β(Ser9)表达,表明北五味子酸性多糖可通过调节GSK-3β活性,抑制海马组织Tau蛋白多个位点过度磷酸化,改善学习记忆能力,发挥抗AD作用。Zhang等[51]研究平菇多糖对D-gal及AlCl3联合诱导的AD模型大鼠的影响,结果显示平菇多糖能改善模型大鼠学习记忆能力,提高SOD、谷胱甘肽过氧化物酶和过氧化氢酶活性,抑制丙二醛水平和AchE活性,表明平菇多糖能通过促进PP2A 蛋白表达,抑制APP、BACE-1 及GSK-3 蛋白表达,减少Aβ形成和p-Tau蛋白磷酸化,发挥AD治疗作用。
3 小结及展望
中药防治AD潜力巨大,抗AD中药因其低毒性、多靶点、多通路作用等明显优势,是目前的研究热点之一。中药抗AD的有效成分研究目前主要集中在中药单体[52],中药多糖由单糖聚合而成,分子量大,水溶性高,口服能被肠道菌群代谢处理。低分子多糖能直接透过血脑屏障发挥神经保护作用,大分子多糖经酸法、碱法或酶法降解为低分子多糖透过血脑屏障,从而成为AD的治疗药物[53-55]。中药多糖对AD模型的保护作用及其机制见图1。

图1 中药多糖对AD模型的保护作用及分子机制
糖类化合物广泛存在于自然界的植物中,种类繁多,具有多种生物活性[56]。中药是多成分、多靶点起效,中药多糖作为多种中药的主要活性成分并不能全面体现中药药效物质基础。确定中药多糖的构效关系、药理机制对认识中药药效物质基础具有积极作用,更能给传统中药的配伍、炮制等基础性研究带来启发,推动中医药传统用药方法、原则等基础性研究。《黄帝内经》揭示了AD的病因病机,蕴含了以补为主、兼顾调理气血和情志的治疗思想。老年人肾精亏虚,髓海不充,脑失所养,久而髓减脑消发为痴呆,以补肾填精、益髓健脑为主要治法[57]。中药多糖需在中医理论指导下研究使用。目前治疗AD的中药多糖研究主要集中于常见中药材,且多为补益类中药,符合“虚者补之”的治则。
综上所述,中药多糖具有一定的改善学习记忆能力和防治AD作用,并可通过多种机制干预AD发生发展,如减缓Aβ沉积、抑制Tau蛋白过度磷酸化、抑制细胞凋亡、抗炎症、抗氧化应激、改善中枢胆碱能系统、保护神经细胞和突触、改善能量代谢等。目前大部分中药多糖抗AD的研究集中在细胞和动物模型上,还需要大型随机临床试验提供更直接的临床证据,以验证这些多糖对AD患者的神经保护作用。由于生物活性多糖结构复杂,且生物学特性与其化学结构密切相关,即使是同一来源的多糖,其生物活性也存在较大差异[58]。因此在今后的AD及相关疾病研究中,需进一步阐明生物活性多糖的构效关系,深入探索中药多糖抗AD的作用机制,研发新药。
