“化学反应速率与限度”试题思维路径的构建
2023-11-03赵雪孙子秀刘传民
赵雪 孙子秀 刘传民











摘要: 以山东省普通高中学业水平等级考试“化学反应速率与限度”试题为例,基于素养立意下高考及等级考试化学学科的考查特点,针对如何面对复杂的试题情境、如何确定正确的认知角度及如何解读陌生图像信息等问题,梳理并归纳了学生应建构的思维路径,为该主题的教学提供借鉴。
关键词: 高考化学; 化学反应速率与限度; 化学热力学; 化学动力学
文章编号: 1005-6629(2023)09-0087-06 中图分类号: G633.8 文献标识码: B
在探索化学变化本质和规律的过程中,化学学科衍生出两个重要的分支领域——化学热力学和化学動力学。化学热力学重在研究化学变化的方向和限度,化学动力学则重在研究化学反应的速率与机理。普通高中化学课程中“化学反应的方向、限度和速率”主题的内容设计,就是从热力学、动力学两个领域,引导高中学生认识化学变化的本质并初步掌握化学反应的基本原理和研究方法。“化学反应的方向、限度和速率”作为高中化学课程体系中最能体现学科本质的内容之一,在彰显学科思想、弘扬学科价值和展现学科魅力等方面都具有独特的优势。基于此,高考作为高中课程重要的评价方式,一直以来都对上述内容的考查给予充分的重视。可以说,“化学反应的方向、限度和速率”既是高中化学课程的核心主干内容,同时也是高考重点考查的内容,双重加持下,高中化学教学对这部分内容的重视与投入程度不可谓不大。然而,从实测情况来看,“化学反应速率与限度”试题往往是高考试题中对学生挑战最大的试题。很多学生在考场上没有思路、无从下手,然而一经讲解后却又感觉恍然大悟。这种现象说明学生尽管掌握了该主题的基础知识,但在面对真实且具有一定复杂程度的试题情境时,往往不能将情境信息与所学知识建立联系,也就谈不上运用知识解决问题了。面对“化学反应速率与限度”试题,正确的思维路径是什么?本文以山东省等级考试化学试题为例,对此进行了梳理和归纳。
1 基于试题情境,提炼反应模型
为落实课程标准“以真实情境为测试载体”的命题原则,高考试题越来越重视情境在试题设计中的作用,追求在真实的特定情境中融入测试任务来考查学生解决实际问题的能力。因此,在当下的“化学反应速率与限度”试题中,以往常见的“A+B
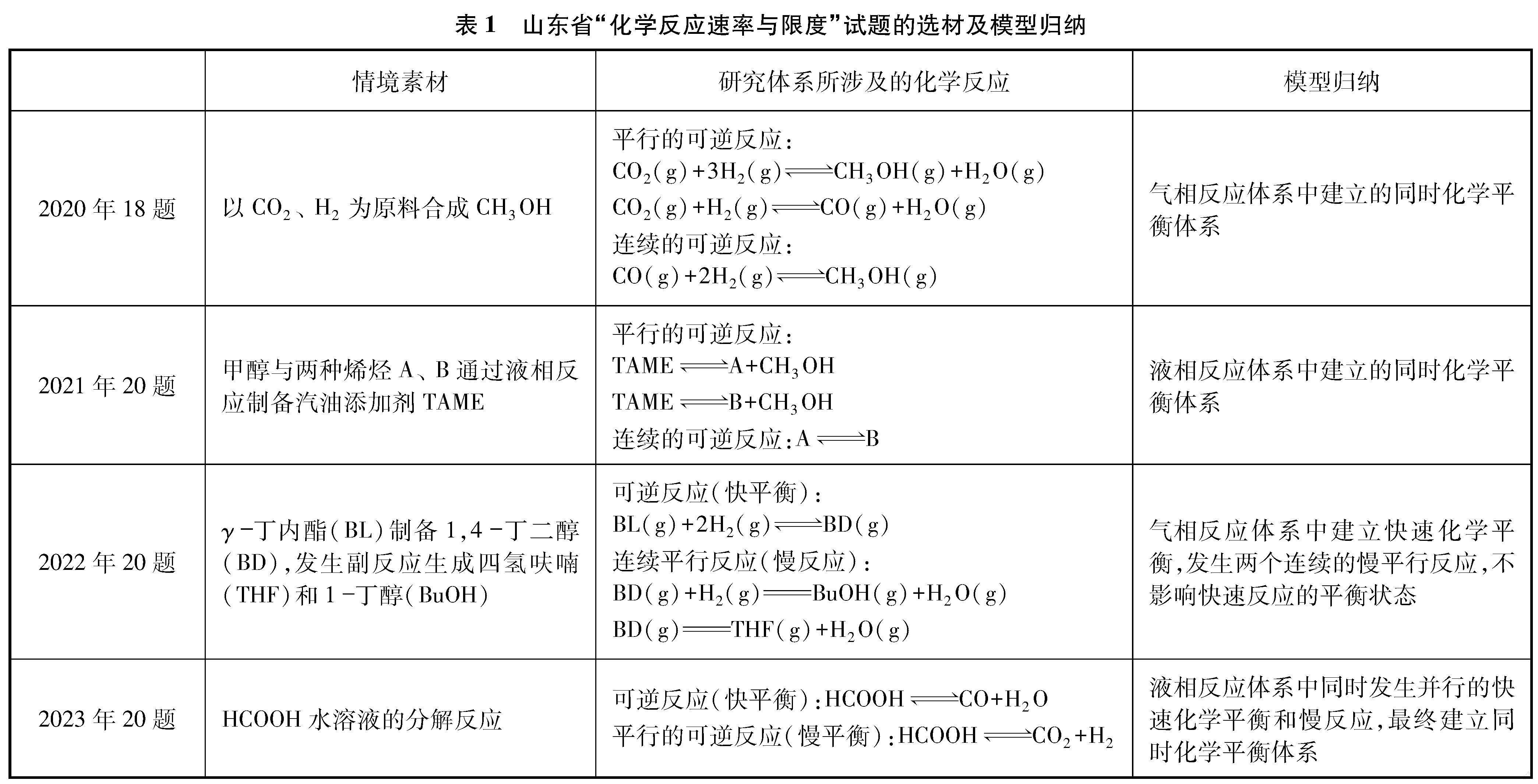
C+D”式的无情境试题已难觅踪迹,取而代之的是体现学科前沿成果的“学术探索情境”及再现工业生产过程的“生产环保情境”[1]。在价值取向上,这些情境首先应是“真实的”和“科学的”,而不是来自命题人的杜撰与想象。真实情境往往会具有一定的复杂程度,这也使试题在塑造情境时从之前常见的仅涉及一个可逆反应的简单平衡体系转变为涉及多个反应的更为复杂的平衡体系[2]。分析近年来山东省等级考试试题的情境选材,这一变化趋势有着清晰的表现(见表1)。
情境的真实性带来了复杂度的提升,使研究体系所涉及的化学反应看起来错综复杂而没有头绪,但如果剥去情境的“外衣”,就会发现“化学反应速率与限度”试题的考查体系中一定会包括至少一个可逆反应,如果将该反应视为主要研究对象,那么其他反应与该反应之间的关系则分为两种,或为连续反应,或为存在竞争关系的平行反应。以此为基础,再根据试题信息分析其他反应是否同为可逆反应,它们对主要研究对象的化学平衡会产生何种影响,就可以梳理并归纳出最终的反应关系模型。以2021年试题为例,题目以利用甲醇与烯烃制备汽油添加剂2-甲氧基-2-甲基丁烷(TAME)为情境,构建了三个平行的可逆反应:
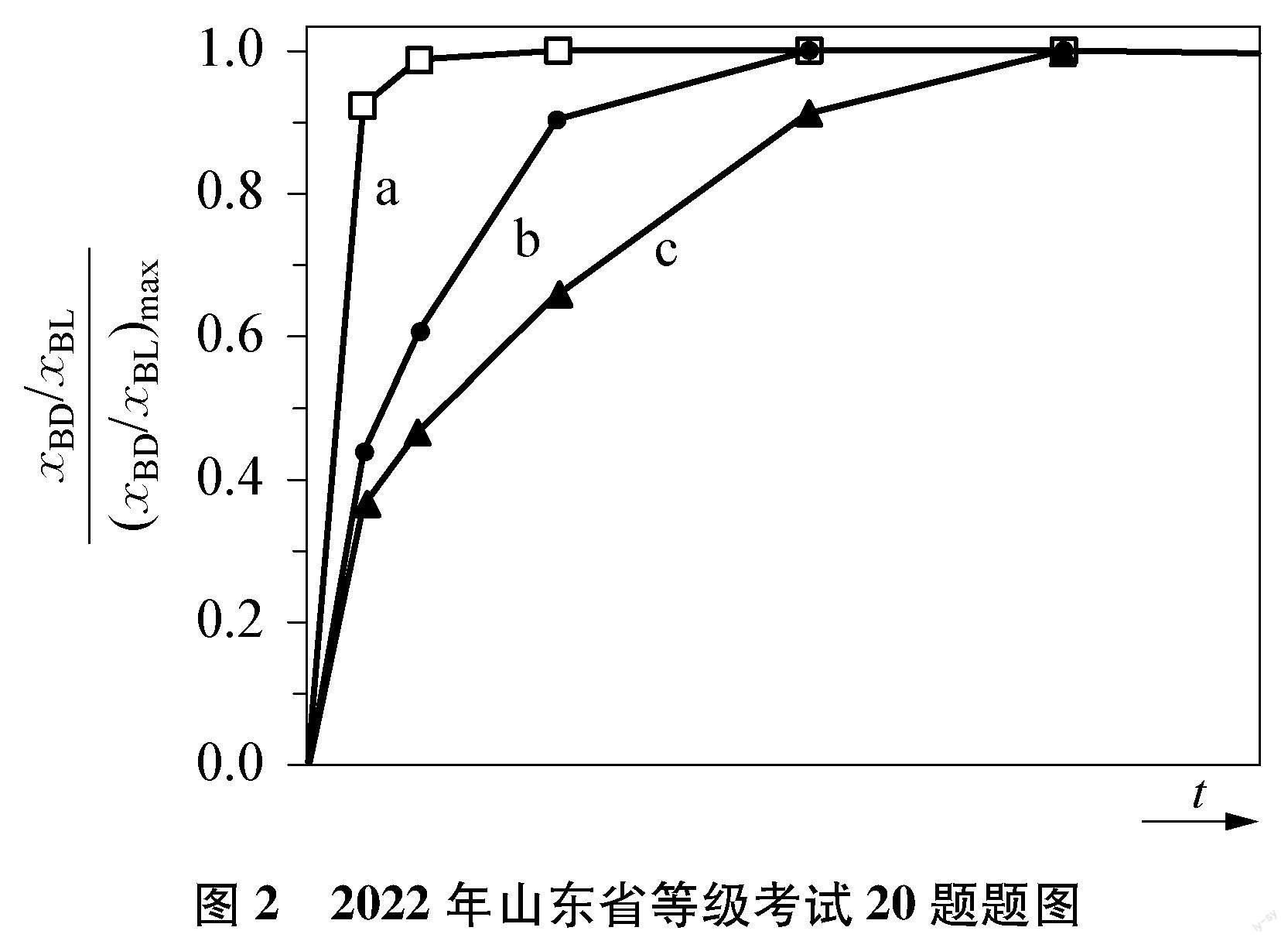
分析三个反应的关系特点,反应体系最终达到同时化学平衡状态,且反应Ⅰ-反应Ⅱ=反应Ⅲ,所以三个反应并非独立的化学平衡,只要有两个反应处于平衡状态,则另一反应也必然处于平衡状态。明确了三个反应的关系,学生在面对不同问题时就能确定需要研究的对象究竟是哪个反应,明确解题线索。在2022年的试题中,题目在以γ-丁内酯(BL)制备1,4-丁二醇(BD)为核心反应的基础上,增加了两个非可逆的BD转化为四氢呋喃(THF)和1-丁醇(BuOH)的平行副反应,设计了快速平衡+慢反应(非可逆)这一较少在高考试题中出现的连串反应模型:
学生要分析反应Ⅰ与反应Ⅱ、 Ⅲ间的关系,明确讨论平衡问题时的研究对象是处于动态平衡状态的反应Ⅰ,而非两个根本不存在平衡状态的副反应。
2 明确认知角度,抓住核心线索
基于试题情境分析不同反应间的关系,基于研究体系提炼模型,这只是建构“化学反应速率与限度”试题思维路径中的第一步,其目的是基于模型明确分析问题所要采用的认知角度,即从动力学或热力学角度选择分析问题的方法[3]。
研究发现,在反应Ⅰ、 Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
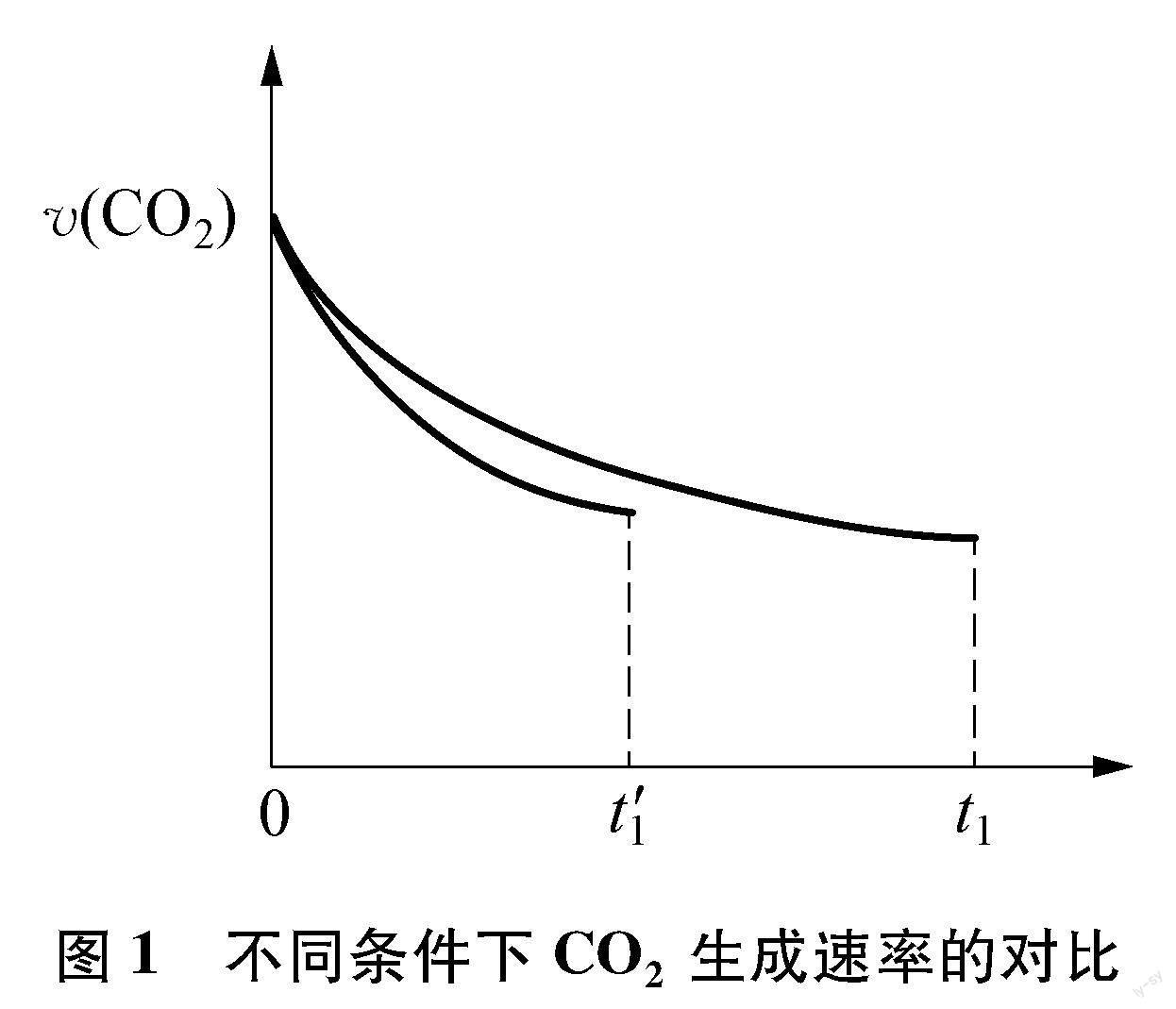
相同条件下,若反应起始时溶液中同时还含有0.10mol·L-1盐酸,则图示点a, b, c, d中,CO新的浓度峰值点可能是 (填标号)。与不含盐酸相比,CO达浓度峰值时,CO2浓度 (填“增大”“减小”或“不变”)。
基于三段式对t1时刻各物质的浓度进行计算,H2O的浓度值为常数c0:
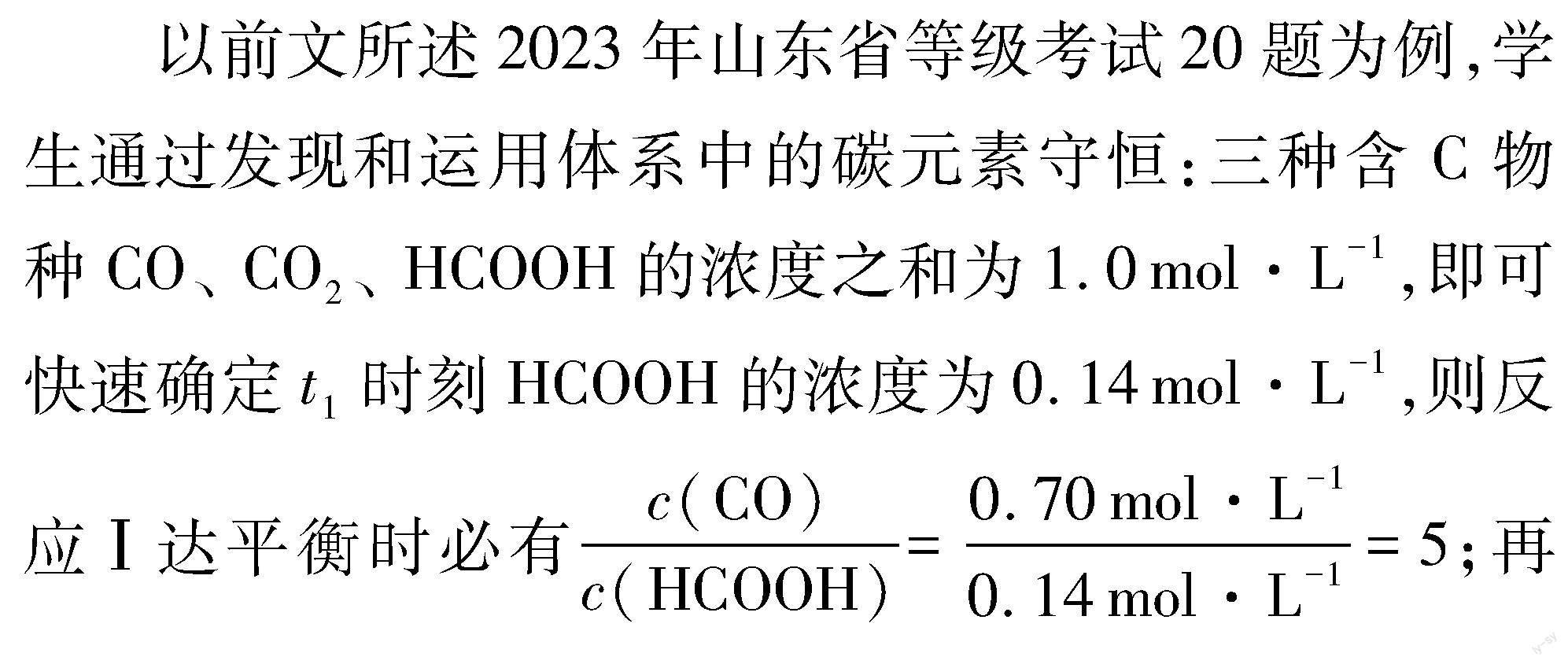
后续“相同条件下,若反应起始时溶液中同时还含有0.10mol·L-1盐酸”的两个问题,实质是在考查当有盐酸时,反应Ⅰ初达平衡状态时,CO、 CO2的浓度变化情况。尽管反应Ⅰ平衡常数不变及CO、 HCOOH浓度比均不变,但考察CO、 CO2的浓度,显然与反应Ⅰ、 Ⅱ中二者的生成速率有关,于是分析问题的角度就要转变为动力学角度了。从反应速率不受盐酸影响的反应Ⅱ入手考察CO2的浓度,对于CO新的浓度峰值时刻,反应Ⅱ进行的时间是减少的,那么每一时刻的瞬时生成速率呢?随着CO生成速率增大,相同时刻进行对比,加入盐酸时每个时刻对应HCOOH的浓度都是减小的,这就意味着每一个对应时刻CO2的生成速率都是降低的,由此可得到CO2浓度减小的结论。图1所示为0~t′1时间段内CO2生成速率υ(CO2)变化情况示意图,0~t′1、 0~t1曲线下相应面积即可代表CO2的浓度变化值。CO2浓度减小,则CO与HCOOH的总浓度增大,结合CO、 HCOOH浓度比仍为5的结论,不难判断新的浓度峰值点应为题中“a”点。
总之,基于试题体系提炼模型只是应对“化学反应速率与限度”问题的第一步,关键还在于考察模型特点后建构处理各种反应时所应采取的认知角度,只有明确了分析问题所应采取的理论方法,才能够有的放矢、从容解决问题。
3 破解图像信息,厘清问题本质
在“化学反应速率与限度”试题中,很多数据事实是以图像的形式加以呈现的,能否快速准确获取图像中的信息、建立图像信息与要解决问题间的内在联系是实现思维突破的重要一环。随着学术探索情境在高考“化学反应速率与限度”试题中使用的增加,图像的陌生度、信息量均有所提升,但无论图像如何呈现,考查的角度不变——仍然是控制变量研究外部条件对反应速率、限度的影响。那么如何从多变的图像中提取出有用的信息,又如何使用这些信息呢?笔者以为,一是要厘清图像中相关变量的意义,读懂图像找到解决问题的“工具”;二是要明确问题的本质是热力学还是动力学问题,进而确定解决问题时所选用的“工具”。
3.1 读懂图像,明确图像中变量的化学意义
3.2 厘清问题本质,正确调用认知角度
读懂图像只是找到了解决问题可能用到的证据,从何种角度运用证据,还需要学生厘清问题的本质是热力学问题还是动力学问题,如此才能有的放矢地使用证据。以2021年山东省等级考试20题为例:
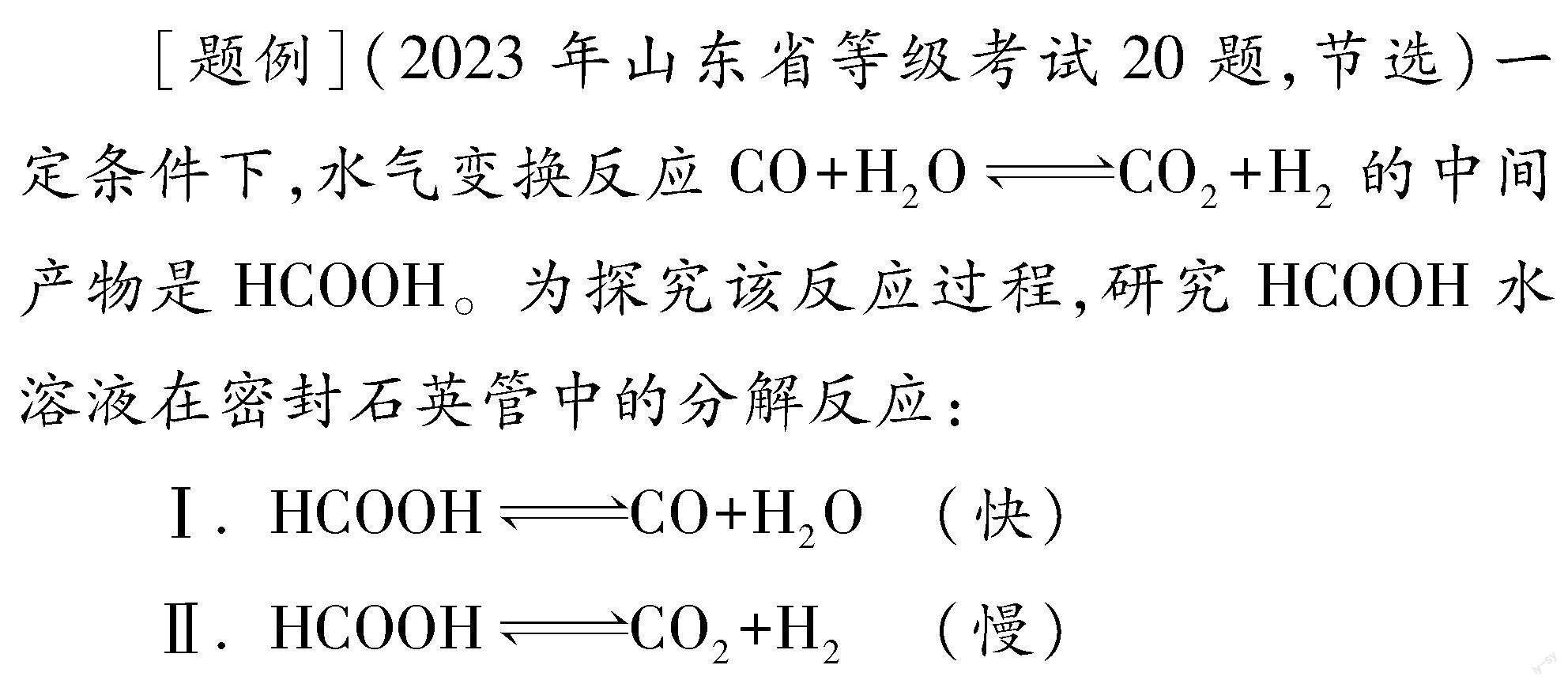
[题例](2021年山东省等级考试20题,节选)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、 B和CH3OH。控制温度为353K,A、 B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为 (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率υ正 逆反应速率υ逆(填“>”“<”或“=”)。
前文已述,本题的研究体系是包括反应Ⅰ、 Ⅱ、 Ⅲ在内的同时平衡体系,现在图像给出了反应Ⅲ反应物和生成物的浓度变化曲线,并针对某个未达平衡的时刻提出了“t=100s时,反应Ⅲ的正反应速率υ正 逆反应速率υ逆”的问题,速率问题貌似应该属于动力学范畴,能否通过作曲线切线比较斜率来解释呢?这样思考的学生显然是没有抓住问题的本质,图中纵坐标表示的是A、 B两种物质的浓度变化情况,但这种浓度变化是由反应Ⅰ、 Ⅱ、 Ⅲ共同导致的,并不能直接代表反应Ⅲ的正、逆反应速率。动力学的角度行不通,就要考虑热力学角度,平衡常数的线索作用就此再次体现出来,通过比较Q与K的相对大小即可判断反应Ⅲ进行的方向,那自然也就可以实现反应Ⅲ正、逆反应速率大小的比较了。
4 运用化学规律,简化复杂问题
列“三段式”是解决“化学反应速率与限度”中定量问题的基础方法,但如能抓住体系相关化学反应的特征,灵活运用物料守恒关系,将复杂体系进行分解和简化,会在极大程度上省时省力地解决问题。
目前高考“化学反应速率与限度”试题所涉及的平衡体系通常是在确定温度、压力下的单相体系,对于这样的平衡体系,要完全确定其平衡组成所需的最少物种数可根据独立组分数K的计算公式加以确定,即K=S-R-R′。其中,S为平衡体系涉及的物种数,R为独立的化学平衡数,R′则为独立的浓度限制关系。换言之,在平衡常数确定的情况下,只要知道S-R-R′个物种的浓度,平衡体系的组成就可以完全确定,而每隐去一个反应的平衡常数,则需要增加一个浓度已知条件。在高考试题当中,通常是不会出现冗余条件的,那么对于一个给定体系,能否发现并运用浓度限制关系R′就成为快速确定平衡体系组成的“捷径”。高中阶段“化学反应速率与限度”主题中物料守恒关系的发现和运用,本质上就是要寻找并利用浓度限制关系R′以快速破解平衡体系的组成,从而对物质浓度、化学平衡常数等进行定量确定。
“化学反应速率与限度”主题学习的目标是引导学生探索纷繁化学反应背后的本质和规律,学习如何根据这些规律控制和利用化学反应。基于这种学科价值,高考试题围绕真实、多样的反应体系,力求实现在“化学反应速率与限度”试题中考查学生解决复杂情境中实际问题的能力[6]。面对较高的考查要求,教学中不可能一蹴而就。广大教师可基于学生认识发展的层次,首先借助单一化的理想体系帮助学生建立对平衡概念和变化规律的认识,学習解决一些简单的无情境问题。然后纳入时间变量,突出强化平衡常数的线索作用,引导学生学习从速率与平衡两方面分析问题。最终引导学生解析实际生产工艺的复杂体系,提炼模型、抓住本质,综合动力学、热力学两个角度,运用好能量守恒与物料守恒等化学规律,形成证据推理、模型建构、宏观辨识、微观辨析的学科高阶思维品质。
参考文献:
[1]程力, 史辰羲. 高中学业水平考试标准制定的实施路径[J]. 课程·教材·教法, 2019, (7): 84~88.
[2]陈爱民, 杨玉琴. “化学反应速率与限度”高考试题特征分析及启示——基于二十年全国1卷的研究[J]. 化学教学, 2022, (5): 89~94.
[3]吴晗清, 李丹, 赵冬青. “速率”和“平衡”教学亟待澄清的误区[J]. 化学教学, 2017, (3): 21~25.
[4]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 129.
[5]张霄, 董素静. 中学化学教学中平衡常数的价值和意义的分析[J]. 化学教育, 2016, (11): 28~31.
[6]赵雪, 卢巍, 逢金满. 高中“化学反应原理”习题命制应注意的几个问题[J]. 化学教学, 2021, (9): 82~86.
