我国部分地区2021 年产大米中稻曲菌素污染情况调查
2023-11-02蔡亚玲张志岐聂冬霞
范 楷,蔡亚玲,胡 政,刘 星,张志岐,聂冬霞,韩 铮
上海市农业科学院农产品质量标准与检测技术研究所,上海 201403
稻曲病是由稻绿核菌(Ustilaginoidea virens(Cke.) Takahashi)侵染水稻穗部引起的一种世界性真菌病害[1]。近年来,随着水稻品种的更替、施肥水平的提高以及气候的变化,稻曲病日趋严重,已成为我国水稻生产过程中的主要病害[2]。稻曲病不仅会引起水稻减产,品质降低,更严重的是,其病原菌产生的有毒次级代谢产物——稻曲菌素可以在稻米中聚集,进而通过食物链威胁人畜健康。
稻曲菌素属于环肽类真菌毒素,具有很强的细胞毒性,能够干扰真核生物微管蛋白的组装与细胞骨架形成,抑制细胞有丝分裂,引发动物器官病变、生长异常、代谢紊乱甚至死亡[3-4]。目前,已发现的稻曲菌素共有6 种(稻曲菌素A、B、C、D、F 和G)。其中稻曲菌素A 和B 最为常见,占稻曲菌素总含量的90%左右[5],毒性也最大[6-8];稻曲菌素G 是近年来新分离得到的一种稻曲菌素,被证实具有和稻曲菌素A 类似的细胞毒性[9]。因此,对稻米中的稻曲菌素进行监测对于保障食品安全和大众健康具有十分重要的意义。
目前,稻米中稻曲菌素的分析方法可分为免疫法和色谱法两类。免疫方法中,酶联免疫吸附测定法和侧流免疫测定法等,往往只适用于一种或两种稻曲菌素的定性或定量分析,且结果可能存在假阳性,不能满足实际检测、监管的需要[10-12]。相比较而言,色谱法具有更高的灵敏度和更好的选择性,被广泛应用于农产品的各类真菌毒素的筛查中[13-14]。在稻曲菌素方面,虽然也有液相色谱和液相串联质谱等分析方法的报道[15-17],但这些方法主要聚焦于稻曲菌素A 和B 的测定,未见稻曲菌素G 的精准检测技术,很少应用于稻米的大样本筛查,不能全面反映我国稻米中稻曲菌素的实际污染情况。
本研究基于固相萃取净化方法,建立了大米中稻曲菌素A,B 和G 的超高效液相色谱-串联质谱(Ultra -performance liquid chromatography -tandem masss pectrometry,UPLC-MS/MS)检测方法,并运用此方法对我国部分水稻产区(安徽、广东、黑龙江、湖北、湖南、江苏、江西、上海、四川和浙江)2021 年产大米中稻曲菌素的污染状况进行测定和分析,为稻曲菌素的风险评估、安全预警及监管防控提供基础数据,为保障食品安全和大众身体健康以及相关标准、政策等的制(修)订提供参考依据。
1 材料与方法
1.1 仪器与试剂
仪器:UPLC XEVO TQ-S 超高效液相色谱-串联质谱联用仪(美国Waters 公司);5804R 离心机(德国Eppendorf 公司);HSC-24B 氮吹仪(上海楚定分析仪器有限公司);Millipore-Elix-QE-QG 超纯水仪(Millipore 公司);AL104 分析天平(美国梅特勒-托利多仪器有限公司);SK8210LHC 超声波清洗机(上海超声仪器有限公司);BJ-800A 食品粉碎机(杭州德清拜杰电器有限公司)。
试剂:甲醇、乙腈、甲酸、醋酸铵(色谱纯,德国Merck 公司);HLB 固相萃取柱(200 mg,60 μm;苏州纳谱分析技术有限公司);稻曲菌素A、B 和G 标准品(纯度>90%)由稻曲球中分离制备所得[9,18]。
1.2 试验材料
2021 年10—11 月在我国部分大米产区(安徽、广东、黑龙江、湖北、湖南、江苏、江西、上海、四川和浙江)采集大米样品318 份。为保证采集样品的代表性,分别从每个省(市)选择3~5 个分采样点,每个分采样点所辖水稻种植区的稻田多点采集成熟稻穗约1 kg,晾干后砻谷机脱壳、精米机加工,所得大米用塑料自封袋装存、标记后,运输至上海市农业科学院农产品质量标准与检测技术研究所进行分析。实验室接收后,将大米样品充分混合、粉碎后过20目筛,按四分法分成4 份,随机抽取一份制备,其余作为留样,于-20 ℃保存。
1.3 稻曲菌素的测定
1.3.1 样品前处理
准确称取1 g 样品(准确到0.01 g)于50 mL 离心管中,加入10 mL 水浸泡5 min,涡旋1 min,室温超声提取10 min,5 000 r/min 离心5 min。取1 mL上清液,过预先用2 mL 甲醇和2 mL 含0.5%甲酸的5 mmol/L 乙酸铵溶液活化过的HLB 柱,2 mL 含0.5%甲酸的5 mM 乙酸铵溶液淋洗,然后用2 mL 甲醇水(25∶75,V/V)溶液洗脱,收集洗脱液,在45 °C下氮气吹干。用1 mL 含5%乙腈的5 mmol/L 乙酸铵溶液溶解残渣,涡旋震荡30 s,经0.22 μm 滤膜过滤后,借助UPLC-MS/MS 测定。
1.3.2 UPLC-MS/MS 检测
色谱条件:Waters XBridge BEH C18(100 mm ×3.0 mm,2.5 μm);流动相:A 相为乙腈溶液,B 相为0.1%甲酸水溶液;梯度洗脱:0~3.75 min,5% A~20%A;3.75~6.5 min,20% A~100% A;6.5~8 min,100%A;8~8.01 min,100% A~5% A;8.01~10 min,5% A;流速为0.4 mL/min;进样量8 μL;柱温40 °C。
质谱条件:采用电喷雾电离源(Electron spray ionization,ESI)正离子模式扫描,脱溶剂气、锥孔气均为高纯氮气,碰撞气为高纯氩气,脱溶剂温度为500 °C,离子源温度为150 °C,通过多反应监测(Multiple reaction monitoring,MRM)模式对目标化合物准确定量。3 种稻曲菌素质谱测定参数见表1。图1 是3 种稻曲菌素在标准溶液中的MRM 图谱。
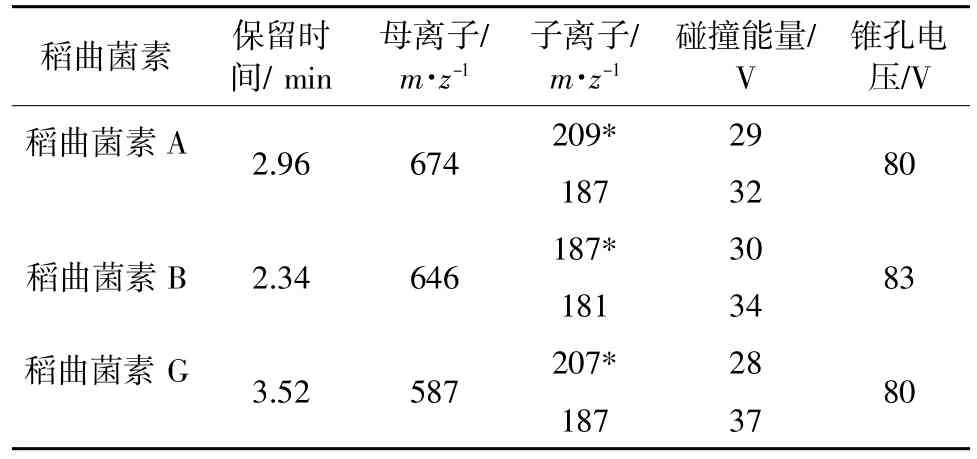
表1 稻曲菌素A、B 和G 的质谱测定参数
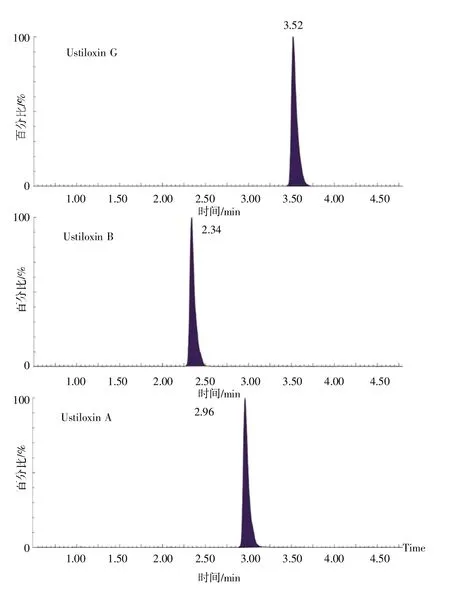
图1 标准溶液中3 种稻曲菌素(50 μg/L)的MRM图谱
1.4 方法学验证
分别通过考察线性、检出限(Limit of detection,LOD)和定量限(Limit of quantitation,LOQ)、回收率和精密度来评价所建立的分析方法。分别称取适量稻曲菌素标准品,用纯水配制质量浓度为1 mg/L 的标准工作液。以不含稻曲菌素的大米为空白样品,通过前处理后得到空白基质溶液,稀释标准工作液获得0.05、0.1、0.2、0.5、1、2、5、10、20 和50 μg/L 的基质标准溶液,以稻曲菌素溶度为横坐标、峰面积为纵坐标,建立3 种稻曲菌素的基质匹配标准曲线并用于浓度测定。为评价基质效应,采用基质匹配标准曲线斜率与溶剂标准曲线斜率的比值计算稻曲菌素在大米中的信号增强或抑制程度(Signal suppression/enhancement,SSE)[19]。SSE 值在80%~120%之间表明基质效应影响不大;当其高于120%时,表明基质增强效应;当其低于80%时,表明基质抑制效应。以定性离子通道的3 倍信噪比确定目标毒素的LOD、定量离子通道的10 倍信噪比确定目标毒素的LOQ。采用加标回收试验法考察回收率。选取空白大米样品,分别按照添加质量分数10、20和100 μg/kg 加入适量的稻曲菌素标准工作液,每个浓度选取5 个平行样。经样品前处理后,通过UPLC-MS/MS 分析,回收率为测定值和理论值的百分比。日内精密度和日间精密度分别为同1 d 平行测定5 个样品,以及连续5 d 测定结果的相对标准偏差(Relative standard deviation,RSD)。
1.5 数据处理和分析
采用Excel 和SPSS 22.0 对大米样品中稻曲菌素的污染水平进行统计分析。计算毒素含量均值和进行统计分析时,仅考虑阳性样本(稻曲菌素含量高于LOD)。采用卡方检验对不同地区大米中稻曲菌素的检出率进行比较,采用单因素方差分析对不同地区大米中稻曲菌素的浓度水平进行比较,采用Spearman 相关对3 种稻曲菌素含量间的相关性进行分析。
2 结果与讨论
2.1 稻曲菌素含量测定的方法学验证
表2 可见,稻曲菌素A 和B 在大米基质中的SSE 分别为47.6%和25.7%,表现出较强的基质效应,仅稻曲菌素G 的基质效应影响不大(85.1%)。因此,为保证稻曲菌素含量测定的准确性,本研究采取基质匹配标准曲线对其进行定量。试验结果表明,3种稻曲菌素的基质匹配标准曲线在各自浓度范围内的线性关系良好,决定系数R2均大于0.990(表2)。稻曲菌素A 的LOD 为0.8 μg/kg,LOQ 为2 μg/kg;稻曲菌素B 和G 的LOD 均为0.5 μg/kg,LOQ 均为1 μg/kg。加标回收试验结果表明,3 种稻曲菌素的平均回收率范围为83.4%~105.2%,日内精密度范围为2.1%~8.2%,日间精密度范围为1.8%~11.3%(表3)。以上数据表明,本研究所建立的分析方法灵敏、准确、可靠,可用于大米中3 种稻曲菌素污染水平的精准测定。
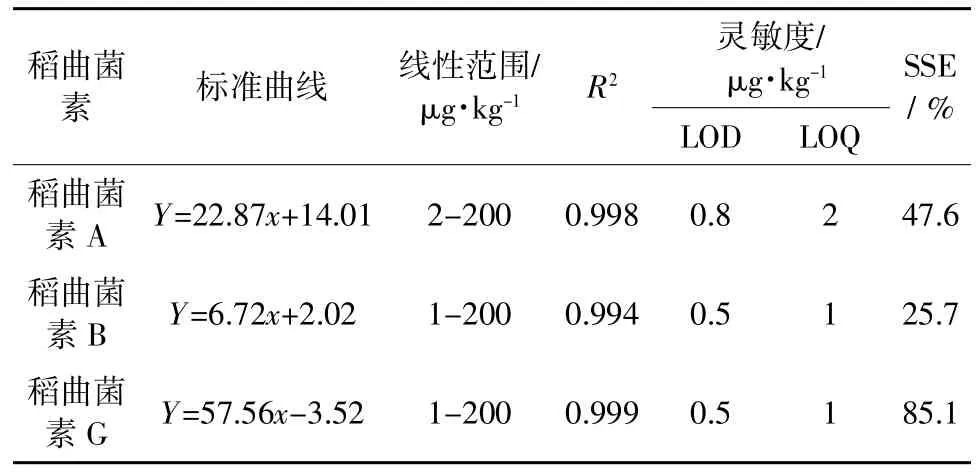
表2 大米中3 种稻曲菌素的标准曲线与灵敏度

表3 大米中3 种稻曲菌素的回收率及精密度(n=5)
2.2 大米中稻曲菌素的总体污染水平
采用本文所建立的检测方法对我国不同地区大米样品中的稻曲菌素污染情况进行分析。如表4 所示,318 份大米样品中共有123 份检出稻曲菌素,总检出率为38.68%。其中稻曲菌素A 污染较为严重,检出率为30.19%,平均质量分数为3.21 μg/kg;其次为稻曲菌素B,检出率为21.38%,平均质量分数为1.16 μg/kg;稻曲菌素G 的检出率为7.86%,平均质量分数为0.88 μg/kg。

表4 我国部分地区2021 年大米样品中3 种稻曲菌素污染状况
目前,稻米中稻曲菌素A 和B 的污染水平仅有少量报道。2012 年,江苏省的10 份稻谷样本中,稻曲菌素A 的检出率为70%,质量分数范围为76~4 036 μg/kg[20];2016 年,浙江省的10 份大米样本中,分别有6 份和5 份样本检出稻曲菌素A 和B,质量分数分别为5.5~273.8 μg/kg 和2.7~88.7 μg/kg[17];2019 年,全国219 份大米样本中,稻曲菌素A 和B的总检出率为91.3%,质量分数范围为 此外,本研究首次报道了大米中稻曲菌素G 的污染情况。尽管污染水平不高,但稻曲菌素G 的含量与稻曲菌素A(r=0.495,P=0.027)和稻曲菌素B(r=0.479,P=0.038)均表现出显著相关性。因此,在稻曲菌素的监测中,稻曲菌素G 同样不容忽视。 对不同地区大米中稻曲菌素的检出率和浓度水平进行比较分析(表4,图2)。江西省样品中,稻曲菌素A 和B 的检出较高,检出率分别为44.44%和33.33%,湖南省样品中,稻曲菌素G 检出最高,达到17.02%。而江苏省样品中,稻曲菌素检出较低,3 种毒素的检出率分别为16.67%、11.90%和7.14%。各地区间大米样品中,稻曲菌素的检出率无显著差异(P>0.05)。污染浓度方面,四川省样品中,稻曲菌素A 的浓度最高,达到6.04 μg/kg,显著高于上海市样品(2.07 μg/kg)(P=0.043),其余各地区间污染水平无明显差异(P>0.05)。稻曲菌素B 也是四川省样品中含量最高的(2.47 μg/kg),显著高于湖北(0.86 μg/kg)、湖南(1.00 μg/kg)和上海(0.92 μg/kg)等地区(P<0.05);不同地区大米样品中稻曲菌素G 的污染浓度无明显差异(P>0.05)。大米中稻曲菌素的污染水平与水稻生长环境、气候条件、采样时间和加工方式等多种因素有关。考虑到本研究分布到各地区的样本量仍然偏少,并不能完全代表各地实际的污染情况,今后需继续加强大样本,大范围的长期、连续监测,进一步全面了解我国大米样品中稻曲菌素的污染状况。 图2 不同地区大米样品中稻曲菌素的污染水平 本研究建立了大米中稻曲菌素A、B 和G 的UPLC-MS/MS 检测方法,调查了我国部分大米产区(安徽、广东、黑龙江、湖北、湖南、江苏、江西、上海、四川和浙江)2021 年产大米中稻曲菌素的污染情况。结果显示,不同地区大米样品普遍受到稻曲菌素的污染,其中稻曲菌素A 检出较多,但总体的污染程度较轻。在后续工作中,需继续加强对稻曲菌素的日常监测,同时开展稻曲菌素的毒理研究、代谢和危害评价等工作,对居民日常暴露稻曲菌素的健康风险作出准确、科学的判断,为相关政策、限量标准的制(修)订提供科学依据,为稻米质量安全保驾护航。2.3 不同地区大米样品中稻曲菌素污染水平的比较

3 结语
