短链脂肪酸对抗生素相关性腹泻的作用及机制研究
2023-11-02谷翠红黄姝怡王丽红张志华
林 丽, 谷翠红, 王 硕, 黄姝怡, 王丽红, 张志华
(1. 承德医学院附属医院 血液内科, 河北 承德, 067000;2. 河北医科大学第二医院 血液内科, 河北 石家庄, 050000)
血液肿瘤为起源于造血系统的恶性疾病的总称,包括白血病、淋巴瘤、多发性骨髓瘤及骨髓增殖性疾病等。近年来,随着放化疗、靶向治疗、细胞免疫治疗及造血干细胞移植等方法的应用,血液肿瘤患者的预后大大改善[1]。但放化疗可引发中性粒细胞减少,免疫抑制剂靶向药物相关的T淋巴细胞和B淋巴细胞功能异常等大大升高患者感染率,严重影响预后。针对血液肿瘤合并感染情况,广谱抗生素为首选的治疗手段[2]。抗生素相关性腹泻(AAD)是广谱抗生素治疗血液肿瘤感染的主要并发症,发生率近40%,常伴有肠道菌群及代谢物的变化[3]。目前, AAD尚无理想的治疗药物,临床一般采用支持治疗、益生菌制剂及粪便移植治疗等重建肠道微生态平衡,但疗效有限且具有潜在的副作用[4]。
研究[5]表明,发生AAD时,肠道菌群变化使得代谢物如短链脂肪酸(SCFAs)的含量明显下降。SCFAs作为肠道厌氧菌发酵抗性淀粉及膳食纤维等产生的主要代谢物,主要包括乙酸、丙酸、丁酸(三者比例为3∶1∶1)[6], 不仅可作为肠上皮细胞能量代谢的底物,还可参与维持肠道屏障功能完整性及免疫应答功能。多项研究[7-8]显示,应用天然化合物及其成分干预AAD, 可通过增加产SCFAs菌的丰度而增强肠黏膜屏障功能,减轻肠黏膜损伤,但肠道补充SCFAs对AAD的疗效尚未明确。本研究观察肠道补充SCFAs对AAD大鼠体质量、结肠长度、脾脏指数、肠道菌群、肠黏膜组织炎症因子水平及结构的影响效果,探讨SCFAs对AAD肠道损伤的作用机制,以期为血液肿瘤合并AAD的临床治疗提供参考。
1 材料与方法
1.1 药物和试剂
盐酸林可霉素注射液(华北制药股份有限公司,国药准字H3020455), 乙酸钠盐、丙酸钠盐(美国Sigma公司),丁酸钠盐(阿拉丁)。
1.2 实验动物
无特定病原体(SPF)级6周龄SD大鼠24只,雌雄各半,体质量230~250 g, 购自北京维通利华实验动物有限公司,合格证号为SYXK(京)2022-0052。大鼠饲养于承德医学院附属医院动物实验中心SPF级实验动物房,室温20~22 ℃, 12 h黑暗与12 h光照循环。饲养使用标准鼠饲料和水,所有动物实验按照承德医学院附属医院动物伦理委员会相关规定进行。
1.3 方法
1.3.1 AAD大鼠模型制备及分组: 将大鼠适应性饲养7 d, 灌胃3.0 g/(kg·d)林可霉素注射液,连续7 d。实验过程中每天观察大鼠精神状态、体毛、饮食、活动度、体质量、粪便状况及尾部肛口洁净程度等,出现软便、稀便或黏液视为AAD大鼠模型制备成功。将制备成功的18只AAD大鼠按照随机数字表法分为AAD组、低剂量SCFAs组、高剂量SCFAs组,另将正常大鼠(每天灌胃生理盐水)设为对照组,每组6只。对照组、AAD组均灌胃生理盐水10 mL/(kg·d), 低剂量SCFAs组、高剂量SCFAs组分别灌胃100、150 mg/(kg·d)乙酸+丙酸+丁酸混合液(乙酸∶丙酸∶丁酸比例为3∶1∶1), 所有组别连续灌胃15 d。
1.3.2 结肠长度测量和脾脏指数计算: 末次给药后30 min, 安乐处死大鼠,取各组大鼠结肠和脾脏,用直尺测量结肠的自然长度; 用滤纸吸干脾脏表面残血后称质量,脾脏指数=脾脏质量(mg)/体质量(g)×10。
1.3.3 结肠组织病理学观察: 取部分病变结肠组织置于4%多聚甲醛中固定、脱水、包埋、切片、脱蜡,行苏木精-伊红(HE)染色,二甲苯透明,中性树脂封片,于显微镜下拍照观察。
1.3.4 结肠组织炎症因子水平检测: 采用实时荧光定量聚合酶链反应(RT-qPCR)检测结肠组织炎症因子白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)水平,取部分病变结肠组织,以Trizol法提取各组结肠组织总RNA, 将RNA逆转录为cDNA, 随后进行qPCR, 反应所需引物序列见表1, 采用2-△△Ct法进行mRNA相对表达量分析。

表1 RT-qPCR引物序列
1.3.5 结肠杯状细胞观察: 取部分病变结肠组织,脱蜡前步骤同“1.3.3”, 经阿利新蓝染液浸染、PAS氧化剂氧化、Schiff染色液浸染,苏木精染色液染核,酸性分化液分化,Scott蓝化液返蓝,逐级常规乙醇脱水,二甲苯透明后以中性树胶封固,于镜下观察结肠杯状细胞。
1.3.6 结肠内容物革兰染色: 取各组大鼠结肠内容物直接涂片,自然干燥,进行革兰染色。
1.4 统计学分析

2 结 果
2.1 各组大鼠精神活动状况、体质量比较
对照组大鼠活泼好动,毛发有光泽,二便正常,饮水和进食正常; AAD组大鼠行动迟缓,毛发粗糙,有轻微脱毛现象,体质量增长缓慢,饮水量增加,进食量减少,粪便稀软,不成形,呈烂泥状; 低剂量SCFAs组、高剂量SCFAs组大鼠活动较少,毛发略有光泽,进食较少,体质量增长,饮水量正常,偶见软便。
给药15 d时,与对照组比较, AAD组大鼠体质量降低,差异有统计学意义(P<0.05); 与AAD组比较,低剂量SCFAs组、高剂量SCFAs组大鼠体质量均增加,且呈剂量依赖性趋势,差异有统计学意义(P<0.05), 见表2。
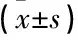
表2 各组大鼠体质量比较 g
2.2 各组大鼠结肠长度、脾脏指数比较
与对照组比较, AAD组大鼠结肠长度减少,脾脏指数增加,差异有统计学意义(P<0.05); 与AAD组比较,低剂量SCFAs组、高剂量SCFAs组大鼠结肠长度增加,脾脏指数降低,且呈剂量依赖性趋势,差异有统计学意义(P<0.05), 见表3。
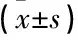
表3 各组大鼠结肠长度、脾脏指数比较
2.3 各组大鼠结肠组织病理学比较
对照组: 黏膜上皮结构完整,肠腺丰富,排列紧密,形态正常,固有层少量炎性细胞浸润,未见其他明显异常; AAD组: 肠腺排列疏松,黏膜固有层内较多炎性细胞浸润; 低剂量SCFAs组: 少量黏膜上皮细胞脱落,局部肠腺排列疏松,固有层内少量炎性细胞浸润; 高剂量SCFAs组: 黏膜上皮结构完整,肠腺数量丰富,排列紧密,形态正常,炎性细胞浸润较AAD组减少,见图1。由此表明, SCFAs可改善AAD大鼠结肠组织形态,且呈剂量依赖性趋势。
2.4 各组大鼠结肠组织炎症因子水平比较
与对照组比较, AAD组IL-6、TNF-α、IL-1βmRNA相对表达量均升高,差异有统计学意义(P<0.05); 与AAD组比较,低剂量SCFAs组、高剂量SCFAs组IL-6、TNF-α、IL-1βmRNA相对表达量均降低,且呈剂量依赖性趋势,差异有统计学意义(P<0.05), 见图2。
2.5 各组大鼠结肠组织杯状细胞比较
与对照组比较, AAD组结肠组织内杯状细胞数量减少,差异有统计学意义(P<0.05); 与AAD组比较,低剂量SCFAs组、高剂量SCFAs组结肠组织杯状细胞数量增加,且呈剂量依赖性趋势,差异有统计学意义(P<0.05), 见表4、图3。

图1 各组大鼠结肠组织病理学观察结果(HE染色法,放大100倍)
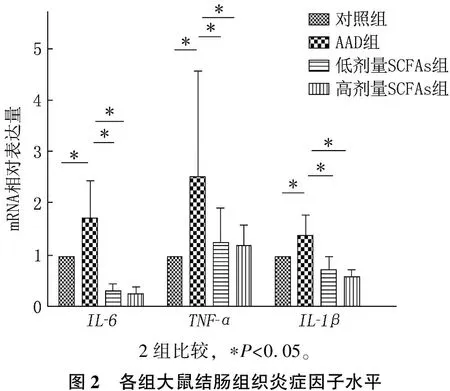
2组比较, ∗P<0.05。图2 各组大鼠结肠组织炎症因子水平
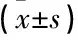
表4 各组大鼠结肠组织杯状细胞比较
2.6 各组大鼠结肠组织内容物革兰染色结果比较
与对照组比较, AAD组革兰阴性杆菌比例下降,革兰阳性杆菌比例升高,差异有统计学意义(P<0.05); 与AAD组比较,低剂量SCFAs组、高剂量SCFAs组革兰阴性杆菌比例升高,革兰阳性杆菌比例下降,且呈剂量依赖性趋势,差异有统计学意义(P<0.05), 见表5。
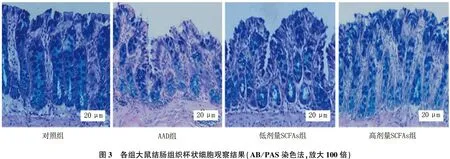
图3 各组大鼠结肠组织杯状细胞观察结果(AB/PAS染色法,放大100倍)
表5 各组大鼠结肠内容物革兰染色结果比较 %
3 讨 论
血液肿瘤指不同分化阶段的造血细胞和淋巴细胞异常克隆增殖的异质性肿瘤,约占全球癌症的6.5%[9]。随着放化疗、造血干细胞移植、靶向治疗、生物治疗、细胞治疗等治疗方式的出现,近年来血液肿瘤患者的5年生存率大大提升。然而放化疗相关的中性粒细胞减少和中心静脉导管、免疫抑制剂、靶向药物相关的T淋巴细胞、B淋巴细胞功能障碍,使得1/3的患者易合并血流感染[10]。应用抗生素是预防或治疗血液肿瘤治疗相关感染的一线方案,但可能引发AAD等并发症。AAD的发病率与抗生素使用时间及抗菌谱呈正相关,与年龄呈负相关[11], 若不及时治疗,还可导致伪膜性肠炎等,致死率近1/4[12]。
栗冲[13]观察132例应用抗生素的血液肿瘤患者发现AAD的发生率为18.94%, 与ZHANG N等[14]报道的AAD患病率(5%~30%)相符。YUSUF K等[15]发现,广谱抗生素所致AAD的发生率为窄谱抗生素的10~70倍,且以第3代头孢菌素类、克林霉素类、氟喹诺酮类抗生素最为常见。超高效液相色谱串联法检测结果显示,发生AAD的血液肿瘤患者结肠内容物SCFAs如乙酸、丙酸、丁酸含量明显下降。基于此,本研究拟通过林可霉素注射液建立AAD大鼠模型,观察肠道补充SCFAs对AAD大鼠肠道黏膜的可能影响。
本研究结果显示,应用林可霉素灌胃的大鼠出现粪便含水量增加,体质量增长缓慢,饮水量增加,排便次数增加,水样便,肛周粪便黏附,精神萎靡,提示AAD大鼠模型制备成功; 分别给予100、150 mg/(kg·d) SCFAs(乙酸+丙酸+丁酸混合液,比例为3∶1∶1)后, AAD大鼠的进食量、日常活动、体质量、粪便性状、粪便含水量等不同程度地改善,初步提示SCFAs具有减轻AAD大鼠腹泻的效果。
AAD发病机制复杂,目前多认为与抗生素的应用导致肠道生物屏障紊乱有关,肠黏膜屏障由化学屏障、生物屏障、免疫屏障和机械屏障组成,肠道生物屏障紊乱可破坏肠道化学屏障及机械屏障,使肠黏膜通透性增加,便于条件致病菌侵入黏膜固有层,激活免疫屏障,释放大量炎性细胞因子如IL-6、TNF-α、IL-1β等,进一步加重肠黏膜屏障破坏程度[16-17]。本研究给予大鼠林可霉素灌胃后,结肠组织HE染色可见黏膜损伤,炎症因子IL-6、TNF-α、IL-1βmRNA相对表达量明显升高, AB/PAS染色示杯状细胞数量减少,黏膜屏障功能受损,革兰染色结果示存在菌群失调,从微观角度进一步证实AAD大鼠制备成功,腹泻的发生伴随肠黏膜屏障功能的降低。SCFAs作为肠道厌氧菌发酵膳食纤维的代谢产物,在调节肠道能量代谢、维护肠道菌群稳态、激发肠道免疫反应和促进电解质与水吸收方面起着重要作用[18]: ① SCFAs是肠道阴离子的主要提供者,通过质子化方式扩散进入微生物细胞内释放H+而降低肠道pH值,可抑制志贺菌属、大肠埃希菌、沙门菌等致病菌或条件致病菌繁殖(适宜生长pH值为6.0~7.0),促进益生菌定植生长(益生菌如乳酸菌的适宜生长pH值为4.0)并保护肠道; ② SCFAs通过促进组蛋白乙酰化,激活过氧化物酶增殖体激活受体等方式作用于淋巴细胞和单核吞噬细胞等免疫细胞,抑制致炎因子释放,抑制免疫效应细胞增殖,诱导T细胞分化为调节性T细胞,抑制效应T细胞增殖和激活,调节趋化反应,促进抗菌肽产生等途径发挥缓解炎症、调节肠道免疫的作用。相关研究[19]亦指出,肠道菌群紊乱相关疾病可通过增加肠道SCFAs浓度的方法治疗,如调整饮食结构、口服益生菌、粪便移植等,但上述治疗方法因各有弊端未能被广泛应用于临床[20]。本研究采用2种剂量的SCFAs对ADD大鼠连续灌胃15 d后, HE染色示黏膜层炎症细胞浸润减少,炎症因子IL-6、TNF-α、IL-1βmRNA相对表达量明显下降, AB/PAS染色示杯状细胞数量增加,黏膜屏障恢复,革兰染色结果示菌群失调情况明显改善,提示肠道补充SCFAs有助于增加杯状细胞数量,降低炎症因子水平,增强肠黏膜屏障功能,恢复肠道菌群。ICHIKAWA H等[21]研究发现,经口或直肠补充SCFAs可促进大鼠肠上皮细胞增殖。SUZUKI T等[22]认为,结肠高浓度SCFAs可增强盲肠的屏障功能。研究[18]显示,口服SCFAs在被结肠细胞利用前不受肝脏等消化因子的影响,提示口服SCFAs的效果明显优于口服益生菌。
综上所述,SCFAs干预有助于促进AAD大鼠肠道屏障功能恢复,这可能与SCFA调节炎性细胞因子,改变肠道菌群组成,减轻AAD所致肠黏膜损伤有关,提示血液肿瘤患者在饮食中补充SCFAs或可减轻AAD症状。尽管AAD由广谱抗生素引发,但亦不能排除血液肿瘤对肠道功能的影响,而本研究中AAD大鼠无肿瘤病变,未来有必要制备荷瘤AAD动物模型进一步深入研究加以验证。
