线粒体自噬相关基因在胃腺癌中的差异表达与核心基因挖掘
2023-11-02熊华朝严明权肖炜明张思琴
熊华朝, 严明权, 肖炜明, 张思琴
(1. 扬州大学 医学院, 江苏 扬州, 225000; 2. 扬州大学附属医院 消化内科, 江苏 扬州, 225001)
胃癌是临床常见的恶性肿瘤之一,发病率、转移率和病死率高,早期诊断率、根治性切除率和5年生存率低[1-2],目前总体治疗效果仍较差。探索胃癌的发生机制及胃癌治疗新靶点,抑制肿瘤复发或转移,对提高胃癌患者生存率具有重要的临床意义。线粒体自噬是一种选择性清除受损或过量线粒体的过程,对调节细胞内线粒体数量和维持其正常功能具有重要作用,且与多种病理生理过程有关[3]。癌细胞可通过糖酵解及线粒体氧化获取腺苷三磷酸(ATP)等能源物质,并利用自噬尤其是线粒体自噬这种特殊形式在抗癌治疗或代谢应激期间回收细胞内成分[4], 从而完成迅速大量的增殖生长。目前,与线粒体自噬相关的胃癌异质性尚未有系统性研究结论。本研究利用生物信息学方法构建线粒体自噬相关基因(MRGs)在胃腺癌(STAD)中的预后模型,分析MRGs在STAD中的差异表达与预后表现(由于多基因模型比单基因模型具有更好的预测能力,最终采用多基因模型对STAD的线粒体自噬情况进行分析[5]), 以期为STAD患者的临床结局预测提供参考依据。
1 材料与方法
1.1 数据来源
从癌症基因组图谱(TCGA)网站(https://portal.gdc.cancer.gov/)[6]中下载STAD数据集(TCGA-STAD)的表达矩阵,共得到375份STAD样本(STAD组)[7]和32份癌旁正常组织样本(正常组)的数据,所有样本都有匹配的临床信息,相应临床数据可从UCSC Xena数据库[8](http://genome.ucsc.edu)中获得。
从基因表达综合数据库(GEO)[9]中下载STAD相关数据集GSE15459[10], 排除质量控制差和非胃癌(癌种不明)样本后,将剩余的192例STAD患者样本的微阵列基因表达谱数据纳入本次研究。
基因卡片(GeneCards)数据库(https://www.genecards.org/)可提供有关人类基因的全面信息[11], 从中收集MRGs,以"mitophagy"作为搜索关键词,共获得2 414个MRGs。另通过基因集富集分析(GSEA)网站检索相关通路,共得到29个MRGs。对2种来源的MRGs取交集,并剔除数据集GSE15459转化过程中缺失的基因,最终得到26个MRGs, 见表1。

表1 26个线粒体自噬相关基因列表
1.2 MRGs预后模型构建方法
为了得到STAD的MRGs预后模型,本研究采用10倍交叉验证法执行最小绝对值收缩与选择算子(LASSO)回归[12]。LASSO回归常被用于构建预后模型,是在线性回归的基础上,通过增加惩罚项(lambda×斜率的绝对值)减少模型的过拟合,提高模型的泛化能力。对LASSO回归结果进行可视化,然后通过森林图对LASSO回归预后模型中的线粒体自噬预后相关基因(MPRGs)表达情况进行展示。
1.3 基因本体论(GO)和京都基因与基因组百科全书(KEGG)分析方法
GO分析是大规模功能富集研究的常用方法,包括生物学过程、分子功能和细胞组分[13]。KEGG是一个已被广泛使用的存储基因组、生物途径、疾病和药物等信息的数据库[14]。为了分析筛选所得MPRGs的生物学过程、分子功能、细胞组分、生物学通路[15]与STAD的关系,本研究进行GO功能富集分析,富集条目的筛选标准是调整后P值(P.adj)<0.05且FDR值(q值)<0.05, 然后进行KEGG通路富集分析。
1.4 蛋白质-蛋白质相互作用(PPI)网络构建方法
PPI网络由单独蛋白通过彼此之间的相互作用构成[16], 网络中紧密联系的局部区域可能代表分子复合体,具有特定的生物学功能。STRING数据库[17]是一个搜索已知蛋白质和预测蛋白质之间相互作用的数据库。本研究通过STRING数据库将筛选出来的MRGs构建差异表达基因(DEGs)相关的PPI网络(所需最小交互分数为0.900), 再用Cytoscape软件[18](version3.9.1版本)可视化呈现PPI网络。
2 结 果
2.1 MRGs预后模型的构建及差异表达情况分析
为了确定26个MRGs在TCGA-STAD数据集中的预后价值,本研究通过LASSO回归分析构建基于表达量的预后模型(图1A), 并根据风险比(HR)>1筛选出有15个MPRGs(ATG12、CSNK2A2、CSNK2B、FUNDC1、MAP1LC3A、MAP1LC3B、PGAM5、PINK1、SQSTM1、TOMM20、TOMM22、TOMM40、TOMM5、UBA52、UBC), 见表2。对LASSO回归结果进行可视化,得到LASSO变量轨迹图(图1B)和MPRGs表达情况的森林图(图1C)。森林图中,红色箱体代表HR的95%置信区间, 15个MPRGs均HR>1, 即均为STAD的危险因子,其中UBC、UBA52基因的箱体更为靠右,提示UBC、UBA52基因对STAD的疾病进展和死亡的危害性更高。

表2 线粒体自噬预后相关基因的差异表达情况分析
2.2 GO和KEGG富集分析结果
GO功能富集分析结果显示, 15个MPRGs在STAD中主要富集于大分子自噬、蛋白质定位、线粒体自噬等生物学过程,线粒体外膜、线粒体膜部分、线粒体外膜蛋白复合体等细胞成分,泛素蛋白连接酶结合、蛋白质丝氨酸/苏氨酸激酶活性、蛋白跨膜转运活性等分子功能,见表3、图2A。KEGG通路富集分析结果显示, 15个MPRGs显著富集于帕金森病、铁凋亡等15个信号通路,见表4、图2B。将GO和KEGG富集分析结果进一步以网络图形式呈现,见图2C、图2D。
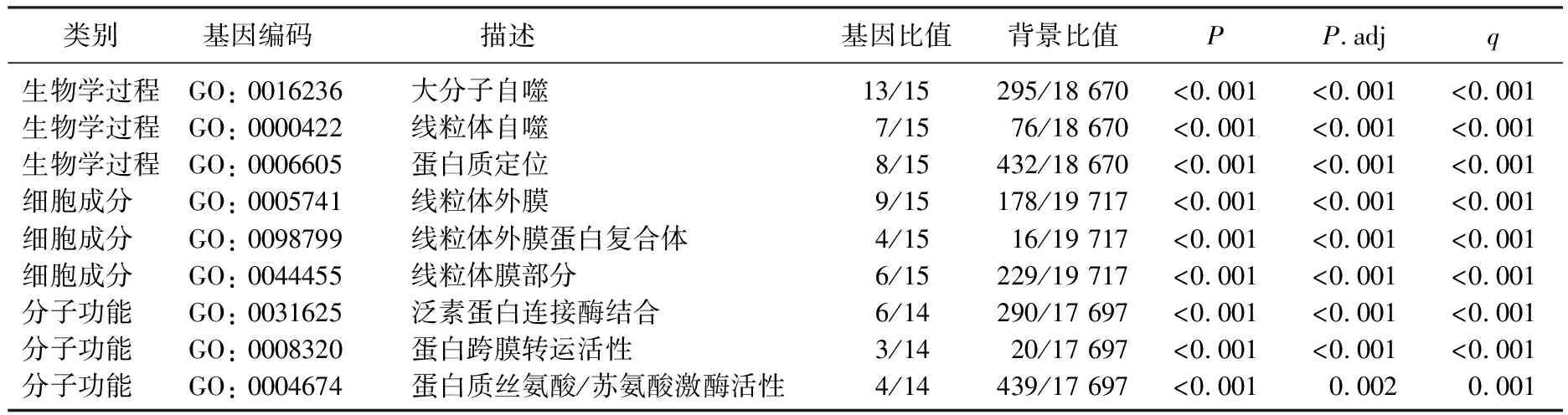
表3 线粒体自噬预后相关基因的GO富集分析结果

表4 线粒体自噬预后相关基因的KEGG通路富集分析结果
对15个MPRGs进行联合log2FC的GO和KEGG富集分析,即在富集分析的基础上,通过提供的分子(15个MPRGs)在TCGA-STAD数据集高风险组、低风险组差异分析结果中的log2FC, 计算每个分子对应的Z得分。联合log2FC的GO富集分析结果以弦图(图2E)展示,联合log2FC的KEGG富集分析结果以圈图(图2F)展示,结果显示线粒体自噬-动物(编码hsa04137)为显著上调表达的生物学过程。
2.3 PPI网络构建
基于STRING数据库对15个MPRGs(ATG12、CSNK2A2、CSNK2B、FUNDC1、MAP1LC3A、MAP1LC3B、PGAM5、PINK1、SQSTM1、TOMM20、TOMM22、TOMM40、TOMM5、UBA52、UBC)构建PPI网络,并通过Cytoscape软件对PPI关系进行可视化展示(图3A、图3B),结果显示与其他蛋白互作关系最多的蛋白是PINK1,有8个蛋白(PGAM5、SQSTM1、TOMM20、TOMM22、TOMM40、TOMM5、UBA52、UBC)与其存在紧密联系。通过功能相似性分析评估各基因与其他基因的功能相似性评分,其中ATG12基因与其他基因的功能相似性评分最高,见图3C、图3D。

A: LASSO回归预后模型图; B、C: LASSO回归预后模型的变量轨迹图、森林图。图1 线粒体自噬相关基因预后模型的构建
3 讨 论
目前,线粒体自噬已被证实与肿瘤的发生和进展有关,然而线粒体自噬在胃癌防御机制中的确切靶点和作用机制尚未明确。本研究基于TCGA、GEO、GeneCards数据库以及GSEA网站分析MRGs在STAD组织和癌旁正常组织中的表达情况,结果显示, 15个MRGs是STAD的危险因素,其中UBC、UBA52基因对STAD的进展和预后影响更大,ATG12基因与其他基因的功能相似性最高,PGAM5表达与STAD的发生具有显著相关性,PINK1与STAD的蛋白表达密切相关。
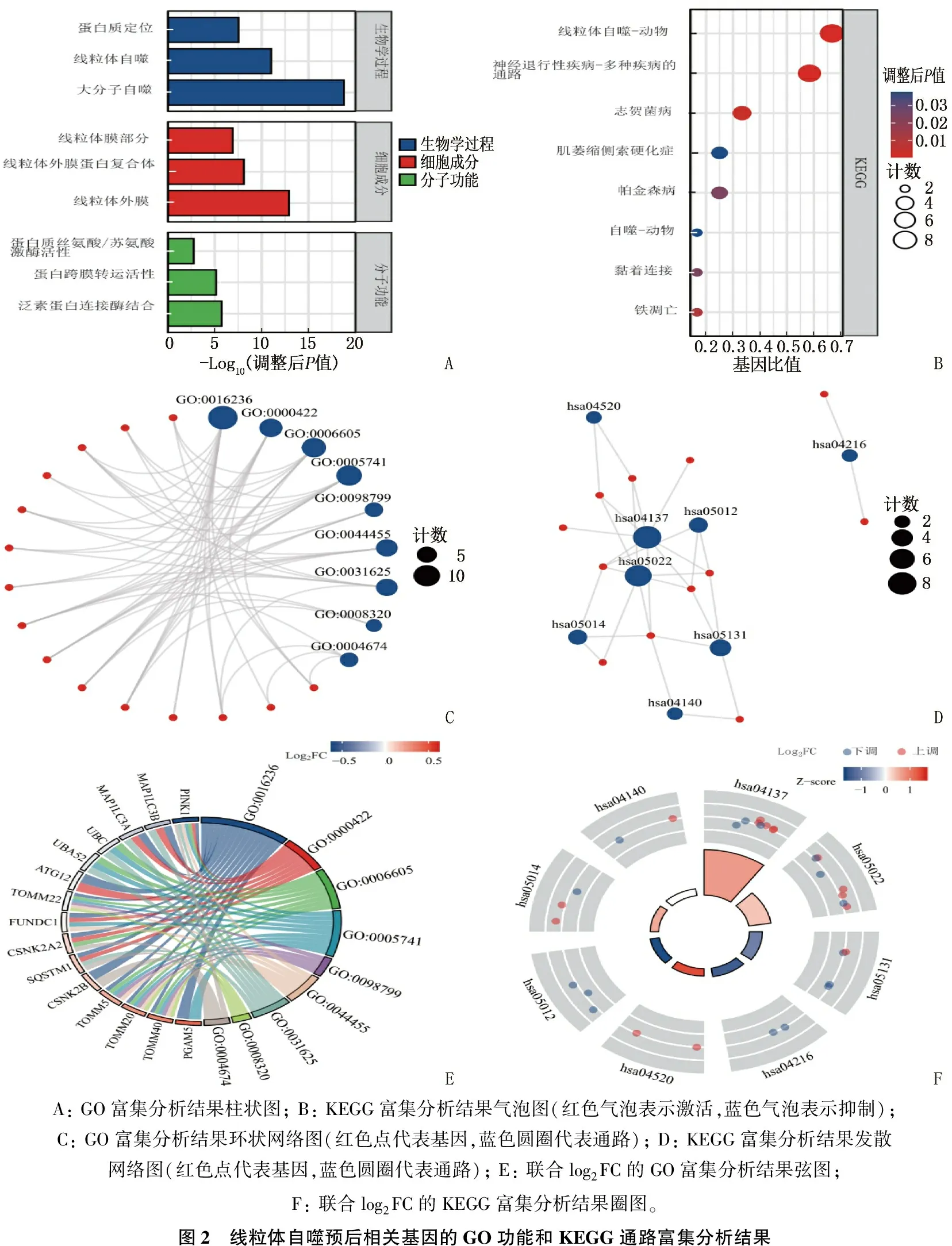
A: GO富集分析结果柱状图; B: KEGG富集分析结果气泡图(红色气泡表示激活,蓝色气泡表示抑制); C: GO富集分析结果环状网络图(红色点代表基因,蓝色圆圈代表通路); D: KEGG富集分析结果发散网络图(红色点代表基因,蓝色圆圈代表通路); E: 联合log2FC的GO富集分析结果弦图; F: 联合log2FC的KEGG富集分析结果圈图。图2 线粒体自噬预后相关基因的GO功能和KEGG通路富集分析结果
目前,关于UBC、UBA52基因与胃癌相关性的研究较少见,故本研究结果或可为该领域的研究提供有益补充。泛素样蛋白ATG12可与ATG5形成复合体,且ATG12已被证明是自噬的关键调节因子。NIE Y L等[19]研究表明,ATG12基因在胃癌治疗中具有重要作用。MENG L等[20]研究表明,PGAM5在胃癌组织和细胞系中表达上调,其表达与TNM分期和肿瘤大小具有相关性。此外,敲低PGAM5可抑制胃癌细胞的迁移、增殖和侵袭能力,而过表达PGAM5可增强胃癌细胞的体外功能。PGAM5还可以促进PI3K/AKT信号通路的激活,促进胃癌细胞增殖。
本研究PPI网络分析结果显示,与其他蛋白互作关系最多的蛋白是PINK1。正常线粒体中, PINK1在线粒体内膜被类金刚石蛋白(PARL)加工,然后释放到细胞质,通过蛋白酶体依赖的途径被迅速清除。当线粒体受损时, PARL可抑制PINK1的内膜插入和后续加工,导致PINK1在线粒体中累积[21]。PINK1和这些相关蛋白的相互作用也与胃癌细胞对线粒体的影响密切相关[22]。

A、B: PPI网络; C、D: 功能相似性分析结果。图3 线粒体自噬预后相关基因的PPI网络和功能相似性分析
SALAZAR C等[23]发现, PINK1/PARKIN/DJ-1网络的相互作用可能发生在转录水平。MIYAZAKI N等[24]指出,在胰腺癌细胞模型中,PINK1通过糖酵解抑制线粒体自噬而调节线粒体的活化。李娜等[25]采用Western blot法检测胃癌细胞线粒体自噬信号通路PINK1/Parkin中PINK1、Parkin蛋白和自噬标志蛋白表达水平,并通过免疫荧光法检测胃癌细胞中自噬蛋白与线粒体特征蛋白共定位水平,发现巨噬细胞迁移抑制因子通过上调PINK1/Parkin线粒体自噬水平发挥保护线粒体功能的作用,进而促进肿瘤细胞增殖,本研究GO和KEGG富集分析结果与此一致,提示MRGs可能参与STAD的进展,或可作为STAD的预后标志物和潜在治疗靶点。但本研究尚处于起步阶段,缺乏相应的临床实验研究,无法结合临床信息进行分析,而多个数据集会导致分析时难以避免和消除批次间差异,未来还需进一步开展体内和体外实验等加以验证。
综上所述,本研究基于生物信息学分析发现15个MPRGs(ATG12、CSNK2A2、CSNK2B、FUNDC1、MAP1LC3A、MAP1LC3B、PGAM5、PINK1、SQSTM1、TOMM20、TOMM22、TOMM40、TOMM5、UBA52、UBC)在STAD中表达不同且代谢通路不同,或可作为STAD预后的独立预测工具和STAD基因检测、治疗评估的靶点,进而为STAD的临床治疗提供参考依据。
