凝血酶原国际标准化比值/白蛋白、终末期肝病模型联合血清钠和高密度脂蛋白胆固醇联合检测对慢加急性肝衰竭患者预后的预测价值
2023-11-02刘先进朱晓红
王 娟, 章 颖, 刘先进, 朱晓红
(江苏省南通市第三人民医院/南通大学附属南通第三医院 感染科, 江苏 南通, 226006)
肝衰竭是一种临床表现为严重肝功能不全及相关并发症的症候群,一般可分为急性、亚急性、慢加急性及慢性肝衰竭,慢加急性肝衰竭(ACLF)在中国最为常见[1]。ACLF是指在长期慢性肝病的状态下,短期内发生急性肝功能失代偿的严重肝病,病情凶险,短期病死率较高[2]。早期ACLF经过积极治疗后,肝功能可能会出现部分逆转,而中晚期患者往往需要进行肝移植或人工肝血浆置换才能得以生存[3]。因此,探索一种临床易于获取、可靠有效的判断病情转归的预测模型具有重要意义。目前,传统的评估肝功能状况及判断肝衰竭预后的指标主要有终末期肝病模型(MELD)、终末期肝病模型联合血清钠(MELD-Na)、序贯器官衰竭估计(SOFA) 评分系统等[1, 4]。近年来发现一些新型指标,如凝血酶原国际标准化比值/白蛋白(PTAR),其由血清白蛋白(ALB)及国际标准化比值(INR)计算得出,二者反映肝脏的合成功能,可作为预测患者死亡风险的重要因素[5]。高密度脂蛋白胆固醇(HDL-C)是肝细胞膜的主要成分,给肝细胞提供能量,肝衰竭患者中HDL-C降低,进而加重肝损伤[6]。本研究回顾性分析了154例ACLF患者的临床资料,通过构建PTAR、HDL-C、MELD-Na联合预测模型,探讨联合预测模型对ACLF患者预后的预测价值。
1 对象与方法
1.1 研究对象
回顾性分析2019年1月—2022年6月南通市第三人民医院收治的200例ACLF患者的临床资料。纳入标准: ① 符合《肝衰竭诊治指南(2018年版)》ACLF诊断标准[1]者; ② 病毒性、免疫性、酒精性引起的肝衰竭者; ③ 临床血液学资料完整者; ④ 随访资料完整者。排除标准: ① 合并肝脏或其他部位恶性肿瘤者; ② 非病毒性、免疫源性、酒精性原因引起的ACLF者; ③ 合并无法控制的高血压、糖尿病等慢性基础疾病者; ④ 合并造血、免疫系统疾病者; ⑤ 孕期或哺乳期妇女; ⑥ 有器官移植手术史患者。
1.2 方法
所有患者入院后未进行治疗,空腹下完成采血。收集患者的临床基线资料,包括年龄、性别、病因及相关实验室指标,实验室指标主要有谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷氨酰转肽酶(GGT)、总胆红素(TBil)、ALB、尿素氮(BUN)、血肌酐(Cr)、凝血酶原时间(PT)、血清钠(Na+)、白细胞(WBC)、血小板(PLT)、INR、HDL-C等。根据公式计算出PTAR及MELD-Na数值, PTAR=INR/ALB(g/mL); MELD-Na=MELD+1.59×(135-Na+), Na+>135 mmol/L时按135 mmol/L计算, Na+<120 mmol/L时按120 mmol/L计算[7], 其余均按实际数值计算。以入院当天未行治疗前作为观察起点,所有患者至少随访90 d, 根据确诊第90天的生存情况将入组患者分为生存组和死亡组。
1.3 统计学分析

2 结 果
2.1 一般资料
共纳入200例ACLF患者,排除46例,入组154例,病因为病毒性95例、酒精性39例、自身免疫性20例,根据3个月末的生存情况分为生存组95例和死亡组59例。生存组年龄为(47.52±10.10)岁,男70例,女25例; 死亡组年龄为(51.33±9.02)岁,男42例,女17例。2组年龄、TBil、ALB、Cr、PT、Na+、WBC、PLT、PTAR、HDL-C、MELD-Na比较,差异有统计学意义(P<0.05)。2组性别、病因、ALT、AST、GGT、BUN比较,差异无统计学意义(P>0.05)。见表1。

表1 生存组和死亡组患者基线资料比较
2.2 PTAR、HDL-C、MELD-Na之间的相关性
Spearman相关系数分析显示, PTAR与MELD-Na呈正相关(r=0.407,P<0.001), PTAR、MELD-Na与HDL-C呈负相关(r=-0.316、-0.303,P<0.001)。见图1。
2.3 ACLF患者的预后因素分析
单因素分析显示,年龄、TBil、ALB、PT、PTAR、HDL-C、MELD-Na是ACLF患者预后的影响因素(P<0.05), 见表2。将有统计学意义的自变量进行多重共线性诊断,方差膨胀因子(VIF)均<5。二元Logistic多因素分析显示,年龄、TBil、PT、PTAR、MELD-Na水平升高是ACLF患者预后的独立危险因素(P<0.05); HDL-C水平降低也提示ACLF患者预后相对较差。见表3。

A: PTAR与MELD-Na相关性分析; B: HDL-C与PTAR相关性分析; C: HDL-C与MELD-Na相关性分析。图1 PTAR、HDL-C、MELD-Na之间的相关性分析
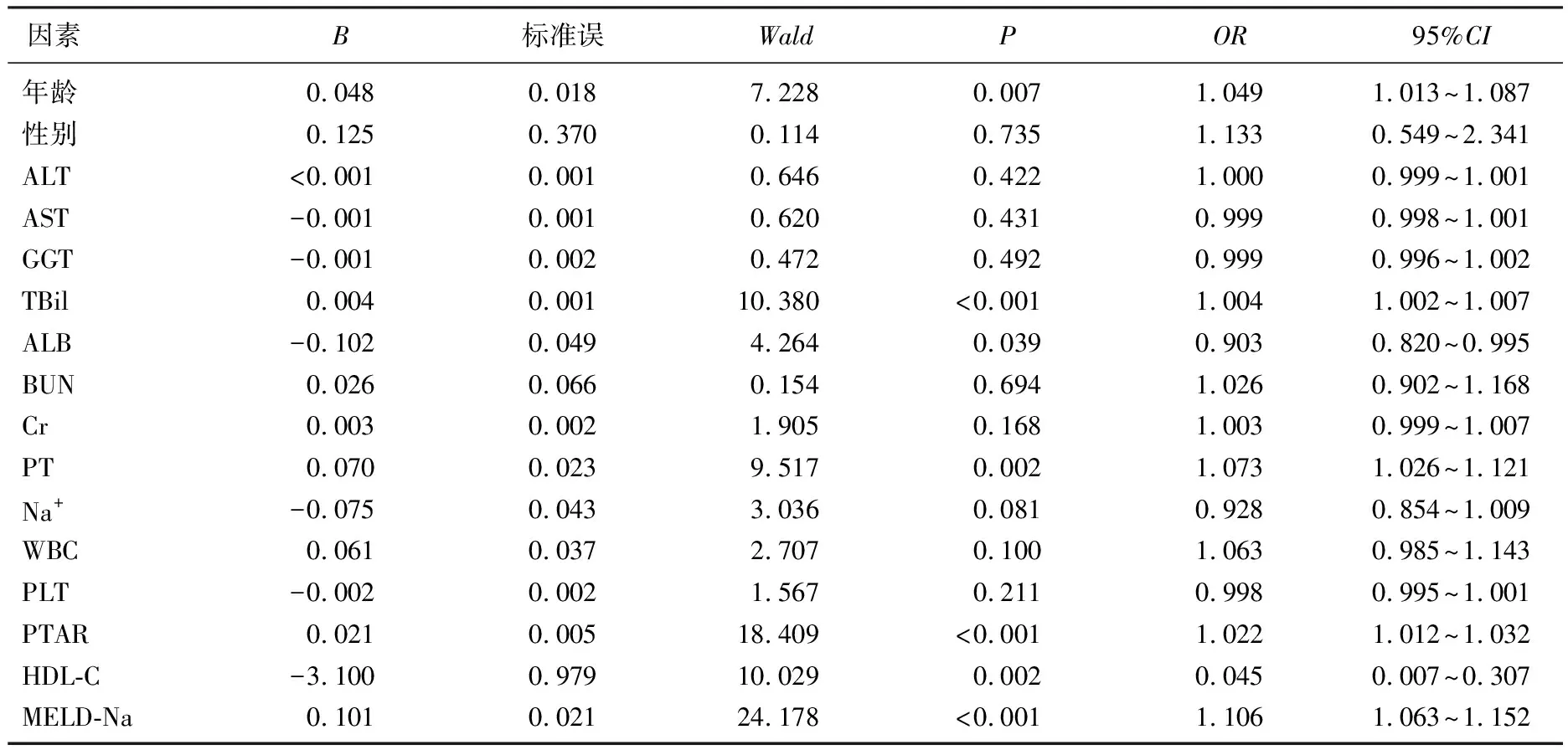
表2 影响ACLF患者预后的单因素分析

表3 影响ACLF患者预后的多因素Logistic分析
2.4 PTAR、HDL-C、MELD-Na单项及联合预测模型的效能分析
绘制PTAR、HDL-C、MELD-Na单项及联合预测模型的ROC曲线,见图2。结果显示, PTAR、HDL-C、MELD-Na单项的AUC分别为0.722、0.717、0.738, 敏感度分别为0.644、0.579、0.740, 三者联合预测模型的预测效能最佳,AUC为0.801, 敏感度为0.627, 特异度为0.916, 约登指数为0.543, 截断值为0.530, 见表4。
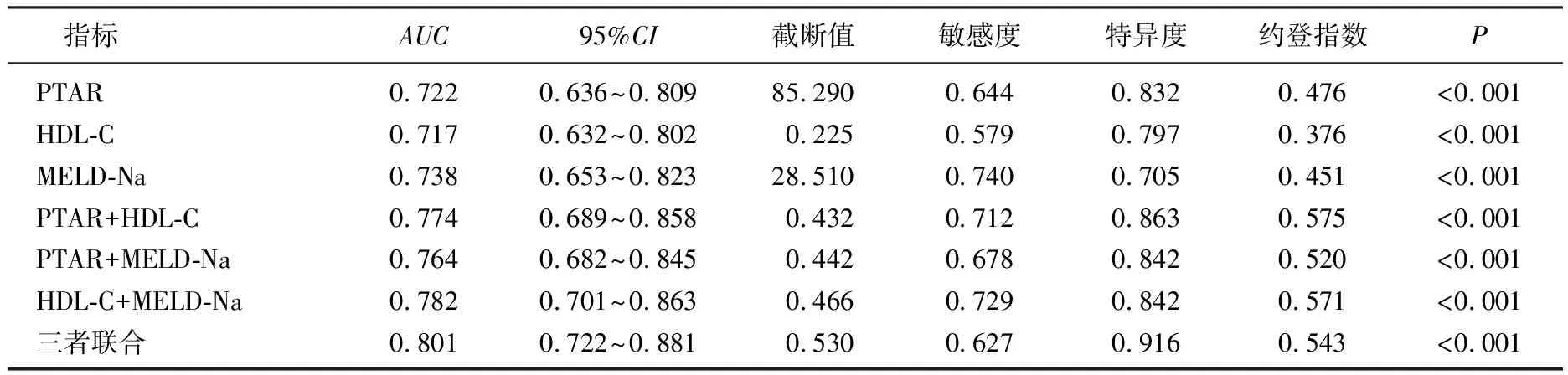
表4 PTAR、HDL-C、MELD-Na单项及联合预测模型的预测效能比较
2.5 三者联合预测模型不同分组对ACLF患者的生存分析
根据三者联合模型的最佳截断值0.530, 将患者分为A组(<0.530,n=47)和B组(≥0.530,n=107), 采用Kaplan-Meier曲线分析显示, A组患者累计生存率高于B组, 差异有统计学意义(P<0.001), 见图3。

图2 PTAR、HDL-C、MELD-Na单项及联合预测模型的ROC曲线
3 讨 论
ACLF的主要临床病理特征是非凋亡形式的肝细胞大量坏死,进展迅速,预后较差[8]。西方国家酒精性ACLF较多见,而中国ACLF最主要的病因为乙型肝炎病毒感染,且大部分患者均合并肝硬化[9-11]。目前尚无ACLF治疗的特效药,内科临床治疗以对症、支持治疗为主,虽然肝移植手术较成熟,也能获得较好的治疗效果,但肝源紧缺且治疗费用较高,大部分ACLF患者没有肝移植手术的机会,病死率较高。因此,构建一种临床易于获取且无创的预后预测模型具有重要意义,以便有针对性地对预后较差的ACLF患者进行尽早干预,降低病死率。
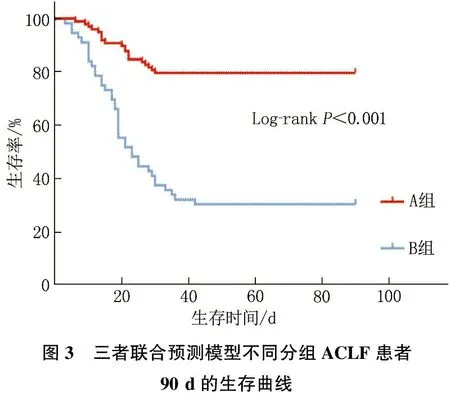
图3 三者联合预测模型不同分组ACLF患者90 d的生存曲线
日本学者[12]在2018年创建了PTAR这种新型指标, PTAR反映机体凝血功能、营养及抵抗力的情况,研究团队对行手术治疗的肝癌患者进行研究,结果发现PTAR水平越高的患者肝损害越严重, PTAR升高的患者术后更容易出现腹水、肝衰竭及病理性肝硬化,由此推断PTAR升高可能是手术治疗后肝癌患者预后不良的危险因素。相关研究[13]对重症肝硬化患者进行了至少90 d的随访,发现PTAR水平升高的患者90 d内死亡的风险显著增加, PTAR评分系统是一种用于预测重症肝硬化患者预后的便捷实用指标。CAI M等[14]分析了166例乙肝相关失代偿期肝硬化患者的临床资料,共有27例患者在30 d内出现死亡,死亡患者的PTAR显著高于未死亡患者,并且PTAR水平越高病情越严重,多因素回归显示, PTAR是乙肝相关失代偿期肝硬化患者死亡的独立预测因子。一项肝硬化合并脓毒症患者相关研究[15]也发现, PTAR是预测预后的一种方便且实用的指标。
HDL-C作为肝细胞膜的主要成分,具有给肝细胞提供能量的功能, ACLF患者由于肝细胞受损,合成HDL-C的能力会有不同程度的下降,而HDL-C水平下降又可加重肝损伤,二者相互促进[16]。ACLF患者本身容易发生肠道屏障的损伤[17], 导致机体内毒素产生增加,而HDL-C能有效中和细菌脂多糖等内毒素,促进内毒素的排泄[18]。相关研究[19-24]对508例代偿期及失代偿期肝硬化患者(包括ACLF)进行研究,结果发现HDL-C水平降低与肝衰竭的严重程度、并发症发生率及生存率密切相关,其是一种有效的预测预后的指标。FENG R R等[25]对肝硬化患者的血脂数据进行分析,结果发现HDL-C水平降低提示失代偿性肝硬化发生率更高、肝功能更差,并且肝硬化患者的存活率更低。GAO B等[26]对117例肝硬化合并门静脉血栓患者进行研究,结果发现HDL-C水平随着肝功能的恶化显著降低,HDL-C水平与患者病死率显著相关,因此该研究团队认为HDL-C可以作为肝硬化合并门静脉血栓患者预后的潜在指标。
MELD评分最早由KAMATH P S等[27]提出,在临床上广泛应用于预测终末期肝病患者的病死率及生存时间,但MELD评分存在一些局限性,易受利尿剂等因素影响,预测准确性不高。BIGGINS S W 等[28]考虑到肝衰竭患者水电解质紊乱较为常见,极易发生低钠血症,因此在2006年将血钠水平添加进MELD评分,首次建立了MELD-Na评分系统。ZHANG Q K等[29]对159例接受肝移植的ACLF患者进行研究,研究显示MELD-Na≥25是肝移植术后出现严重并发症的唯一危险因素(P<0.05,OR=4.35), 而MELD-Na≥35是术后死亡的危险因素之一(P<0.01,HR=4.72)。ZHOU Q H等[30]研究了47例肝硬化合并隐球菌感染的患者,结果发现MELD-Na评分能准确地预测肝硬化合并隐球菌感染患者30 d的病死率。WANG X H等[31]的研究发现,在停用核苷类药物的ACLF患者中,较高的MELD-Na评分与患者3个月的病死率密切相关。
本研究共纳入了154例ACLF患者病例,结果显示,生存组和死亡组患者在年龄、TBil、ALB、Cr、PT、Na+、WBC、PLT、PTAR、HDL-C、MELD-Na方面比较,差异有统计学意义(P<0.05); 年龄、TBil、PT、PTAR、MELD-Na的水平升高是影响ACLF患者预后的危险因素(P<0.05), HDL-C水平的降低也提示ACLF患者预后相对较差。ROC曲线分析显示,PTAR、HDL-C预测ACLF患者预后的价值与MELD-Na评分相似,三者联合对ACLF患者预后的预测价值最高,优于单一指标及任意二者联合。
综上所述,本研究认为PTAR、HDL-C、MELD-Na均是ACLF患者近期预后的独立影响因素, PTAR+HDL-C+MELD-Na联合预测模型对ACLF患者预后具有较好的预测价值。上述3种指标均为常规的无创检测项目,易于获取,实用价值较高。但本研究仍存在一定的不足,本研究属于单中心回顾性分析,样本量偏小,可能存在一定的选择偏倚,仍需开展多中心、大样本、前瞻性的研究进一步验证。
