早期胃癌行内镜黏膜下剥离术的疗效及术中出血危险因素分析
2023-11-02刘翠霞杨桂凤
刘翠霞, 张 祎, 刘 妮, 杨桂凤
(南京医科大学附属泰州人民医院 消化内科, 江苏 泰州, 225300)
胃癌(GC)是一种发生在胃黏膜上皮细胞的恶性肿瘤,死亡率较高[1-2]。目前手术是治疗胃癌的首选方式,胃癌在早期可以通过手术切除肿瘤病灶组织,血清肿瘤标志物是评估癌症患者术后病灶清除效果的重要指标[3-4]。若手术中出血情况得不到有效控制,易致血容量降低,诱发各种并发症,影响手术质量和预后[5]。传统的开腹手术治疗方式会对患者造成较大的创伤,同时术中出血量较多,易诱发肠粘连、吻合口瘘等并发症,治疗效果欠佳[6]。内镜黏膜下剥离术(ESD)可以有效切除肿瘤,具有暴露清晰、损伤小、恢复快、住院时间短等优点[7]。本研究以全腹腔镜下远端胃切除术(TLDG)为参照,探讨ESD治疗早期胃癌患者的临床疗效,分析术中出血的影响因素,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2019年6月—2022年6月在南京医科大学附属泰州人民医院诊断为早期胃癌的156例患者为研究对象,随机分为ESD组与TLDG组,每组78例。ESD组男43例,女35例,年龄36~67岁,平均(51.68±16.12)岁; 体质量指数(BMI)为25~30 kg/m2,平均(27.49±2.68) kg/m2; 合并心、肺慢性疾病14例; 病变部位为胃窦32例,胃底-贲门13例,胃体18例,胃角15例; TNM分期ⅠA期52例, ⅠB期26例; 组织高分化53例,中分化25例; 美国麻醉医师协会(ASA)分级Ⅰ期45例, Ⅱ期33例。TLDG组男46例,女32例,年龄35~68岁,平均(52.12±17.19)岁; BMI为25~29 kg/m2, 平均(26.53±2.73) kg/m2; 合并心、肺慢性疾病16例; 病变部位为胃窦29例,胃底-贲门18例,胃体17例,胃角14例; TNM分期ⅠA期49例, ⅠB期29例; 组织高分化52例,中分化26例; ASA分级Ⅰ期50例, Ⅱ期28例。2组患者性别、年龄、BMI、并发症、病变部位、TNM分期、组织分化及ASA分级等一般临床资料比较,差异无统计学意义(P>0.05)。纳入标准: ① 患者均符合《中国胃癌筛查与早诊早治指南(2022, 北京)》[8]中早期胃癌的诊断标准; ② 患者符合早期胃癌内镜下切除的适应证[9]; ③ 患者临床资料完整,年龄>20岁,骨髓功能正常,肝肾功能正常; ④ 患者无胃肠道手术治疗史; ⑤ 患者预期生存期≥6个月; ⑥ 患者及家属均知情并签署知情同意书。排除标准: ① 存在严重贫血者; ② 合并其他严重疾病或恶性肿瘤者; ③ 合并其他恶性肿瘤者; ④ 胃癌中晚期患者或存在淋巴结及器官转移者; ⑤ 存在精神疾病,自主表达能力较弱者; ⑥ 妊娠或哺乳期女性。本研究经南京医科大学附属泰州人民医院伦理委员会批准。
1.2 方法
ESD组行ESD手术: 对患者进行全身麻醉,取左侧卧位,通过窄带内镜成像、near focus或靛胭脂染色查看腺管开口、微血管等观察并确定病变范围,同时使用Dualknife做点状标记(病变边缘5 mm处)。在标记外侧进行多点黏膜下注射1 mL肾上腺素、5 mL靛胭脂、甘油果糖或100 mL的0.9%氯化钠混合液,每点注射量约2 mL (为使病变隆起清晰,可多次重复行黏膜下注射)。应用Dualknife刀和IT2刀沿标记点切开病变外侧缘黏膜,再交替使用 Dualknife刀和IT2刀在黏膜下层剥离病灶(此过程中,根据术中情况,可多次行黏膜下注射,以确保剥离层次始终处于黏膜下层)。操刀医师的操作需保持稳定的剥离层次,若剥离层次较浅,黏膜肌层血管丰富,则易出现术中出血情况; 若剥离层次较深,固有肌层则易发生穿孔。在完整切除病灶后,使用热活检钳电凝或氩离子血浆凝固术对创面可见暴露的小血管进行止血处理; 使用血夹夹闭血管或止热活检钳电凝对创面可见暴露的大血管进行处理; 使用电凝止血对切除病灶的创面表面及其周围进行充分止血,金属夹缝合较大创面。部分ESD患者术后病理提示需要追加手术,该部分患者为非治愈性切除患者[存在淋巴结转移和(或)残留癌的风险(局部复发)],追加手术的方式及时机需要依据患者自身情况确定。
TLDG组行TLDG手术: 对患者进行全身麻醉,取平卧位,气管插管。建立CO2气腹,在患者脐下做1 cm的横向切口,并置入气腹针(腹内压力为10~12 mmHg)。以患者左侧腋前线肋缘下2 cm处取主穿刺孔(12 mm套管针),左侧锁骨中线平脐位置取副操作孔(10 mm套管针穿刺),同时在左、右侧对称部位分别取助手操作孔(5 mm套管针)。通过腹腔镜观察患者肿瘤位置、大小等,向近心端翻起大网膜,将血管离断至脾门,剥离胰腺包膜及横结肠系膜组织,对胃结肠韧带进行游离,切断胃网膜血管、韧带,清扫胃大弯、肠系膜上及油门下淋巴结,游离胃网膜、胃右动脉,应用不可吸收夹夹闭并切断十二指肠动脉分支,对胃左血管进行游离,并清理局部淋巴组织。关闭气腹,选取十二指肠球部至肿瘤近端4 cm游离胃体,在脐部上方做纵向切口约7 cm,进入腹腔,置入切口保护套,取出病灶,病理检测呈阴性后,生理盐水冲洗腹腔,行消化道重建。吻合十二指肠与胃,放置引流管,逐层缝合,术毕。
1.3 评价标准
1.3.1 术中出血: 指术中创面渗血或喷射性出血超过1 min, 内镜可成功止血; 术中活动性渗血或喷射性出血,内镜下止血困难,需要中断手术或输血治疗。将出血量≥150 mL的患者纳入出血组。
1.3.2 血清肿瘤标志物: 采集患者术前及术后空腹静脉血3 mL, 1 000转/min离心5 min, 离心半径10 cm, 而后取上清液置于无菌EP管中。糖类抗原199(CA199)、糖类抗原125(CA125)采用酶联免疫吸附法(ELISA)检测; 胃蛋白酶原Ⅰ(PG Ⅰ)采用乳胶增强免疫比浊法检测。仪器为上海金鹏分析仪器有限公司的JP-K3900Plus全自动电化学发光检测仪,配套试剂盒均购自罗氏检验公司,操作严格按照说明书执行。记录患者术后3个月血清标志物水平。
1.3.3 病灶切除: 术中整块切除病灶的同时获得单块标本; 完全切除是指术中整块切除病灶且边缘未见异型肿瘤细胞。整块切除率(%)=获得整块病灶例数/总例数×100%, 完全切除率(%)=术中整块切除病灶且边缘未见异型肿瘤细胞例数/总例数×100%。
1.3.4 并发症: 术中发生切口脂肪液化,术后发生胃瘫、吻合口出血及肺部感染等。
1.3.5 生活质量评估: 采用健康调查简表(SF-36)评估生活质量,共8个维度、36个条目,分值为0~100分,分数越高提示生活质量越好。
1.4 统计学分析
将数据整理并录入Excel表格,采用SPSS 26.0软件对数据行统计学处理,对计量资料行正态和方差齐性检验,正态分布数据以均值±标准差表示,组间比较采用独立样本t检验; 计数资料采用[n(%)]表示,组间比较行χ2检验; 影响因素分析采用多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者手术疗效比较
ESD组病灶完全切除率、病灶整块切除率高于TLDG组,肠胃功能恢复时间、住院时间、术后开始进食时间、住院费用、术后恢复时间均短于或低于TLDG组,差异有统计学意义(P<0.05或P<0.01)。见表1。
表1 2组患者手术疗效比较
2.2 2组患者术后血清肿瘤标志物水平比较
2组术前血清肿瘤标志物CA199、CA125、PG Ⅰ水平比较,差异无统计学意义(P>0.05); 2组术后3个月血清肿瘤标志物CA199、CA125水平均低于术前, PG Ⅰ水平高于术前,差异有统计学意义(P<0.05); 术后3个月时, ESD组CA199、CA125水平低于TLDG组,PG Ⅰ水平高于TLDG组,差异有统计学意义(P<0.01)。见表2。
表2 2组患者手术前后血清肿瘤标志物水平比较
2.3 胃癌患者术中出血的单因素分析
根据术中出血情况,将所有患者分为出血组(n=33)和未出血组(n=123); 出血组年龄≥60岁、BMI≥27 kg/m2、手术时间>150 min、伴有溃疡患者的比率均高于未出血组,差异有统计学意义(P<0.05)。见表3。
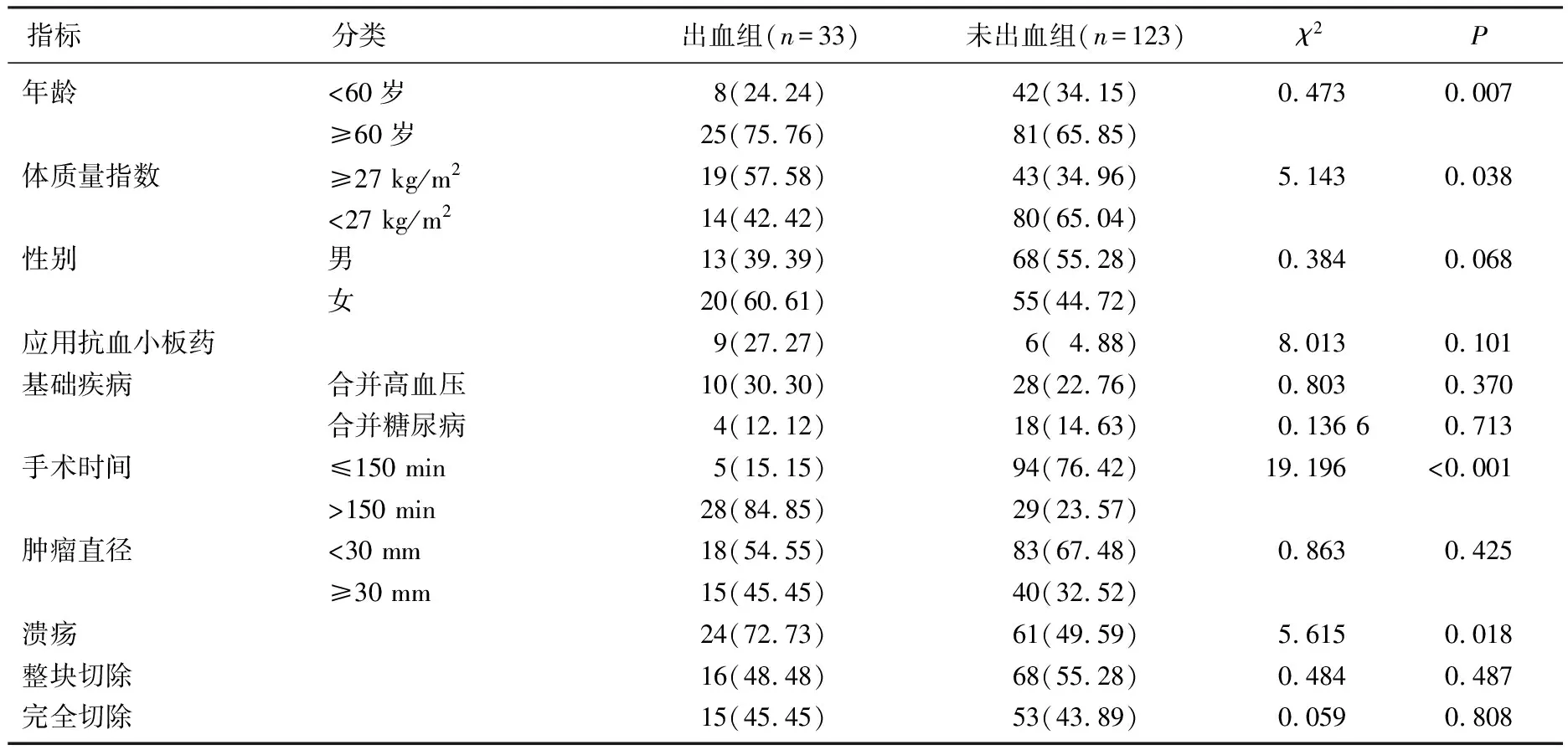
表3 早期胃癌患者术中出血的单因素分析[n(%)]
2.4 胃癌患者术中出血的多因素Logistic分析
对单因素分析中影响早期胃癌患者术中出血情况的有统计学意义的变量行多因素Logistic回归分析,结果显示年龄≥60岁、BMI≥27 kg/m2、手术时间>150 min、合并溃疡是影响胃癌患者术中出血的独立危险因素(P<0.05)。见表4、表5、图1。
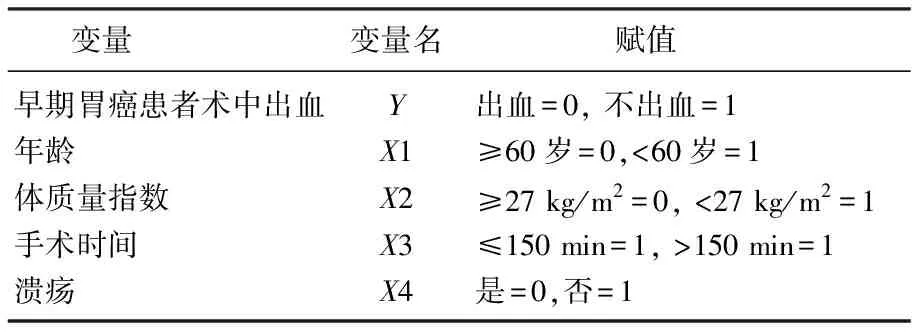
表4 早期胃癌患者术中出血的多因素Logistic回归分析赋值
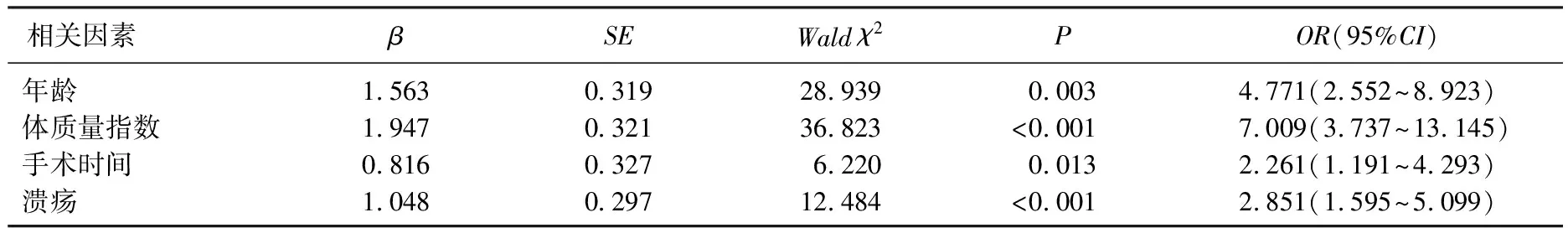
表5 早期胃癌患者术中出血的多因素Logistic回归分析
3 讨 论
流行病学报道[9-10]显示,目前中国胃癌发病率逐年上升,并具有较高病死率。早期胃癌主要是指癌细胞组织局限在胃黏膜层或黏膜下层[11]。随着内镜技术的发展及提高,目前早期胃癌治疗方式以内镜手术为主,其中以ESD为佳,因其更易获得完整病灶且不受肿瘤大小影响。出血在ESD术中较为常见, ESD相关的出血一般分为术中出血、术后出血,术中出血若不能及时处理,会引发多种并发症[12-13]。
郝炳章等[14]研究表明, ESD治疗早期胃癌临床疗效显著,疾病控制率高达98%。本研究中, ESD组疗效显著优于TLDG组,病灶完全切除率、病灶整块切除率显著高于TLDG组,术中出血量、肠胃功能恢复时间、住院时间、术后开始进食时间显著短于TLDG组。分析原因可能是内镜下手术视野清晰,可以完整切除消化道黏膜病灶,清除部分黏膜下病变,并保留正常器官,实现根治肿瘤的目的,具有暴露清晰、创伤小、出血量少、住院时间短、肠胃功能恢复较快等优势。

图1 早期胃癌患者术中出血的多因素Logistic回归分析森林图
本研究中,术后3个月时,ESD组CA199、CA125水平显著低于TLDG组, PG Ⅰ水平显著高于TLDG组。PG Ⅰ水平可有效反映胃黏膜的分泌功能,其主要是由胃底黏液细胞分泌, PG Ⅰ水平降低代表胃底腺体数量减少,从而反映出胃黏膜萎缩; CA199、CA125是肠胃癌恶性肿瘤的重要肿瘤标志物,其水平升高表明患者存在肿瘤的病变; ESD手术能够清晰观察并彻底清除淋巴组织、肿瘤组织,有效减少肿瘤标志物的分泌,从而降低CA199、CA125水平,提高PG Ⅰ水平。冯伟静等[15]研究显示, CA19-9、CA72-4、CEA及AFP在内镜治疗适应证中有一定临床应用价值,联合检测可提高灵敏度和特异性。袁锡裕等[16]也发现胃癌患者肿瘤标志物CEA、CA19-9、CA72-4表达水平及表达数目与根治性切除相关。
陈旭峰等[17]研究指出,病灶直径≥2 cm、操作时间≥25 min、病变部位位于下1/3胃、使用过氯吡格雷的患者术后早期延迟出血的发生率较高。蔡培等[18]指出,有氯吡格雷服药史和肿瘤直径≥20 mm与早期胃癌患者行ESD术后出血密切相关。本研究中,多因素Logistic回归模型发现,年龄≥60岁、BMI≥27 kg/m2、手术时间>150 min、合并溃疡是影响胃癌患者术中出血的独立危险因素,其可能机制为: ① 由于年龄的增加,身体各项机能变差,患者术前多合并心血管疾病及代谢疾病,血管内膜硬化,从而导致血管脆性增加,术中分离过程中易出血,且术中清扫血管旁淋巴结后,钳夹离断血管时内膜易脱落大出血,增加术后并发症的发生率; ② 肥胖患者腹腔内的大量脂肪包裹手术区的血管,影响医生对手术区域血管位置的判断,影响手术视野及操作,钳夹过程中易发生出血; ③ 指南[19]指出,手术时间的延长会导致术中出血风险增加; ④ 早期胃癌患者病灶伴有溃疡的病变发生穿孔风险较高,操作难度加大,病变转移率也随之增加,从而导致手术时间增加,进而增加术中出血的风险。
本研究存在的不足有: ① 样本量少,缺乏代表性,后续研究可进一步扩大样本量; ② 缺乏对患者远期预后评估,对于ESD的远期疗效暂未得知,后续研究中应增加远期随访观察。
综上所述, ESD治疗早期胃癌患者疗效较好,可有效控制血清标志物水平,减少术中出血量。年龄≥60岁、BMI≥27 kg/m2、手术时间>150 min、合并溃疡是影响胃癌患者术中出血的独立危险因素。
