S100A4基因载体的构建及其在人胃癌细胞系中的表达
2023-11-02余海涛陈正徐谢扬虎
余海涛, 陈正徐, 谢扬虎, 张 飞
(1. 安徽医科大学附属合肥医院 检验科, 安徽 合肥, 230041;2. 上海交通大学附属新华医院 普外科, 上海, 200092)
胃癌是最常见的消化系统恶性肿瘤之一。胃癌的主要治疗方法是手术和辅助化疗,但传统化疗副作用大,需要开发新的辅助治疗方法。研究胃癌发生发展的分子生物学机制,寻找新的靶点,将有助于开发更有效的诊断和治疗方法。近年来, S100蛋白家族越来越受到人们的关注,多个S100成员在肿瘤中表达异常,并与肿瘤的浸润和转移密切相关。文献[1]报道, S100A2、S100A4、S100A6和S100A14与各种恶性肿瘤的发病和进展有关。S100A4蛋白是S100蛋白家族的成员,分子量约为11 kDa,由101个氨基酸组成。S100A4在许多人类肿瘤中都有表达,其表达与胃癌的侵袭和淋巴结转移密切相关,但S100A4基因在胃癌中的作用机制尚不清楚。本研究拟通过逆转录聚合酶链反应(RT-PCR)与基因重组技术构建重组真核表达载体pcDNA3.1-S100A4, 然后转染胃癌细胞系MKN1, 本研究为进一步探讨S100A4对胃癌细胞生物学功能的影响及其在胃癌发病中的作用奠定了实验基础。
1 材料与方法
1.1 实验材料
人胃黏膜上皮细胞系GES-1、人胃癌细胞系MKN1(安徽医科大学病理学研究室购买)、克隆载体pMD18-T simple Vector、限制性核酸内切酶、大肠杆菌JM109感受态细胞和胶回收纯化试剂盒(均为Takara公司)、真核表达载体pcDNA 3.1(+)、LipofectamineTM2000脂质体、TRIZOL Reagent(均为Invitrogen公司)、反转录试剂盒(Promega公司)、PCRKit (TIANGEN公司)、质粒提取试剂盒(QIAgen公司)、RPMI1640培养基、胎牛血清(GIBCO 公司)。
1.2 实验方法
1.2.1 细胞培养: 在37 ℃、5% CO2饱和湿度下,在RPMI1640培养基(10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)中培养GES-1和MKN1细胞, 0.25%胰蛋白酶(用生理盐水配制)消化传代。
1.2.2 总RNA的提取: 提取GES-1细胞(细胞数约2×106个)总RNA。① 磷酸盐缓冲液(PBS)清洗细胞2次,加入1 mL TRIZOL试剂; ② 室温静置5 min, 加样枪吹打混匀,取1.5 mL Eppendorf管收集; ③ 加入0.2 mL氯仿,涡旋振荡15 s, 室温静置2~3 min; ④ 4 ℃, 12 000转/min离心15 min, 将上清液转入另一支新试管; ⑤ 加入0.5 mL异丙醇,混匀,室温静置10 min; ⑥ 4 ℃, 12 000转/min离心10 min, 弃上清; ⑦ 加1 mL 75%乙醇(DEPC水配制),涡旋冲洗1次; ⑧ 4 ℃, 7 500转/min离心5 min, 弃上清; ⑨ 风干15 min, 将沉淀物溶于0.01% DEPC-H2O中,取少量进行含量和纯度检测,剩余部分保存于-70 ℃冰箱中。
1.2.3 cDNA的合成: 采用Promega逆转录试剂盒,将总RNA逆转录到cDNA第一链上。总反应体积为20 μL, 反应体系见表1。

表1 cDNA合成反应体系
1.2.4 PCR 扩增: 参照GenBank人S100A4基因cDNA序列(基因登录号: NM_011311), 使用Primer 3.0软件设计引物,以转逆录合成的cDNA作为模板进行PCR 扩增,扩增片段长度327 bp。所用的引物序列如下: 5′-CCCAAGCTTGTCATGGCGTGCCCT -3′; 5′-CGCGGATCCTCATTTCTTCCTGGGCT -3′。PCR反应体系见表2。

表2 PCR扩增反应体系
PCR反应条件:
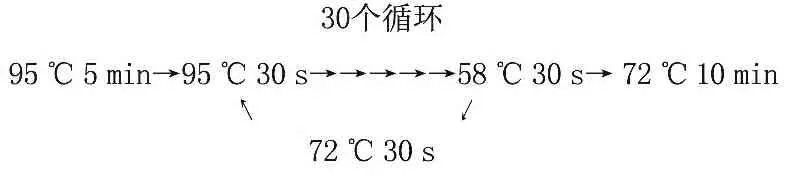
PCR产物经1.2%琼脂糖凝胶电泳证实,用凝胶回收试剂盒回收并纯化目的片段。
1.2.5 pMD18-T simple-S100A4构建: 载体连接,反应体系(混匀, 16 ℃过夜,用于转化)见表3。

表3 PCR扩增反应体系
① 转化: 将6 μL连接产物加入60 μL的 JM 109感受态大肠杆菌中,轻轻混匀,置于冰上30 min。42 ℃热休克55 s,立即置于冰上,加入940 μL LB培养基, 37 ℃ 150转/min孵育1 h, 取200 μL涂布于LB琼脂平板(含50 μg/mL 氨苄青霉素纸片, X-Gal, IPTG)上, 37 ℃培养过夜,筛选蓝白阳性克隆。② 富集测序: 挑取数个白色单菌落,接种于5 mL LB培养基中, 37 ℃ 孵育12~16 h。以2 μL菌液为模板进行PCR扩增,筛选出阳性克隆,送1 mL菌液至金域检验公司测序。③ 质粒提取: 取2 mL菌悬液转移至Eppendorf管中, 10 000转/min离心2 min, 弃去上清液,用质粒提取试剂盒提取质粒。取少量用于内容物纯度检测,其余在-20 ℃冰箱中冷冻保存。
1.2.6 pcDNA3.1-S100A4的构建: 重组质粒pMD18- T simple-S100A4以BamH Ⅰ/Hind Ⅲ 双酶切,反应体系见表4。

表4 PCR扩增反应体系
37 ℃过夜,加入1 μL缓冲液终止反应,放入1.2%琼脂糖凝胶电泳,回收纯化目的片段,与BamH Ⅰ/Hind Ⅲ双酶切的真核表达载体PCDNA3.1(+)连接, 16 ℃水浴循环过夜,转化JM109感受态细胞,铺匀所有转化液,筛选出重组克隆,提取质粒,酶切鉴定。见图1。

图1 pcDNA3.1(+)载体质粒谱
1.2.7 细胞的转染: ① 将MKN1细胞按2×105个/孔接种于1.5 mL/孔无抗生素培养皿中, 37 ℃过夜培养; ② 将4 μg质粒 (pcDNA3.1-S100A4/pcDNA3.1-empty)和8 μL Lipofectamin2000在无血清和无抗生素的培养基中稀释至250 μL室温5 min; ③ 用质粒(pcDNA3.1-S100A4/pcDNA3.1-empty)转染MKN1细胞,将质粒与Lipofectamin2000稀释液混合, 30 min室温孵育,将500 μL混合物加入培养皿中,前后轻轻混匀; ④ 6 h后换培养液,根据增殖情况传代,收集不同时间的细胞。
1.2.8 RT-PCR检测S100A4基因转录水平的表达: 转染后总RNA提取及cDNA第一链合成步骤同上。运用Primer 3.0 软件设计引物,β-actin为内参对照。所用引物序列如下:S100A4: 上游引物5′-GATGTGATGGTGTCCACCTT-3′; 下游引物5′-ATTTCTTCCTGGGCTGCTTA-3′;β-actin: 上游引物5′-CTCTTCCAGCCTTCCTTCCT-3′; 下游引物5′-CACCTTCACCGTTCCAGTTT-3′。反应体系同前述; 反应条件:
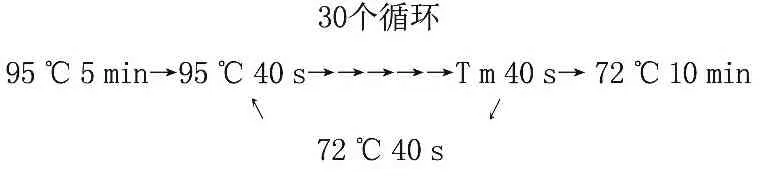
2 结 果
2.1 RT-PCR扩增S100A4基因片段
RT-PCR扩增的产物利用1%琼脂糖凝胶电泳,可见预期的327 bp基因片段,见图2。

M: DL2000标记; 1: RT-PCR扩增S100A4基因。图2 S100A4基因RT-PCR扩增结果
2.2 S100A4基因的序列测定
PCR产物连接克隆载体的测序与GenBank公布序列一致,无突变(见图3)。
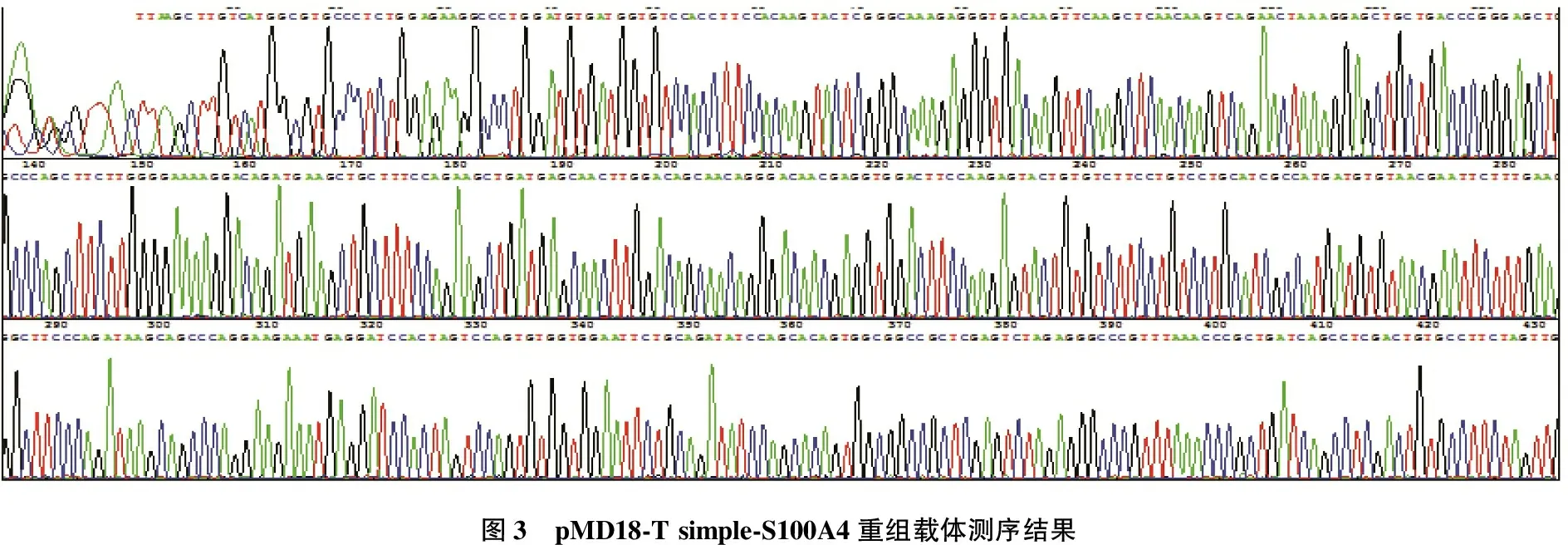
图3 pMD18-T simple-S100A4重组载体测序结果
2.3 pcDNA3.1-S100A4表达载体的构建
构建的pcDNA3.1-S100A4载体经Hind Ⅲ/BamH Ⅰ双酶切鉴定结果见图4。以上结果可以证实真核表达载体pcDNA3.1-S100A4构建成功。
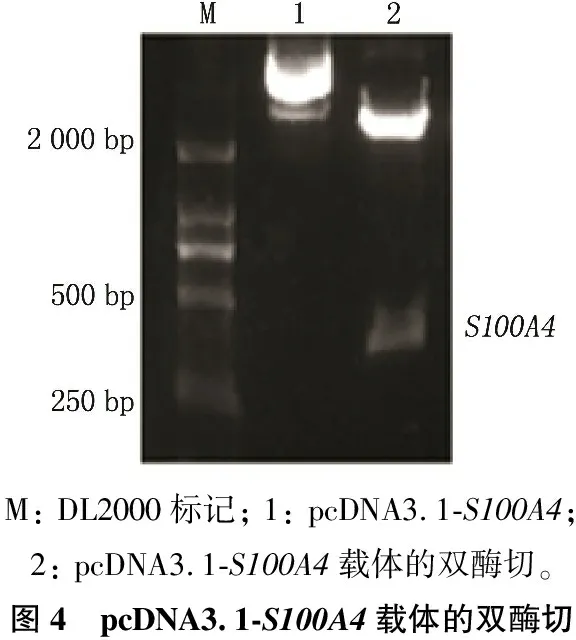
M: DL2000标记; 1: pcDNA3.1-S100A4; 2: pcDNA3.1-S100A4载体的双酶切。图4 pcDNA3.1-S100A4载体的双酶切
2.4 pcDNA3.1-S100A4表达载体的鉴定
在胃癌细胞系MKN1中转染pcDNA3.1-S100A4表达载体,以转染pcDNA3.1空载体和正常未转染的MKN1细胞作为对照。结果表明转染pcDNA3.1-S100A4表达载体48 h后,S100A4mRNA表达水平升高,差异有统计学意义(P<0.01), 见图5。

M: DL2000标记; 1: 未转染的正常MKN1细胞; 2: 转染pcDNA3.1 -阴性对照; 3: 转染pcDNA3.1-S100A4。图5 转染pcDNA3.1-S100A4表达载体的S100A4表达
3 讨 论
S100蛋白首先在牛脑组织中发现,这是一组小分子量的酸性蛋白质,是钙结合蛋白中最大的亚类[2-3]。在21个S100基因家族成员中,其中有15个位于染色体lq21上,其结构在进化过程中是保守的。该段染色体不稳定,易发生多染色体重组,如杂合性丢失、易位、重叠等,与免疫调节和肿瘤预后密切相关[4]。此外,这15个S100家族成员参与了表皮分化复合物(EDC)的形成,该复合物与上皮分化与肿瘤的形成密切相关[5]。
S100A4蛋白作为S100蛋白家族的一员,在小鼠的转染癌基因v-K-ras和v-Ha-ras的正常细胞和成纤维瘤细胞中, S100A4在蛋白水平和mRNA水平异常高表达[6]。 S100A4在许多人类肿瘤中均有表达,研究[7]发现S100A4在大多数早期和晚期乳腺癌组织的细胞膜、细胞质和细胞核中均有表达,因此推测S100A4可能在乳腺癌的发生发展中起作用。研究[8]证明, S100A4在正常胰腺组织、胰腺良性病变和胰腺癌组织中的表达各不相同,在胰腺癌组织中的表达水平最高。RT-PCR检测发现,有95%的胰腺癌细胞S100A4呈过表达,免疫组化分析证实S100A4蛋白在胃癌、甲状腺癌等肿瘤组织中高表达[9-10]。
目前,基因研究的热点不仅包括序列结构,还包括表达调控和功能。分子克隆中常用的携带外源基因的载体主要包括: 病毒类与非病毒类的真核表达载体[11]。本研究通过RT-PCR获得全长S100A4基因。DNA测序结果表明,该基因产物序列与GenBank中S100A4的编码序列完全吻合。采用基因重组技术将S100A4基因插入pcDNA3.1载体中,构建真核表达载体pcDNA3.1-S100A4。双酶切鉴定证实目的基因片段插入到载体的相应位置,证明重组质粒pcDNA3.1-S100A4构建成功。其构建有助于通过细胞转染手段,将S100A4导入细胞内,让S100A4在胃癌细胞中高度表达,为了更深入研究S100A4蛋白对胃癌细胞增殖、侵袭和凋亡的影响奠定了基础。
本研究中,在胃癌细胞系MKN1中转染cDNA3.1-S100A4表达载体,以转染pcDNA3.1空载体和正常未转染的MKN1细胞作为对照。结果显示, pcDNA3.1-S100A4表达载体转染后48 h,S100A4mRNA的表达水平显著增加,表明构建的质粒转染到细胞中并成功表达。本研究探讨了S100A4基因在胃癌细胞中的表达,为进一步探索S100A4基因能否作为胃癌诊断和治疗的靶点奠定了实验基础。
