肿瘤坏死因子-α通过Wnt/β-catenin信号通路对胆囊癌细胞增殖的作用
2023-11-02王郑林常卫才刘心语陈佳伟刘子祥周少波
王郑林, 常卫才, 刘心语, 陈佳伟, 刘子祥, 周少波
(1. 蚌埠医学院第二附属医院 普外科, 安徽 蚌埠, 233000;2. 舟山医院 发热门诊, 浙江 舟山, 316000)
胆囊癌是胆道系统最常见的恶性肿瘤,侵袭性强、致死率高[1], 早期缺乏典型症状和体征,确诊时往往已处于晚期[2-3]。由于其早期发病症状隐匿、恶性程度高、易转移,且放化疗不敏感,胆囊癌预后极差。目前胆囊癌的发病机制尚不明确,但癌症的发生、发展与炎症有关,肿瘤外源性炎症由多种复杂因素引起,即使是细菌和病毒引起的感染也可增大癌症发生的风险[4]。肿瘤坏死因子-α(TNF-α)作为重要的促炎因子,关于TNF-α对胆囊癌细胞的增殖作用鲜有报道。Wnt/β-catenin信号通路是一个高度保守和严格控制的分子机制,负责调节增殖、分化、迁移、遗传稳定性、凋亡和干细胞更新。Wnt/β-catenin信号能够严格控制胚胎发生,包括肝胆管发育、成熟和分化。在正常组织中,Wnt/β-catenin通路处于非活性状态,但在细胞更新和再生过程以及某些病理状态、疾病、恶性前期状态和癌症中,可能会被重新激活[5]。Wnt/β-catenin是参与炎症反应的重要信号通路之一,其信号失调与癌症的发生发展有着重要关系[6]。研究[7]显示,Wnt/β-catenin信号通路参与了胆囊癌的发展。本实验研究TNF-α对胆囊癌细胞系NOZ增殖的影响,并探讨其初步相关分子机制。
1 材料与方法
1.1 材料
胆囊癌细胞系NOZ购自上海通派科技公司; CCK-8、DMEM培养基、胎牛血清、磷酸盐缓冲液(PBS)、胰蛋白酶购自Gibco; β-肌动蛋白/β-actin多抗和辣根过氧化物酶(HRP)标记的兔抗鼠二抗购自美国CST公司; β-链接素抗体(Anti-β-catenin)、致癌基因抗体C-Myc(Anti-c-myc)、抗体细胞周期素D1抗体(anti-cyclin D1)购自Affinity生物公司; TNF-α(人种属)、Wnt/β-catenin信号通路抑制剂IWR-1购自MCE公司; BCA蛋白浓度测定试剂盒和Annexin-FITC/PI试剂盒购自联科生物公司; 显影液购自美国默克公司, SDS-PAGE蛋白凝胶电泳试剂盒购自上海康朗公司。
1.2 方法
1.2.1 细胞培养: NOZ细胞采用含10% FBS、1%双抗的DMEM完全培养基,细胞培养条件为37 ℃、100%湿度、5% CO2的培养箱中培养,观察并及时更换完全细胞培养基1次,待细胞长满80%~90%时选取处于对数生长期且状态良好的细胞用于实验,用胰蛋白酶将细胞消化至脱落, 1 000转/min离心5 min, 弃上清,使用新鲜DMEM完全培养基混匀细胞悬液并进行种板和传代。
1.2.2 CCK-8检测细胞增殖: 取对数生长期且状态良好的细胞, 2 000个细胞/孔接种至96孔板中,待细胞贴壁,弃去原培养液,然后加入TNF-α处理,分为空白组(无细胞且只含培养液)和处理组(采用0、10、20、50、100 ng/mL浓度的TNF-α对细胞进行处理),每组设5个复孔。分别于培养24、48、72 h后弃去原培养液,每孔加入100 μL新的含10%FBS完全培养基和10 μL CCK-8试剂, 37 ℃下避光孵育2.5 h后用酶标仪在450 nm波长处测定吸光度(OD)值。本实验重复测定3次,计算细胞存活率。
1.2.3 细胞生长曲线法: 在96孔板中将胆囊癌细胞株NOZ按照2 000个/孔进行接种,分为TNF-α(20 ng/mL)组、对照(NC)组(0 ng/mL)、抑制剂组[TNF-α (20 ng/mL)+IWR-1], 每组设5个复孔,24、48、72 h后对各组进行细胞计数,本实验重复3次。
1.2.4 流式细胞术检测细胞周期: 接种前用无FBS的DMEM培养48 h, 于24 h后换成含10%FBS的DMEM培养基,按4×105个细胞/瓶接种至细胞培养瓶中,实验分组同上。收集使用胰酶消化后的各组细胞,用4 ℃的PBS缓冲液洗涤3次, 1 000转/min离心5 min, 弃去上清,加入4 ℃预冷的75%冰乙醇1 mL, 于4 ℃冰箱过夜固定细胞,检测前1 000转/min离心5 min, PBS缓冲液洗涤2次,再用100 μL PBS将细胞轻轻吹悬,用300目尼龙网过筛,避光条件下加入1 mL的RNase A和10 μL的PI, 涡旋混匀5~10 s。室温避光孵育30 min。用流式细胞仪检测周期,实验重复3次。
1.2.5 Western blot检测Wnt/β-catenin信号通路相关蛋白: 将3×106个/皿的NOZ胆囊癌细胞株接种于3个皿中,实验分组同上,将细胞按上述分组进行药物处理48 h, 用细胞裂解液提取细胞总蛋白,经BCA蛋白定量检测并调整蛋白浓度。用20 μL/组进行蛋白凝胶电泳分离,从凝胶中转印至PVDF膜上,快速封闭液封闭0.5 h, 用PBS按照1∶1 000稀释β-catenin、c-myc、cyclinD1、β-actin抗体,于4 ℃冰箱下孵育过夜,用TBST将孵好抗体的PVDF膜洗30 min, 每隔10 min更换1次TBST, 二抗按照1∶5 000用PBS稀释,于室温下孵育2 h, 采用ECL工作液进行显色,在曝光成像检测仪中曝光成像。实验重复3次。
1.2.6 平板克隆形成试验: 取对数生长期的NOZ细胞,实验分组同上,用胰蛋白酶消化后,用10%FBS的DMEM培养基重悬细胞悬液,并计数,于6孔板中各实验组接种1 000个细胞/孔,轻轻转动使细胞分散均匀。放置于37 ℃、100%湿度、5% CO2的培养箱中培养2周。每隔3 d进行换液并观察细胞状态,肉眼下可见克隆时终止培养。弃上清, PBS洗涤1次,每孔加入1 mL 4%多聚甲醛固定60 min, 弃去固定液, PBS洗涤1次,每孔加入结晶紫染液1 mL, 染细胞15 min。PBS洗涤细胞数次至染色液褪去,在干燥空气中倒扣晾干。使用数码相机进行拍照, AI抠照后使用Image J来进行相对面积统计分析。
1.3 统计学分析
使用GraphPad Prism 9进行相关统计学分析,数据以均数±标准差表示,使用两样本t检验对2组间的差异进行分析, Dunnett-t检验进行两两比较,单因素方差One-way ANOVA分析多组之间的差异,P<0.05为差异有统计学意义。
2 结 果
2.1 TNF-α对胆囊癌细胞系NOZ增殖的结果
采用TNF-α处理(20 ng/mL)的细胞生长速度24 h内差异无统计学意义(P>0.05), 48、72 h细胞生长速度显著增快,且48 h的细胞生长速度增速大于72 h, 差异有统计学意义(P<0.01)。TNF-α对胆囊癌细胞系NOZ增殖作用的最佳浓度为20 ng/mL, 最佳作用时间为48 h, 表明TNF-α可以促进胆囊癌细胞系NOZ的增殖,见图1。

A: 不同浓度TNF-α对NOZ细胞增殖的影响(与0 ng/mL比较, ∗∗P<0.01, ∗∗∗∗P<0.000 1); B: 不同时点NOZ细胞的增殖(与NC比较, ∗∗∗∗P<0.000 1)。图1 不同浓度TNF-α和不同时点NOZ细胞的增殖
2.2 TNF-α对胆囊癌细胞系NOZ周期的影响
本研究采用流式细胞仪检测TNF-α对胆囊癌细胞系NOZ周期的影响,探讨TNF-α促进胆囊癌细胞增殖的机制,见图 2。与对照组比较,采用TNF-α(20 ng/mL)处理的G1期细胞占比降低,S期细胞占比增高,差异有统计学意义(P<0.000 1), G2期细胞占比降低,差异有统计学意义(P<0.05); 采用TNF-α(20 ng/mL)+IWR-1处理的G1期细胞占比增高,S期细胞占比降低,G2期细胞占比增高,差异有统计学意义(P<0.05)。研究结果显示, TNF-α可能通过加速细胞周期G1→S→G2向M期转化促进胆囊癌细胞的增殖。
2.3 TNF-α对胆囊癌细胞系NOZ中Wnt/β-catenin信号通路的结果
采用Western blot方法检测胆囊癌细胞系NOZ在TNF-α 20 ng/mL条件下Wnt/β-catenin信号通路相关基因(cyclinD1、β-catenin、c-myc)的蛋白表达。与对照组比较,实验组细胞(TNF-α 20 ng/mL)中cyclinD1、β-catenin、c-myc基因的蛋白表达含量升高,使用Wnt通路抑制剂IWR-1+TNF-α(20 ng/mL)处理后, cyclinD1、β-catenin、c-myc蛋白表达下降,差异有统计学意义(P<0.01), 表明TNF-α可能通过激活Wnt/β-catenin信号途径促进胆囊癌细胞NOZ增殖,见图3。

A: TNF-α(20 ng/mL)处理细胞的流式细胞仪检测图; B: 对照组细胞的流式细胞仪检测图; C: 采用TNF-α(20 ng/mL)+IWR-1处理的流式细胞仪检测图; D: 细胞周期分布图。图2 TNF-α对胆囊癌细胞NOZ周期的影响
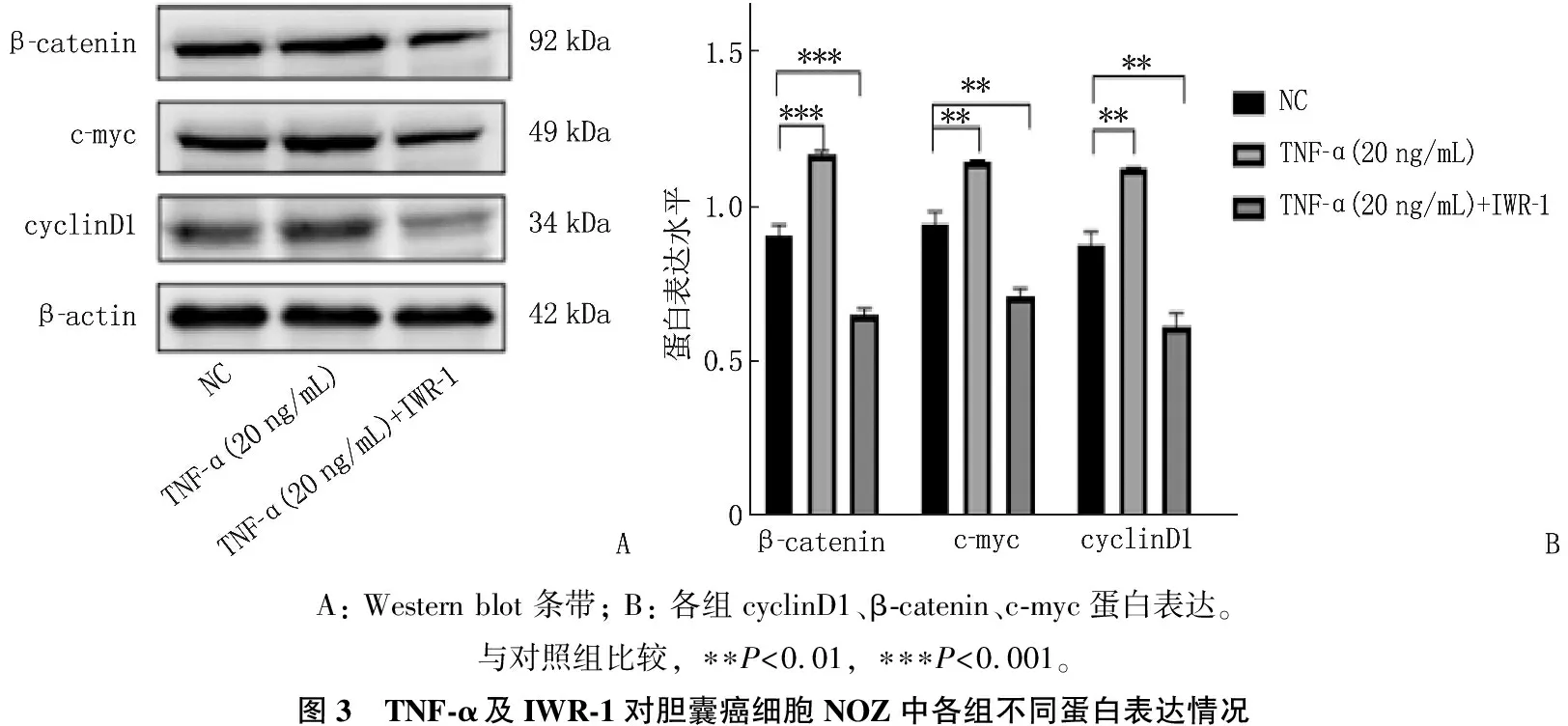
A: Western blot 条带; B: 各组cyclinD1、β-catenin、c-myc蛋白表达。与对照组比较, ∗∗P<0.01, ∗∗∗P<0.001。图3 TNF-α及IWR-1对胆囊癌细胞NOZ中各组不同蛋白表达情况
2.4 TNF-α对胆囊癌细胞系NOZ增殖能力的影响
本研究采用平板克隆形成试验检测TNF-α对胆囊癌细胞系NOZ的增殖能力。实验组细胞(TNF-α 20 ng/mL)中胆囊癌细胞系NOZ克隆数量大于对照组,差异有统计学意义(P<0.05)。使用Wnt通路抑制剂IWR-1+TNF-α(20 ng/mL)处理后,胆囊癌细胞系NOZ克隆数量少于对照组,差异有统计学意义(P<0.05)。结果表明,TNF-α可能增强胆囊癌细胞的增殖能力。见图4。

A: 细胞克隆图片; B: 细胞克隆数量。与对照组比较, ∗P<0.05。图4 TNF-α及IWR-1对胆囊癌细胞系NOZ的克隆数量的影响
3 讨 论
胆囊癌是一种高度恶性的肿瘤,预后不佳。研究[8]表明,胆囊癌的发生是由多因素参与的多阶段复杂过程。流行病学数据表明,由胆囊或胆囊结石感染引起的慢性炎症可增高个体易患胆囊癌的概率。持续的局部炎症反应可能通过诱导基因改变,促进癌细胞的生存和增殖,抑制凋亡,刺激血管生成和转移,促进胆囊癌的发生和进展[9]。然而,胆囊癌的准确发病机制尚不清楚。目前,炎症已被确定为癌症的第7个特征[10]。此外,高达25%癌症与慢性炎症有关[11]。在炎症介质中, TNF-α是一种主要的促炎细胞因子,在最初的炎症反应中由巨噬细胞产生,诱导自身分泌并刺激其他炎症细胞因子和趋化因子产生。肿瘤细胞也可分泌TNF-α, 并与肿瘤发生有关,包括肿瘤细胞转化、增殖、血管生成、侵袭和转移。本研究发现,经TNF-α 20 ng/mL处理胆囊细胞系NOZ后,其生长速度快于对照组细胞。细胞周期进一步分析提示, TNF-α 20 ng/mL处理后可明显加速胆囊癌细胞周期G1→S→G2最终向M期转化。因此,可以推测TNF-α促进胆囊癌细胞增殖可能与其加速细胞细胞周期转化有关。
研究[12]显示,炎症微环境中TNF-α可通过多种信号通路促进细胞的增殖。TNF-α参与许多生理和病理细胞途径,包括细胞增殖、分化和死亡,调节不同细胞和分子的免疫反应、肿瘤的局部转移、血管侵袭以及肿瘤的破坏。TNF-α多见于肾细胞癌、结肠直肠腺癌、非霍奇金淋巴瘤(NHL)和肉瘤,可在一些肿瘤中作为强有力的生物标志物和预后因子[13-14]。TNF-α表达量的变化及其基因中的单核苷酸多态性(SNPs)甚至可能是肿瘤发展变化中的里程碑性标志物[15]。TNF-α被认为是肿瘤基因启动子,并且在结肠癌和卵巢癌中存在自分泌表达。在人胆囊癌细胞系SGC-996中沉默TNF-α显著抑制了肿瘤的增殖和侵袭,但TNF-α的沉默并不能诱导肿瘤细胞凋亡。TNF-α是肿瘤微环境中促进肿瘤细胞增殖和侵袭的关键细胞因子。在胰腺癌的原位小鼠模型中,用TNF-α抗体治疗可导致肿瘤生长和转移减少[16]。在动物胸部肿瘤、皮肤肿瘤和胃肠道肿瘤的研究中发现,肿瘤细胞的生长和转移与肿瘤微环境中TNF-α的含量有关[17]。在对前列腺恶性肿瘤的研究[18]中发现, TNF-α的表达量与恶性程度、复发、转移和预后相关。因此,肿瘤微环境中的关键促炎因子TNF-α通过调控肿瘤细胞增殖对肿瘤的形成和进展发挥作用。
目前研究[19]已证实, Wnt/β-catenin信号通路影响肿瘤细胞的生长、转移,该信号通路的异常参与了多种癌症的发病机制。β-catenin蛋白是一种与许多癌症基因有关的转录因子, Wnt/β-catenin信号通路的一个标志是β-catenin蛋白的稳定。最新研究[20-21]证据表明, Wnt/β-catenin信号的异常促进肝癌的发展,包括肝细胞癌(HCC)和胆管癌(CCA), 是成人中最常见的2种原发性肝癌。Wnt/β-catenin通路还可能与许多卵巢癌亚型的致癌作用有关, Wnt/β-catenin靶基因调节细胞增殖和凋亡,从而介导上皮性卵巢癌细胞的启动和进展。Wnt/β-catenin通路在化疗耐药中起重要作用,可以作为卵巢癌化疗增敏的靶点。Wnt/β-catenin通路的激活对前列腺细胞增殖、分化和上皮-间质转化有影响[22]。本实验结果发现, TNF-α促进胆囊癌细胞中cyclinD1、β-catenin、c-myc蛋白的表达。IWR-1抑制该信号通路后, TNF-α对胆囊癌细胞促增殖作用明显降低。Western blot结果显示, IWR-1减弱了TNF-α对胆囊癌细胞中Wnt/β-catenin信号通路相关基因cyclinD1、β-catenin、c-myc等蛋白表达。上述研究表明, TNF-α通过Wnt/β-catenin信号通路促进胆囊癌细胞增殖。
目前, Wnt/β-catenin信号通路被TNF-α激活的分子机制尚不清楚。作为一种潜在的炎症因子, TNF-α可促进肿瘤细胞增殖、迁移和侵袭,诱导化疗耐药性和上皮间质转化,还可以激活NF-κB信号,上调趋化因子、生长因子和转录因子及其他细胞因子的表达,加速肿瘤的发生[23-25]。TNF-α的表达在各种类型的癌症中显著增加,并且通常与患者的不良预后相关,因此TNF-α被认为是关键的促肿瘤细胞因子[24]。此外,研究[26]表明, TNF-α可激活结肠NCM460s细胞中NF-κB和Wnt/β-catenin通路。Wnt/β-catenin通路的负性调节因子APC的蛋白水平经TNF-α刺激0.5 h后下调,而另一个负性调节因子GSK3β磷酸化水平上调。然后,在TNF-α诱导的NCM460s细胞中,可观察到经典Wnt/β-catenin级联反应中的中心介质β-catenin的去磷酸化、积累和核转运。研究[27]发现,胆囊癌细胞的增殖受多种因素的影响。本研究证实, TNF-α促进胆囊癌细胞的增殖,进一步表明靶向TNF-α及其涉及的细胞内途径可能被证明有助于治疗胆囊癌,为人胆囊癌的治疗提供了新的分子靶点和用药新思路。但胆囊癌患者的总体生存率较低,对其发病机制和致癌作用的分子研究较少,探讨TNF-α对肿瘤细胞的作用,可以更好地了解炎症与胆囊癌之间的关系,改善胆囊癌患者的预后。TNF-α激活Wnt/β-catenin信号通路的分子机制需要更深一步的研究,从而可以更加全面了解胆囊癌进展的机制。
