环指蛋白44基因表达对胃癌细胞增殖和凋亡的调节作用及机制
2023-11-02孙焕焕
师 文, 高 楠, 孙焕焕, 韩 炜
(1. 西安交通大学第一附属医院 消化内科, 陕西 西安, 710061;2. 陕西省人民医院 肿瘤外科, 陕西 西安, 710068)
胃癌是世界上最常见的消化系统恶性肿瘤之一, 2020年全球新增确诊病例超过10万例,发病率位于恶性肿瘤第5位[1]。胃癌早期缺乏特异性症状,诊断存在困难,多数患者确诊后易错过最佳治疗时机,治疗后5年生存率也不足20%[2], 病死率在所有恶性肿瘤中位居第4位[3-4]。近年来胃癌的发病率和病死率逐年下降, 2022年新增胃癌病例51万,死亡病例40万[5]。胃癌发病机制涉及多种因素、发育过程中的多个步骤以及多重基因突变和异常[6-7]。E3泛素连接酶家族在各种恶性肿瘤的发生、发展以及耐药中发挥重要作用。环指蛋白44(RNF44)是一种新发现的E3泛素连接酶,参与黑色素瘤、口腔鳞状细胞癌和胶质瘤等发生和发展[8-10]。目前,RNF44基因作用的分子机制及其与胃癌进展的关系仍有待进一步探索。本研究采用细胞生物学和动物实验等方法探讨RNF44基因对胃癌发生、发展的影响和机制,现将结果报告如下。
1 材料与方法
1.1 实验材料
1.1.1 细胞株来源: 细胞株AGS、MGC-803、MKN28、MKN45及正常胃黏膜GES-1细胞源自ATCC细胞库。
1.1.2 实验动物: 无特定病原体(SPF)级雄性裸鼠12只,体质量18~20 g, 购自上海斯莱克实验动物有限公司,动物合格证编号为20170005034573, 适应性饲养1周后开始造模。
1.1.3 主要试剂: 胎牛血清(美国Gibco公司), RPMI-1640培养液(美国Hyclone公司),青链霉素混合液、0.25%胰蛋白酶消化液(北京索莱宝科技有限公司), CCK-8试剂(美国Signalway antibody 公司), Trizol试剂、LipofectamineTM2000试剂盒(美国Invitrogen公司),逆转录试剂盒(加拿大Fermentas公司), SYBR Green PCR试剂盒(美国Thermo公司), RIPA裂解液、BCA蛋白定量试剂盒、Tris-HCl电泳缓冲液、蛋白上样缓冲液(北京索莱宝科技有限公司), RNF44一抗(美国NOVUS公司), Ki-67、AKT、P-AKT(美国Abcam公司), GAPDH一抗(美国Proteintech公司), Annexin V-FITC细胞凋亡检测试剂盒、HRP标记二抗、Alexa Fluor 488标记山羊抗兔IgG(H+L)、4′, 6-二脒基-2-苯基吲哚(DAPI)和防淬灭封片剂(上海碧云天公司)。shRNF44病毒及对应空载病毒shNC、oeRNF44病毒及对应空载病毒Vector(本实验构建)。RNF44和GAPDH引物序列和产物长度见表1。

表1 引物序列和产物长度
1.1.4 主要仪器: Forma 3111型CO2恒温培养箱(美国Thermo公司), DHG-9023A型恒温烘箱(上海恒一科学仪器有限公司), TDZ4-WS型离心机(上海卢湘仪离心机仪器有限公司), TG-16M型低温冷冻离心机(上海卢湘仪离心机仪器有限公司), K30型旋涡振荡器(上海青浦泸西仪器厂), PRO200型电动匀浆机(上海弗鲁克科技发展有限公司), CytoFLEX型流式细胞仪(美国Beckman Coulter公司), ABI-7300型Real-time检测仪(美国ABI公司), DNM-9602型酶标仪(北京普朗新技术有限公司), XDS-500C型显微镜(上海蔡康光学仪器有限公司), ECLIPSE Ni型荧光显微镜(日本NIKON公司), SQ2125型石蜡切片机和PPTHK-21B型摊片机(湖北徕克医疗仪器有限公司)。
1.2 实验方法
1.2.1 细胞培养和传代: 胃癌细胞株AGS、MGC-803、MKN28、MKN45及正常胃黏膜GES-1细胞复苏后,采用含10%胎牛血清、1%双抗(青链霉素混合液)的RPMI-1640培养液于37 ℃、5%CO2恒温培养箱中进行培养, 24 h更换1次培养液,待细胞生长至80%~90%时进行传代。加入0.25%胰蛋白酶液消化细胞1~2 min, 显微镜下观察细胞变圆即可加入新鲜培养液终止消化, 1 000 转/min室温离心5 min, 加入适量新鲜培养液反复轻轻吹打,使细胞分散成单细胞悬液,另取培养瓶,将单细胞悬液加入培养瓶中继续培养进行后续实验。采用定量聚合酶链反应(Q-PCR)和Western blot检测各细胞中RNF44的基因和蛋白表达。
1.2.2RNF44基因干扰慢病毒转染MKN45细胞株的构建: 收集处于对数生长期的MKN45细胞,按照每孔5×105的密度铺入6孔培养板中,分为Control组、shNC组和shRNF44组。每孔中加入2 mL完全培养基,放入37 ℃、5%CO2培养箱内培养,细胞生长至70%左右进行慢病毒转染。Control组每孔加入2 mL完全培养基,其余各组每孔分别加入siNC和shRNF44各5 μL以及1 μL聚凝胺(5 μg/μL), 于37 ℃、5%CO2恒温培养箱中培养24 h, 然后更换为完全培养基继续培养72 h, 采用Q-PCR和Western blot检测RNF44 的基因和蛋白表达效率,确认RNF44基因干扰慢病毒转染MKN45细胞株是否构建成功。
1.2.3RNF44基因干扰慢病毒转染MKN45细胞株增殖、凋亡和AKT信号蛋白的测定: 按1.2.2方法构建RNF44基因干扰慢病毒转染MKN45细胞株,各组细胞转染24 h, 更换为完全培养基,继续进行培养,采用CCK-8测定细胞增殖情况,采用流式细胞术检测细胞凋亡情况,采用Western blot检测RNF44、AKT和p-AKT蛋白的表达。
1.2.4RNF44基因过表达慢病毒转染AGS细胞株的构建: 收集处于对数生长期的AGS细胞,按照5×105个/孔的密度铺入6孔培养板中,分为Control组、Vector组和oeRNF44组,每孔中加入2 mL培养基,放入37 ℃、5%CO2培养箱内培养,细胞生长至70%左右进行慢病毒转染。Control组每孔加入2 mL完全培养基,其余各组每孔分别加入Vector和oeRNF44各5 μL以及1 μL 聚凝胺(5 μg/μL), 于37 ℃、5%CO2恒温培养箱中培养24 h, 然后更换为完全培养基继续培养72 h。采用Q-PCR和Western blot检测RNF44 的基因和蛋白表达效率,确认RNF44基因过表达慢病毒转染AGS细胞株是否构建成功。
1.2.5RNF44基因过表达慢病毒转染AGS细胞株增殖、凋亡和AKT信号蛋白的测定: 按1.2.2方法构建RNF44基因过表达慢病毒转染AGS细胞株,各组细胞转染后24 h, 更换为完全培养基,继续进行培养,采用CCK-8测定细胞增殖情况,采用流式细胞术检测细胞凋亡情况,采用Western blot检测RNF44、AKT和p-AKT蛋白的表达。
1.2.6 AKT通路抑制剂LY294002对RNF44基因过表达AGS细胞株增殖、凋亡和AKT信号蛋白影响的测定: 按1.2.2方法构建RNF44基因过表达慢病毒转染AGS细胞株,各组细胞转染后24 h, 更换为分别含AKT通路抑制剂LY294002(20 μmol/L)或溶媒(Vehicle)完全培养基,继续进行培养,采用CCK-8测定细胞增殖情况,采用Q-PCR和Western blot检测相关蛋白表达效率。
1.2.7 MKN45细胞株构建的裸鼠皮下瘤模型实验: 12只裸鼠随机分为shNC组(n=6)和shRNF44组(n=6)。各组裸鼠酒精棉球消毒,shNC组裸鼠于腋下皮下接种MKN45细胞100 μL(2×106个), shRNF44组裸鼠于腋下皮下接种RNF44干扰后的MKN45细胞100 μL(2×106个)。接种后将不同组别的裸鼠分笼饲养,定期喂水和饲料,定期更换垫料。待注射细胞1周后,每3 d游标卡尺测量肿瘤大小。接种33 d时处死,取出肿瘤组织称重并拍照,将肿瘤组织分为2个部分,分别进行免疫荧光染色实验和Western blot实验。免疫荧光染色实验: 将肿瘤组织置于10%福尔马林中固定48 h, 流动冲洗后,采用梯度浓度乙醇(50%→70%→85%→95%→100%)进行退水,脱水后经二甲苯透明(2 h×2次)、浸蜡、包埋、常规切片、烤片,二甲苯脱蜡,采用梯度浓度乙醇(100%→95%→85%→75%)进行水化,经柠檬酸钠缓冲溶液高压修复,滴加一抗于4 ℃孵育过夜,滴加二抗,室温孵育1 h, 加入经DAPI稀释后的防淬灭封片剂封片,荧光显微镜下观察拍片(放大倍数400倍)。另一部分于-20 ℃冻存,后续采用Western blot检测肿瘤组织RNF44、AKT、p-AKT蛋白的表达。
1.2.8 CCK-8检测细胞增殖实验: 各组细胞慢病毒转染后更换为完全培养基,调整细胞悬液浓度(1×104个/mL), 于37 ℃、5%CO2恒温培养箱中进行培养,分别在0、12、24、48、72 h后,加入CCK-8试剂继续培养1 h, 用酶标仪测定450 nm波长吸光度,计算各组细胞的增殖率。
1.2.9 流式检测细胞凋亡实验: 各组细胞慢病毒转染后更换为完全培养基,调整细胞悬液浓度(1×104个/mL), 于37 ℃、5%CO2恒温培养箱中培养72 h, 以预冷后的磷酸盐缓冲液(PBS)冲洗3遍,离心(1 000 g×5 min)、弃上清,收集细胞,用PBS轻轻重悬细胞并计数。取5×104个重悬细胞,离心(1 000 g×5 min), 弃上清,加入195 μL结合缓冲液重悬细胞,分别加入Annexin V-FITC 10 μL和碘化丙啶(PI) 5 μL进行染色,避光室温孵育15 min, 置于冰浴,用流式细胞仪检测凋亡情况。
1.2.10 Q-PCR实验: 各组细胞慢病毒转染后更换为完全培养基,调整细胞悬液浓度(1×104个/mL), 于37 ℃、5%CO2恒温培养箱中培养72 h, 用PBS 清洗细胞后采用TRIzol试剂提取RNA。采用酶标仪检测260 nm和280 nm处的吸光度值(OD260 nm/OD280 nm: 1.8~2.0)。参照逆转录试剂盒说明书,将RNA逆转录为cDNA。逆转录条件为: 37 ℃, 15 min; 85 ℃, 5 s; 4 ℃ 10 min。取cDNA 2 μL、上游及下游引物各1 μL、TB Green Premix Ex TaqTM Ⅱ 12.5 μL和灭菌水8.5 μL组成的反应体系,按照SYBR Green qPCR 试剂盒说明书进行qRT-PCR。PCR条件: 95 ℃变性15 s, 60 ℃ 退火60 s, 72 ℃ 60 s, 共40 个循环, 72 ℃延展5 min。以GAPDH作为内参,采用2-△△Ct法计算RNF44mRNA的相对表达量。
1.2.11 Western blot实验: 各组细胞慢病毒转染后更换为完全培养基,调整细胞悬液浓度(1×104个/mL), 于37 ℃、5%CO2恒温培养箱中培养72 h, 加入RIPA裂解液冰上裂解,离心,收集上清液。BCA法进行蛋白定量,于-20℃保存。将蛋白样品于恒温水浴锅中煮沸5 min 变性。取蛋白上清液50 μg于SDS-PAGE凝胶恒压(120 V)电泳2 h, 转移至PVDF膜(0.3 A×2 h), 于3%脱脂奶粉中室温封闭2 h, TBST溶液洗膜(10 min/次×3次),分别滴加一抗溶液p-Cdc2、Cdc2、p-AKT、AKT、p-PI3K、PI3K、p-MTOR、MTOR及GAPDH孵育,于4 ℃过夜, TBST溶液洗膜(10 min/次×3次),再与相应二抗室温孵育1 h。TBST溶液洗膜(10 min/次×3次),用ECL plus试剂发色液显色,化学发光信号采用ChemiDoc MP凝胶成像系统检测。
1.3 统计学分析
采用SPSS 22.0软件进行统计分析。各组数据以均值±标准差表示,数据采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 不同胃癌细胞株RNF44 的基因和蛋白的
表达水平
不同胃癌细胞株RNF44的基因和蛋白的表达水平不同, RNF44 的基因和蛋白的表达水平呈正相关(r=0.994,P<0.05), 其中GES-1细胞株RNF44的基因和蛋白表达水平最低, MKN45细胞株RNF44的基因和蛋白表达水平最高,见图1、图2。
2.2 RNF44基因干扰慢病毒转染MKN45细胞株的构建
MKN45细胞株经RNF44基因干扰慢病毒转染后, RNF44的基因和蛋白表达水平降低,差异有统计学意义(P<0.05), 而空白对照组(Control组)与空载组(shNC组)细胞RNF44的基因和蛋白表达水平差异无统计学意义(P>0.05), 说明RNF44基因干扰慢病毒转染MKN45细胞株的构建成功,见图3、图4。
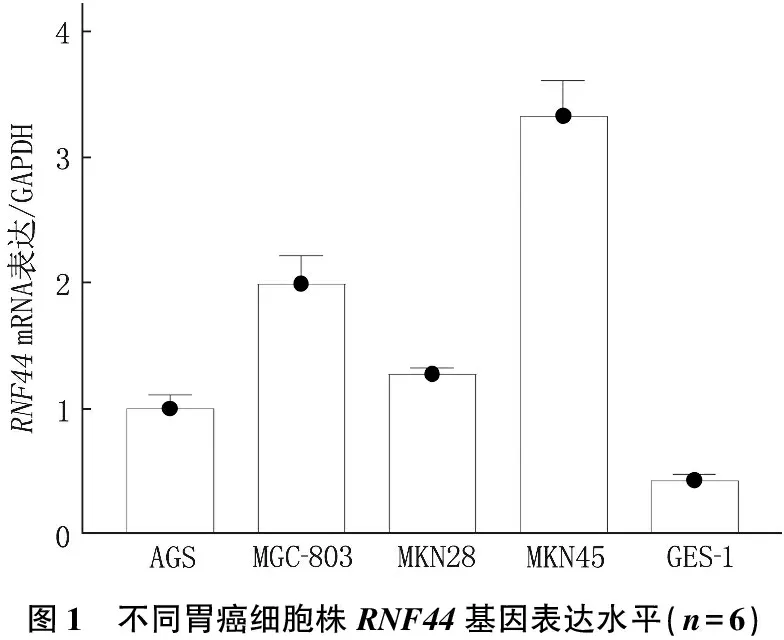
图1 不同胃癌细胞株RNF44基因表达水平(n=6)
2.3 RNF44基因过表达慢病毒转染AGS细胞株的构建
AGS细胞株经RNF44基因过表达慢病毒转染后(oeRNF44组), RNF44的基因和蛋白表达水平升高,差异有统计学意义(P<0.05), 而空白对照组(Control组)与空载组(Vector组)细胞RNF44的基因和蛋白表达水平差异无统计学意义(P>0.05), 表明RNF44基因过表达慢病毒转染AGS细胞株的构建成功,见图5、图6。
2.4 RNF44基因干扰慢病毒转染MKN45细胞株增殖、细胞凋亡和AKT信号通路蛋白的表达
RNF44基因干扰慢病毒转染MKN45细胞株增殖培养48、72h增殖能力降低,差异有统计学意义(P<0.05), 见图7; 培养72 h时,细胞早期和晚期凋亡率均增加,差异有统计学意义(P<0.05), 见图8;RNF44基因干扰慢病毒转染MKN45细胞株RNF44和p-AKT蛋白表达水平降低,差异有统计学意义(P<0.05), 而AKT蛋白表达无显著变化(P>0.05), 见图9。

图2 不同胃癌细胞株RNF44蛋白表达水平(n=6)
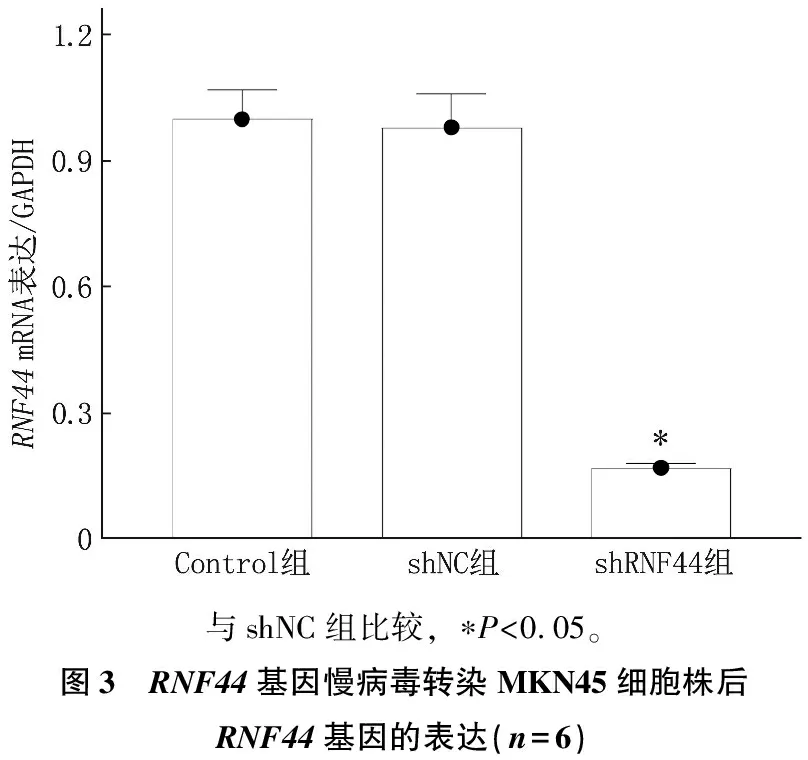
与shNC组比较, ∗P<0.05。图3 RNF44基因慢病毒转染MKN45细胞株后RNF44基因的表达(n=6)
2.5 RNF44基因过表达慢病毒转染AGS细胞株增殖、细胞凋亡和AKT信号通路蛋白的表达
RNF44基因过表达慢病毒转染AGS细胞株增殖培养48、72 h增殖能力增加,差异有统计学意义(P<0.05),见图10; 培养72 h时,细胞早期和晚期凋亡率均降低,差异有统计学意义(P<0.05), 见图11; 培养72 h时,RNF44基因干扰慢病毒转染MKN45细胞株RNF44和p-AKT蛋白表达水平增加,差异有统计学意义(P<0.05), 而AKT蛋白表达无显著变化(P>0.05), 见图12。
2.6 AKT通路抑制剂对RNF44基因过表达AGS细胞株增殖、凋亡和相关信号通路的影响
AKT抑制剂(LY294002)可使正常AGS细胞或RNF44基因过表达AGS细胞株增殖能力降低,细胞早期和晚期凋亡率均升高, p-AKT蛋白表达水平降低,差异均有统计学意义(P<0.05), 而AKT蛋白表达无显著变化(P>0.05), 见图13、图14、图15。

与shNC组比较, ∗P<0.05。图4 RNF44基因慢病毒转染MKN45细胞株后RNF44蛋白的表达(n=6)
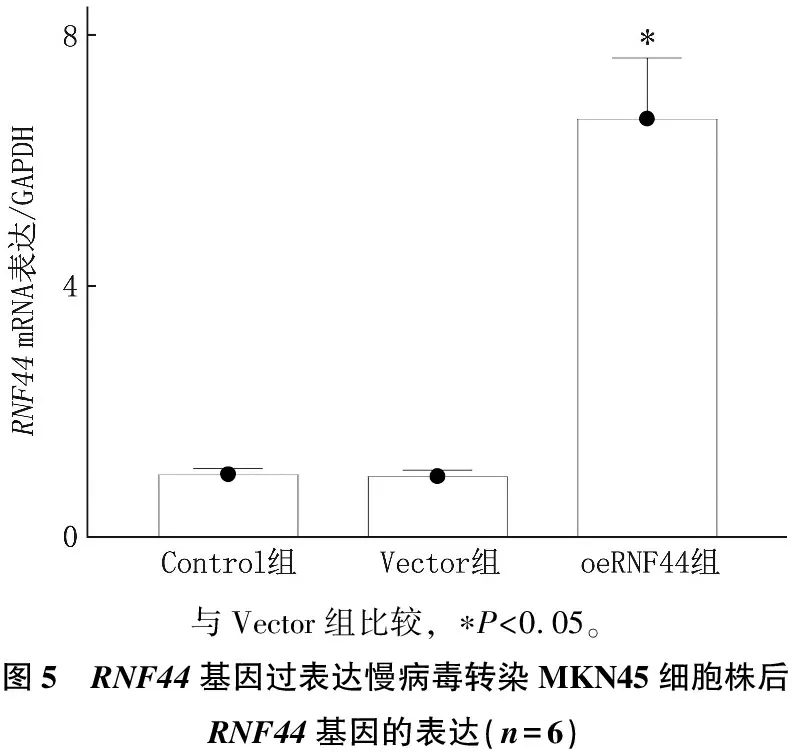
与Vector组比较, ∗P<0.05。图5 RNF44基因过表达慢病毒转染MKN45细胞株后RNF44基因的表达(n=6)
2.7 MKN45细胞株构建的裸鼠皮下瘤模型实验
实验结束时, shRNF44 组裸鼠肿瘤组织大小和质量均较shNC组降低,差异有统计学意义(P<0.05), 见图16; 免疫荧光染色结果显示, shRNF44 组裸鼠肿瘤组织Ki-67表达较shNC组降低,差异有统计学意义(P<0.05), 见图17; Western blot检测结果显示, shRNF44 组裸鼠肿瘤组织RNF44和p-AKT蛋白表达较shNC组降低,差异有统计学意义(P<0.05), 2组裸鼠肿瘤组织AKT蛋白表达基本一致,见图18。
3 讨 论
针对胃癌的治疗手段包括手术切除、化疗以及放疗等[11]。目前,手术被认为是唯一的根治性治疗方法。尽管胃癌的治疗已取得较好的进展,但因其存在确诊晚、复发、化疗副作用和耐药等问题,导致整体治疗效果不理想[12]。研究开发预防胃癌复发和转移的治疗手段也成为了推动癌症治疗的重大挑战[13]。因此,深入分析胃癌发生、发展的分子机制,寻找新的治疗靶点,不断开发新的治疗方案,对提高胃癌患者的生存率极为重要[14-15]。

与Vector组比较, ∗P<0.05。图6 RNF44基因过表达慢病毒转染MKN45细胞株后RNF44蛋白的表达(n=6)
泛素作为一种在真核生物中普遍存在的小分子调节蛋白,可在翻译后水平修饰底物蛋白,参与细胞的增殖、分化、凋亡及DNA修复等生理活动的调控[16], 其介导的底物传递过程需要泛素激活酶E1、泛素结合酶E2及泛素连接酶E3的共同参与[17]。泛素连接酶E3可被分为RING家族、HECT家族及RBR家族,其中RING家族成员众多,是最大的泛素连接酶家族, RING家族中RNF2、RNF6、RNF43、RNF128、RNF180与胃癌的发生、发展或临床预后相关。ZHANG J F等[18]研究显示,胃癌细胞中RNF2mRNA和其蛋白水平明显增加,敲除RNF2 可抑制胃癌细胞的活力并诱导G1期细胞周期停滞,并上调细胞周期相关基因p21和p27的mRNA及其蛋白水平。RNF6在胃癌组织中表达水平均有增高,还可促进胃癌细胞的增殖[19]。RNF43在胃癌组织高表达,并且RNF43高表达与患者发生远处转移、淋巴结转移和总生存期显著缩短相关,因此成为胃癌侵袭、转移和不良预后的原因之一[20]。路德荣等[21]研究发现, RNF128低表达的胃癌患者总生存期、首次进展生存期、无进展生存期低于RNF128高表达患者,并且细胞实验证明RNF128通过泛素化稳定Axin1蛋白抑制胃癌的发生发展。另外, RNF180可抑制胃癌细胞的生长、增殖能力,促进胃癌细胞凋亡[22]。RNF44是由LI Y Y等[8]于2017年发现的一种新的E3泛素连接酶,该蛋白负责BRAF抑制剂耐药黑色素瘤细胞中AMPK-β1的降解,并且ERK/AKT过度激活诱导转录因子CREB而导致RNF44表达上调。LUO F F等[9]研究发现,口腔鳞状细胞癌组织和SCC-9细胞中RNF44的表达上调,特别在SCC-9耐药细胞中表达更高,降低RNF44表达可通过下调miR-125a-5p而逆转SCC-9耐药细胞对顺铂耐药性和细胞糖酵解作用。
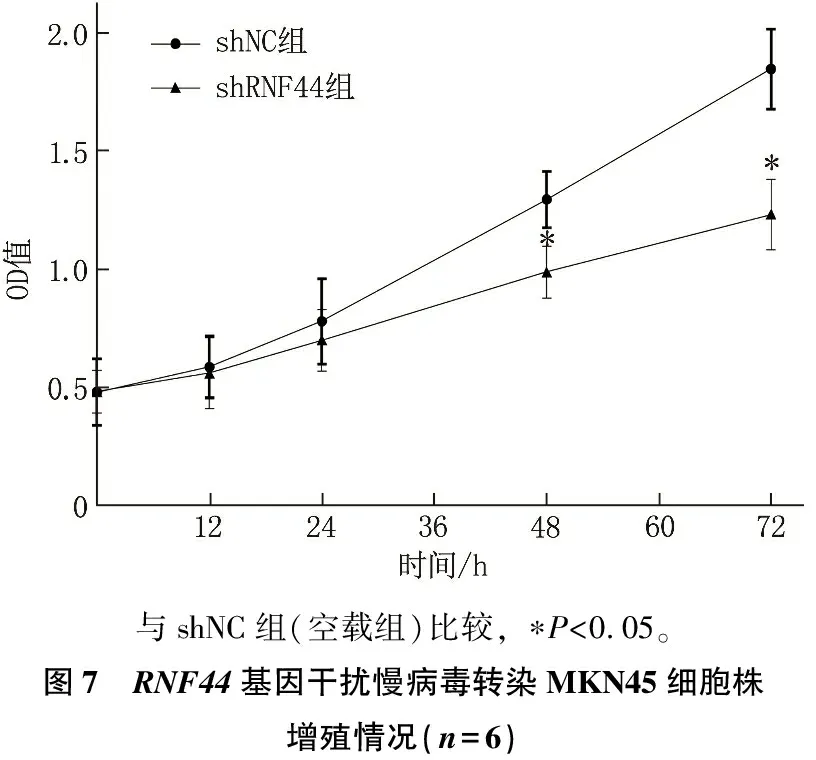
与shNC组(空载组)比较, ∗P<0.05。图7 RNF44基因干扰慢病毒转染MKN45细胞株增殖情况(n=6)

与shNC组(空载组)比较, ∗P<0.05。图8 RNF44基因干扰慢病毒转染MKN45细胞凋亡情况(n=6)

与shNC组比较, ∗P<0.05。图9 RNF44基因干扰慢病毒转染MKN45细胞RNF44、AKT和p-AKT蛋白情况(n=6)
本研究结果显示,胃癌AGS、MGC-803、MKN28、MKN45细胞株以及正常胃黏膜GES-1细胞中RNF44的基因和蛋白表达水平不同,其中GES-1细胞株RNF44的基因和蛋白表达水平最低, MKN45细胞株RNF44的基因和蛋白表达水平最高,说明RNF44可能参与胃癌细胞的发生和发展。细胞的异常增殖是恶性肿瘤最重要的特征之一,细胞实验结果显示, MKN45细胞株经RNF44基因干扰慢病毒转染后, RNF44的基因和蛋白表达水平显著降低,同时培养48、72 h时细胞增殖能力显著降低(P<0.05), AGS细胞株经RNF44基因过表达慢病毒转染后, RNF44的基因和蛋白表达水平显著升高,同时培养48、72 h时细胞增殖能力显著增加,并且加入AKT抑制剂可抑制细胞增殖能力,说明RNF44可显著调节胃癌细胞的增殖作用。在裸鼠实验中,shRNF44 组裸鼠肿瘤组织大小和质量均较shNC组显著降低, Ki-67表达较shNC组显著降低,进一步证实RNF44可抑制胃癌的生长。肿瘤的产生是因细胞增殖和死亡失衡导致,其中细胞凋亡受到抑制是非常重要的原因。本研究中, MKN45细胞株经RNF44基因干扰慢病毒转染后,细胞早期和晚期凋亡率显著升高(P<0.05), AGS细胞株经RNF44基因过表达慢病毒转染后,细胞早期和晚期凋亡率显著降低,并且加入AKT抑制剂可促进细胞凋亡,说明RNF44可显著调节胃癌细胞的凋亡作用。

与Vector组(空载组)比较, ∗P<0.05。图10 RNF44基因过表达慢病毒转染AGS细胞株增殖情况(n=6)

与Vector组(空载组)比较, ∗P<0.05。图11 RNF44基因过表达慢病毒转染AGS细胞凋亡情况(n=6)

与空载组(Vector组)比较, ∗P<0.05。图12 RNF44基因过表达慢病毒转染AGS细胞RNF44、AKT和p-AKT蛋白情况(n=6)
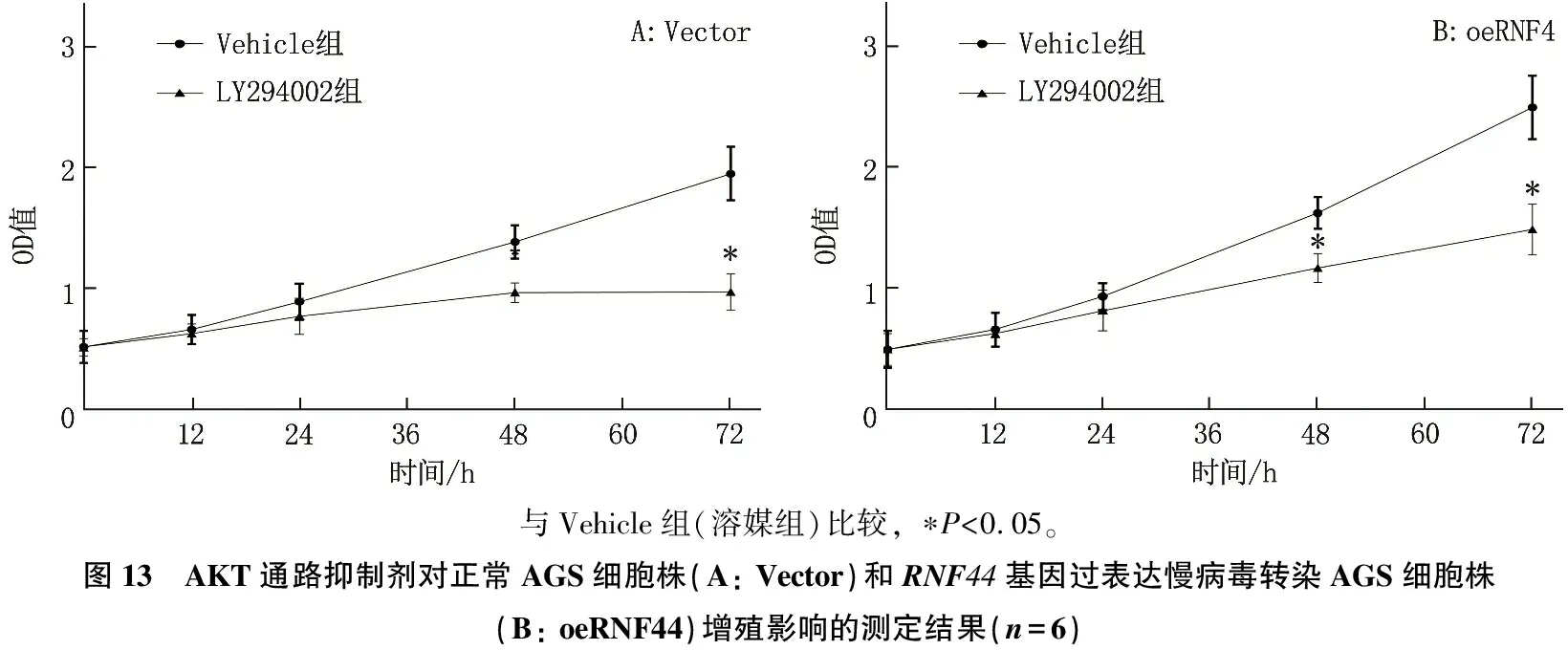
与Vehicle组(溶媒组)比较, ∗P<0.05。图13 AKT通路抑制剂对正常AGS细胞株(A: Vector)和RNF44基因过表达慢病毒转染AGS细胞株(B: oeRNF44)增殖影响的测定结果(n=6)

与Vehicle组(溶媒组)比较, ∗P<0.05。图14 AKT通路抑制剂对正常AGS细胞株(A: Vector)和RNF44基因过表达慢病毒转染AGS细胞株(B: oeRNF44)凋亡影响的测定结果(n=6)
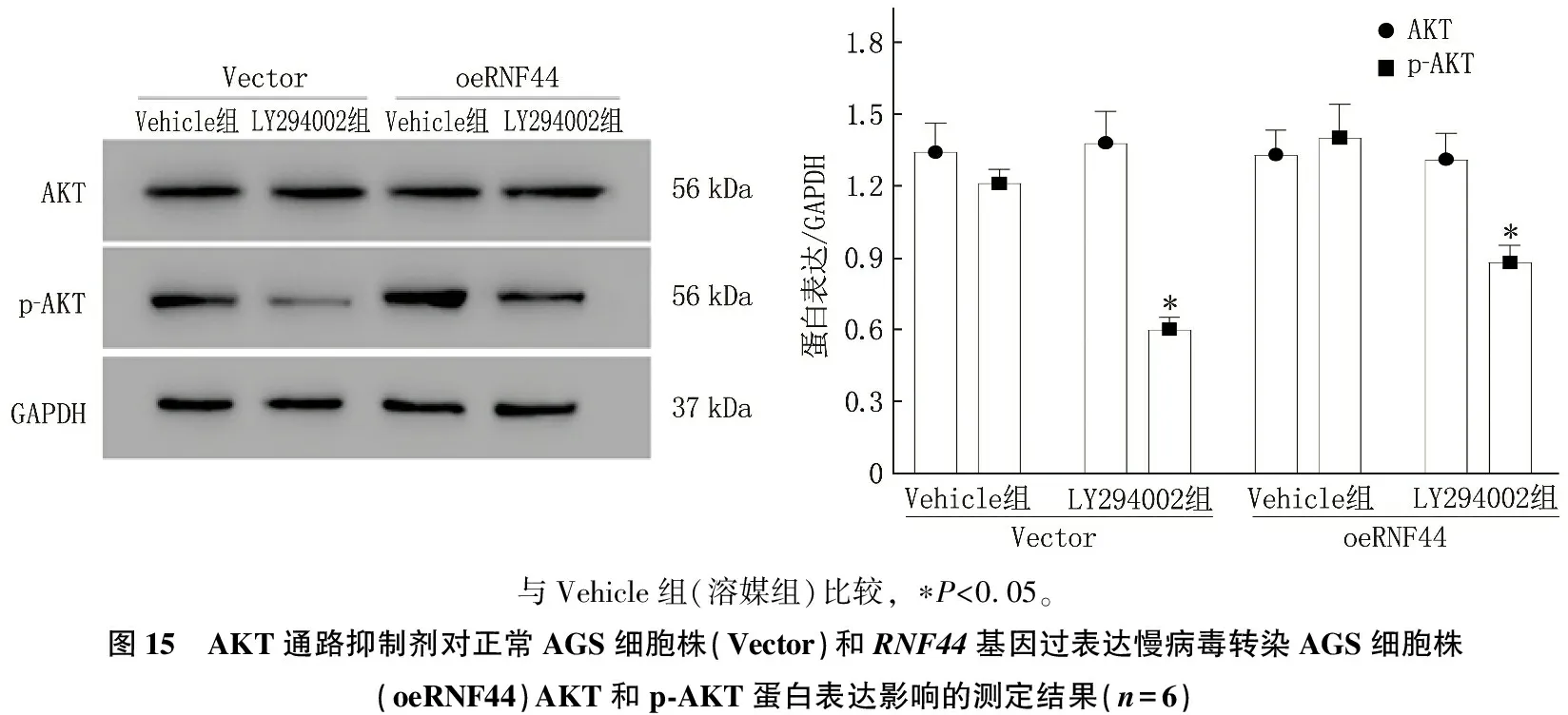
与Vehicle组(溶媒组)比较, ∗P<0.05。图15 AKT通路抑制剂对正常AGS细胞株(Vector)和RNF44基因过表达慢病毒转染AGS细胞株(oeRNF44)AKT和p-AKT蛋白表达影响的测定结果(n=6)
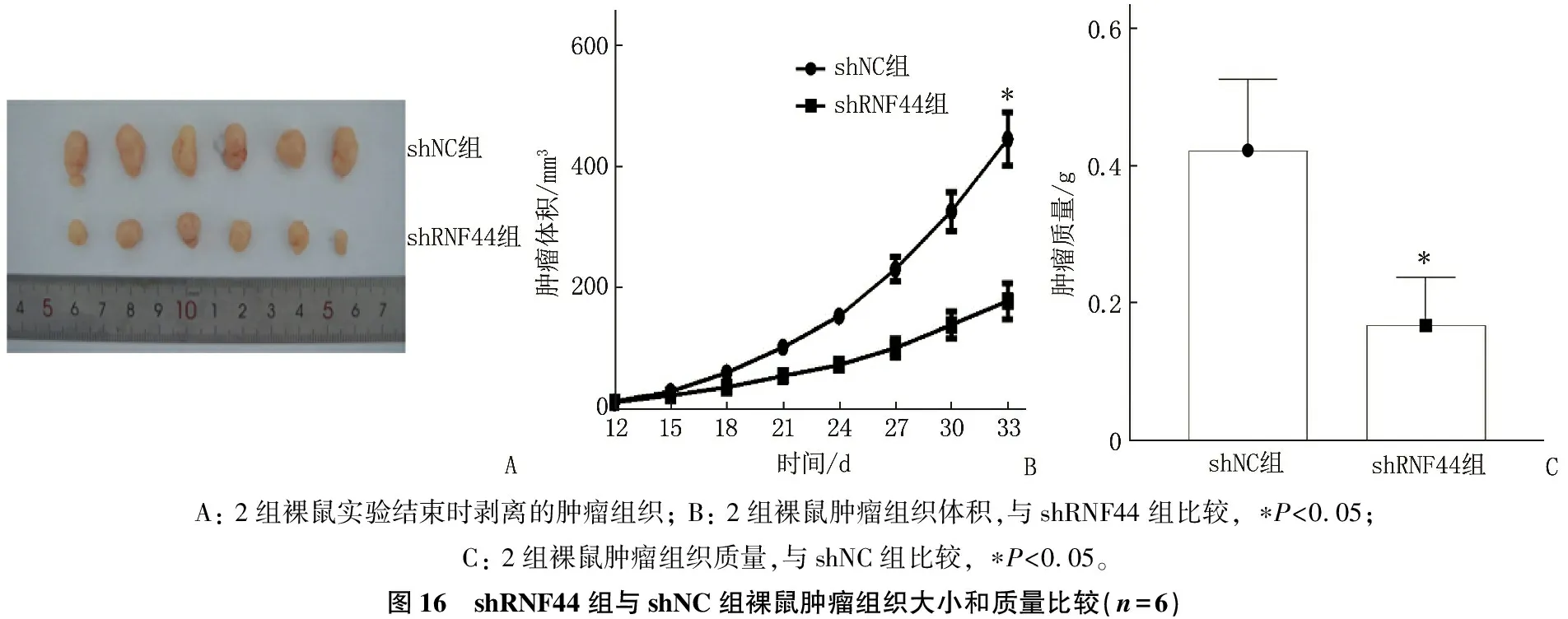
A: 2组裸鼠实验结束时剥离的肿瘤组织; B: 2组裸鼠肿瘤组织体积,与shRNF44组比较, ∗P<0.05; C: 2组裸鼠肿瘤组织质量,与shNC组比较, ∗P<0.05。图16 shRNF44组与shNC组裸鼠肿瘤组织大小和质量比较(n=6)

图17 2组裸鼠肿瘤组织切片组织免疫荧光实验结果(n=6, 放大400倍)

与shNC组比较, ∗P<0.05。图18 2组裸鼠肿瘤组织Western blot测定结果(n=6)
AKT作为调节蛋白在细胞存活和凋亡中起重要作用, AKT常穿梭于胞浆和核质之间,并不可能通过细胞受体直接激活,需要细胞受体先激活,然后发生磷酸化形成p-AKT, 释放具有催化活性的亚基而激活AKT[23], 随后激活Caspase-3、mToR等多条信号通路,从而控制细胞存活、增殖、DNA修复和合成代谢等过程。此外, p-AKT可通过调节Bcl-2蛋白家族来控制细胞凋亡[24]。本研究结果显示,RNF44基因干扰慢病毒转染MKN45细胞p-AKT表达显著降低,而RNF44基因过表达慢病毒转染AGS细胞株p-AKT表达显著升高,这可能与RNF44调节细胞增殖和凋亡相关。此外,裸鼠试验中shRNF44 组裸鼠肿瘤组织中p-AKT蛋白表达均较shNC组显著降低,进一步证明RNF44可能通过调控p-AKT的表达来调节肿瘤生长。
综上所述,RNF44基因表达对胃癌细胞增殖和凋亡有调节作用,RNF44过表达可显著抑制肿瘤细胞增殖并促进凋亡,RNF44低表达可显著促进肿瘤细胞增殖并抑制凋亡,RNF44可能通过调控p-AKT蛋白表达而发挥调节作用。
