美洛昔康单克隆抗体制备及其免疫层析试纸条的研制
2023-11-01别玮姚佳冯鑫杨海涛崔风云张茂东槐硕任西杰张捷
别玮 姚佳 冯鑫 杨海涛 崔风云 张茂东 槐硕 任西杰 张捷*
(1.中国海关科学技术研究中心 北京 100026;2.北京勤邦科技股份有限公司;3.内蒙古中敖食品有限公司)
0 引言
美洛昔康(Meloxicam)是一种新型非甾体抗炎药,具有良好的解热镇痛、消炎等作用,在兽医临床治疗方面应用广泛[1-2]。 然而,由于乳畜饲养业的规模化发展,养殖数量大,存在不法养殖户滥用兽药、不遵守休药期等现象, 导致乳品中美洛昔康残留,严重影响了乳品品质。 残留的美洛昔康随食物链进入人体后,还可能导致消费者胃肠道、肝脏、神经系统、泌尿系统及血液系统等不良反应[3-4],乳品中抗炎药残留问题已成为全世界关注的焦点。
为了确保动物源性食品的安全, 维护消费者健康, 一些国家和地区规定了乳品中美洛昔康的最大残留限量(MRLs),如欧盟规定了美洛昔康在牛奶中的MRLs 为15 μg/kg,加拿大规定了美洛昔康在牛奶中的MRLs 为35 μg/kg。我国GB 31650.1—2022《食品安全国家标准食品中41 种兽药最大残留限量》规定了美洛昔康在牛奶中的MRLs 为15 μg/kg[5]。
目前, 主要采用色谱方法检测动物源食品中美洛昔康的残留,包括高效液相色谱法[6-7]、液相色谱-质谱/质谱法[3-4,8-10]等。 如彭涛等[4]首次建立了牛奶中64 种中性和酸性药物的高效液相色谱-串联质谱(HPLC-MS/MS)同时测定方法,其中检测美洛昔康的定量下限(LOQ)为1 μg/kg。 现有行业标准SN/T 2190—2008《进出口动物源性食品中非甾体类抗炎药残留量检测方法液相色谱-质谱/质谱法》就是采用液相色谱-质谱/质谱法对牛肉、猪肝、兔肝、牛奶和鸡蛋中美洛昔康残留量进行检测, 测定低限为5 μg/kg。色谱方法虽然准确灵敏,但其需要较高成本和专业人员操作,且操作复杂不利于推广使用。 因此与上述现有的仪器方法相比,利用免疫化学法原理的快速检测方法更加灵敏、快捷,且成本较低,适用于现场大规模的检测。 但目前还没有检测美洛昔康试纸或者美洛昔康半抗原改造的相关文献报道。
本文采用自合成的美洛昔康半抗原人工制备免疫原,对免疫BALB/c 小鼠进行免疫;免疫后取小鼠脾脏细胞与骨髓瘤细胞进行融合,筛选得到可产生美洛昔康单克隆抗体的杂交瘤细胞株;对细胞株进行培养,根据小鼠体内诱生腹水法制备特异性高的单克隆抗体;并利用该抗体研制可快速检测乳品中美洛昔康的胶体金免疫层析试纸条。
1 材料与方法
1.1 材料与试剂
1.1.1 试验动物
BALB/c 小鼠(许可证号:SCXK2019-0010,斯贝福(北京)生物技术有限公司)。
1.1.2 试剂
美洛昔康、庆大霉素、卡那霉素、新霉素、大观霉素、链霉素、雌二醇、青霉素G、头孢氨苄、四环素、土霉素、玉米赤霉醇、黄曲霉毒素M1、三聚氰胺和诺氟沙星标准品(北京标准物质研究中心);牛血清白蛋白(BSA)、卵清蛋白(OVA)、N,N-二甲基甲酰胺(DMF)、1-乙基-(3-二甲氨基丙基)碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)和羊抗鼠二抗(生工生物工程(上海)股份有限公司);化合物Ⅰ(CAS 号188422-58-4,上海麦克林生化科技股份有限公司);化学试剂均为分析纯(国药集团化学试剂有限公司);生牛乳(本地养殖场);巴氏杀菌乳、UHT 灭菌乳、羊奶等乳品(购自超市)。
1.2 仪器与设备
电子天平 (ESJ110-4A, 沈阳龙腾电子有限公司);旋转蒸发仪(RE-201D,上海越众仪器设备有限公司);酶标仪(MK3,上海雷勃分析仪器有限公司);点膜仪(xyz 3000,美国BioDot 公司);Milli-Q 纯水仪(美国Millipore 公司); 核磁共振波谱仪(NMR)(EFT-60,美国Anasazi 公司)。
1.3 试验方法
1.3.1 半抗原合成
称取3.0 g 化合物Ⅰ, 加入1,4-二氧六环80 mL,叔丁醇钠1.15 g, 醋酸铅0.2 g,(2R)-1-[(1R)-1-[双(1,1-二叔丁基)膦]乙基]-2-(二环己基膦)二茂铁0.2 g,充分搅拌,然后加入巯基丙酸2.12 g,搅拌,加热回流反应12 h。 停止加热,冷却至室温,加入水200 mL,乙酸乙酯100 mL,萃取,除去水相,有机相蒸干,无水乙醇20 mL 重结晶,得到化合物Ⅱ1.49 g,回收率为39.9%。
全部的化合物Ⅱ1.49 g, 依次加二甲基甲酰胺20 mL、二甲苯80 mL,加2-氨基-5-甲基噻唑0.68 g,充分搅拌,装上回流冷凝管,加热回流反应24 h,旋蒸,除去有机溶剂,得到红色油状物,上硅胶柱,加体积比为5/1 的二氯甲烷/甲醇洗脱分离纯化,得到化合物Ⅲ0.76 g,回收率为41.8%,即为半抗原产物。合成路线见图1。

图1 美洛昔康半抗原合成路线Fig.1 Synthesis of Meloxicam Hapten
1.3.2 免疫原的合成
取1.2.1 中的化合物Ⅲ16.97 mg,加1 mL DMF溶解澄清,加12.87 mg NHS 和18.1 mg EDC,充分溶解并混匀,室温反应2 h,得到半抗原活化液A液;取牛血清白蛋白BSA 50 mg,加入0.1 mol/L pH 9.5的CB 缓冲液4 mL 进行溶解,得到B 液。 将A 液逐滴滴加到B 液中,室温反应6 h,停止反应,用0.02 mol/L PBS 透析纯化3 d,每天换液3 次,之后离心分装,得到美洛昔康-BSA 偶联物,即为免疫原,取出分装保存于-20℃。
1.3.3 包被原的合成
取1.2.1 中的化合物Ⅲ20.22 mg,加1 mL DMF溶解澄清,加12.87 mg NHS,18.1 mg EDC,充分溶解并混匀,室温反应2 h,得到半抗原活化液A 液;取卵清蛋白OVA 100 mg, 加0.1 mol/L pH 9.5 的CB缓冲液4 mL 进行溶解,得到B 液。将A 液逐滴滴加到B 液中,室温反应6 h ,停止反应,用0.02 mol/L PBS 透析纯化3 d,每天换液3 次,之后离心分装,得到美洛昔康-OVA 偶联物,即为包被原,取出分装保存于-20℃。
1.3.4 半抗原结构的鉴定
美洛昔康半抗原的分子结构鉴定采用核磁共振法(1H-NMR)确证。
1.3.5 多抗血清的制备及效价测定
对BALB/c 小鼠进行美洛昔康人工抗原免疫,将100 μg 免疫原溶于100 μL pH 7.4 的PBS 中,随后与等体积的FCA/FICA 混合, 对小鼠进行颈背部皮下多点注射。免疫结束7 d 后,对小鼠进行断尾取血,对美洛昔康抗血清的效价采用间接ELISA 法进行测定[11],选择抗血清效价最优的小鼠作为后续单克隆抗体制备过程中融合细胞的脾细胞供体。
1.3.6 单克隆抗体的制备和纯化
准备细胞融合时提前3 d 对小鼠进行200 μg的免疫原腹腔注射, 融合时利用小鼠脾细胞与SP2/0骨髓瘤细胞通过聚乙二醇的作用进行细胞融合,融合成功的细胞在HAT 培养基中培养,对融合细胞的特异性进行检测, 选取特异性最好的阳性细胞孔进行有限稀释,采用HT 培养基进行克隆化,待阳性率达100%后用DEME 培养基培养建立细胞株。 收集生长良好的杂交瘤细胞对小鼠进行腹腔注射,10 d后无菌操作收集小鼠腹水并采用辛酸-硫酸铵法进行纯化。
1.3.7 单克隆抗体免疫学特性分析
灵敏度测定:采用间接竞争ELISA(icELISA)测定单克隆抗体对美洛昔康的50%抑制质量浓度(IC50),以IC50衡量灵敏度[12];特异性测定:采用交叉反应试验,选择庆大霉素、卡那霉素、新霉素、大观霉素、链霉素、雌二醇、青霉素G、头孢氨苄、四环素、土霉素、玉米赤霉醇、黄曲霉毒素M1、三聚氰胺、诺氟沙星作为抑制物,icELISA 测定各抑制物的IC50,以单克隆抗体对美洛昔康的IC50与抑制物的IC50百分比为其交叉反应率。
1.3.8 胶体金免疫层析试纸条的制备
用磷酸缓冲液将美洛昔康半抗原-卵清蛋白偶联物稀释到10 mg/mL, 用Isoflow 点膜仪将其包被于硝酸纤维素膜上的检测线(T 线),包被量为0.8 μL/cm;用0.01 mol/L pH 7.4 的磷酸盐缓冲液将羊抗鼠抗抗体稀释到200 μg/mL,用Isoflow 点膜仪将其包被于硝酸纤维素膜上的质控线(C 线),包被量为1.0 μL/cm。将包被好的反应膜置于37℃条件下干燥2 h,备用。
将样品吸收垫置于含0.5%牛血清白蛋白(体积分数)、0.1 mol/L pH 7.2 的磷酸盐缓冲液中浸泡2 h,在37℃下烘2 h 备用。
将样品吸收垫、结合物释放垫、反应膜、吸水垫依次按顺序粘贴在PVC 底板上;结合物释放垫从起始端有1/3 区域被样品吸收垫覆盖, 结合物释放垫的末端与反应膜的始端连接,反应膜的末端与吸水垫的始端相连,样品吸收垫的始端与PVC 底板的始端对齐,吸水垫的末端与PVC 底板的末端对齐;所述反应膜上有检测线和质控线,检测线(T 线)和质控线(C 线)均为与所述试纸条的长相垂直的条状带;检测线位于靠近结合物释放垫的末端的一侧; 质控线位于远离结合物释放垫的末端的一侧;将试纸条用机器切成3 mm 宽的小条,装在特制的塑料制卡中。
1.3.9 胶体金试纸条方法的建立
待测乳品样本须为均匀液体,不能有结块、发酸或沉淀。吸取待测液100 μL 垂直滴于试纸条加样孔中,液体流动开始计时,反应10 min,肉眼观察判定结果。T 线显色高于或者等于C 线显色为阴性(-);T线显色低于C 线显色或者T 线不显色为阳性(+);未出现C 线表示结果无效,应重新测试。
1.3.10 试纸条灵敏度测试
用经仪器方法确认为不含美洛昔康的乳品(生牛乳、巴氏杀菌乳、UHT 灭菌乳、羊奶)与美洛昔康标准溶液混合, 制成浓度分别为0.025、0.05、0.075 μg/L 的样品, 用1.3.9 所述方法进行检测,每个浓度重复3 次,以T 线显色最浅时的稀释度作为试纸条最低检测浓度。
1.3.11 试纸条准确性测试
用试纸条检测样本中美洛昔康的残留情况,统计出假阳性试纸条和假阴性试纸条的数量, 从而计算出试纸条的假阳性率、假阴性率。而这2 个指标能够用来评价试纸条的准确性, 当试纸条的假阳性率小于5%,同时,未出现假阴性结果,即假阴性率为0。那么,这说明试纸条的准确性指标良好。本研究利用已由仪器确证的样本进行测定, 即质量浓度小于0.05 μg/L 的50 份阴性乳品样本、 质量浓度大于0.05 μg/L 的50 份阳性乳品样本, 以此测定的结果来反映所研制试纸条的准确性。
1.3.12 试纸条稳定性测试
本研究利用已由仪器确证的样本进行测定,即质量浓度小于0.05 μg/L 的20 份阴性乳品样本、质量浓度大于0.05 μg/L 的20 份阳性乳品样本, 用不同保藏时间的试纸条进行稳定性评估测定。 对试纸条进行37℃老化试验,4℃、25℃、30℃稳定性试验,每个样本测定次数为2 次。
1.3.13 试纸条特异性试验
向空白生牛乳、巴氏杀菌乳、UHT 灭菌乳、羊奶等乳品样本中, 各添加乳品中可能与美洛昔康联合用药的药物(庆大霉素、卡那霉素、新霉素、大观霉素、链霉素、雌二醇、青霉素G、头孢氨苄、四环素、土霉素、玉米赤霉醇、黄曲霉毒素M1、三聚氰胺、诺氟沙星) 来进行试纸条的特异性分析, 添加浓度至500 μg/L,用试纸条进行检测,每个浓度重复3 次,从而判断试纸条的特异性。
2 结果与分析
2.1 半抗原结构鉴定
美洛昔康是一种小分子非甾体抗炎药, 不具有完全抗原的免疫原性,需要与大分子蛋白质偶联成人工完全抗原后才能进行动物免疫[16]。 本研究人工合成了美洛昔康半抗原,并对1.2.1 制备的半抗原,进行核磁共振(1H-NMR,500 MHz,Chloroform-d)试验,结果由图2 可知,1H NMR (500 MHz,Chloroform-d)谱图显示:δ7.84(d,J=8.8 Hz,1H),7.74 (d,J=1.9 Hz,1H),7.45 (dd,J=8.9,1.9 Hz,1H),6.99(s,1H),3.15(t,J=6.5 Hz,2H),3.06(s,2H),2.54(t,J=6.5 Hz,2H)。其中, 化学位移δ=3.15、2.54 的峰为间隔臂上亚甲基氢的吸收峰,该峰的存在,证明半抗原合成成功。
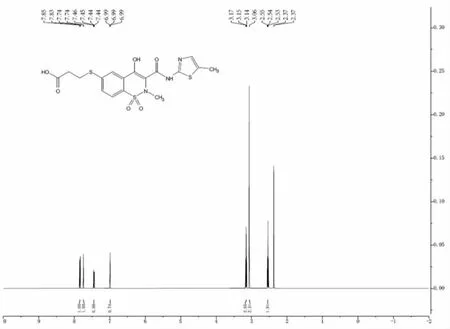
图2 半抗原1H-NMR 鉴定结果Fig.2 Identification of hapten by 1H-NMR
2.2 抗血清效价的测定
第4 次免疫后,通过对小鼠断尾取血,采用间接ELISA 检测,用酶标仪测定其在450 nm 条件下的吸光度值(OD450值),计算其抑制率,对应的稀释倍数即为抗血清效价值。表1 显示6 号小鼠产生的抗血清效价(540 000)和抑制率(47.1%)最优,因此选择6 号小鼠作为与骨髓瘤细胞融合的脾细胞供体。
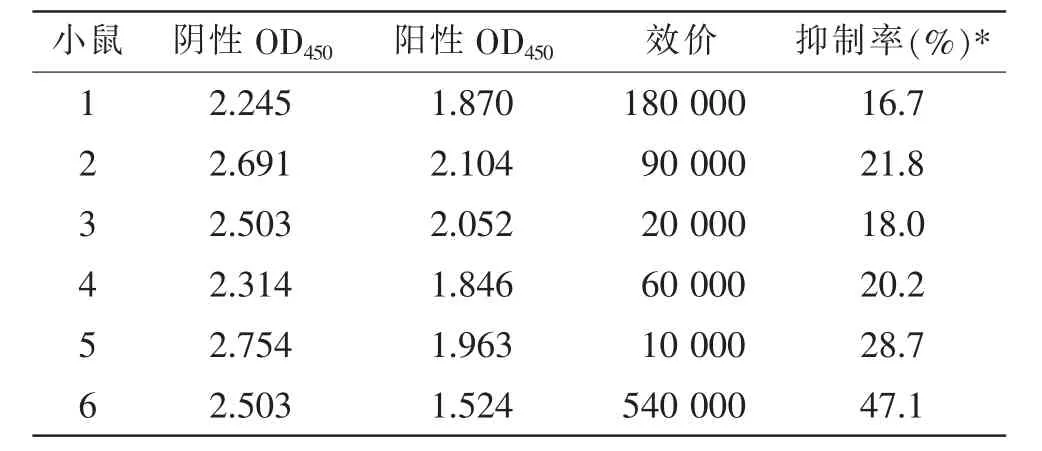
表1 小鼠抗血清测定结果Table 1 Results of mouse antiserum assay
2.3 杂交瘤细胞的筛选
经过筛选得到3 株阳性融合细胞株,如图3 所示,Mel-101 细胞株随美洛昔康竞争浓度的增加OD450显色程度下降最为显著,说明其分泌的单克隆抗体对于美洛昔康的亲和力最高[13]。因此,选择该细胞株用于小鼠腹水的采集。
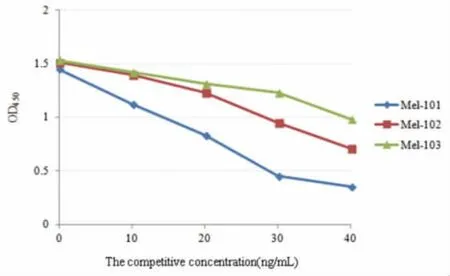
图3 杂交瘤细胞的筛选Fig.3 Screening of hybridoma cells
2.4 单克隆抗体免疫学特性分析
抗体特异性是指与抗原类似物相比,与特定抗原结合的能力,常用交叉反应率作为评价标准。 抗体的交叉反应率和特异性呈反比关系。 本试验选择了乳品中可能与美洛昔康联合用药的庆大霉素、卡那霉素、新霉素、大观霉素、链霉素、雌二醇、青霉素G、头孢氨苄、四环素、土霉素、玉米赤霉醇、黄曲霉毒素M1、三聚氰胺、诺氟沙星来进行特异性分析。结果表明,单克隆抗体对美洛昔康具有特异性,与其结构类似物无交叉反应(表2)。
2.5 试纸条灵敏度试验
由图4 可知, 检测美洛昔康浓度分别为0.025、0.050、0.075 μg/L 的阴性乳品加标样品,T 线颜色由强(0 μg/L)到弱,在0.05 μg/L 浓度时T 线显色弱于C 线,为阳性。因此确定本试纸条对乳品样本的检测限为0.05 μg/L,我国GB 31650.1—2022《食品安全国家标准食品中41 种兽药最大残留限量》 规定了美洛昔康在牛奶中的MRLs 为15 μg/kg, 因此符合GB 31650.1—2022 规定的最大残留限量要求。

图4 胶体金免疫层析试纸条检测限的确定Fig.4 Determination of detection limit of gold immunochromatographic strip
2.6 试纸条准确性试验
用试纸条检测50 份阴性和50 份阳性生牛乳、巴氏杀菌乳、UHT 灭菌乳、羊奶等乳品样本,表3 为检测结果。 结果显示,检测所有阳性样本时,试纸条未出现假阴性结果,假阴性率为0%;检测阴性样本时,巴氏杀菌乳、UHT 灭菌乳、羊奶等样本出现了不同数量的阳性检测结果,假阳性数量分别为1、1、3,即假阳性率分别为2%、2%、6%。
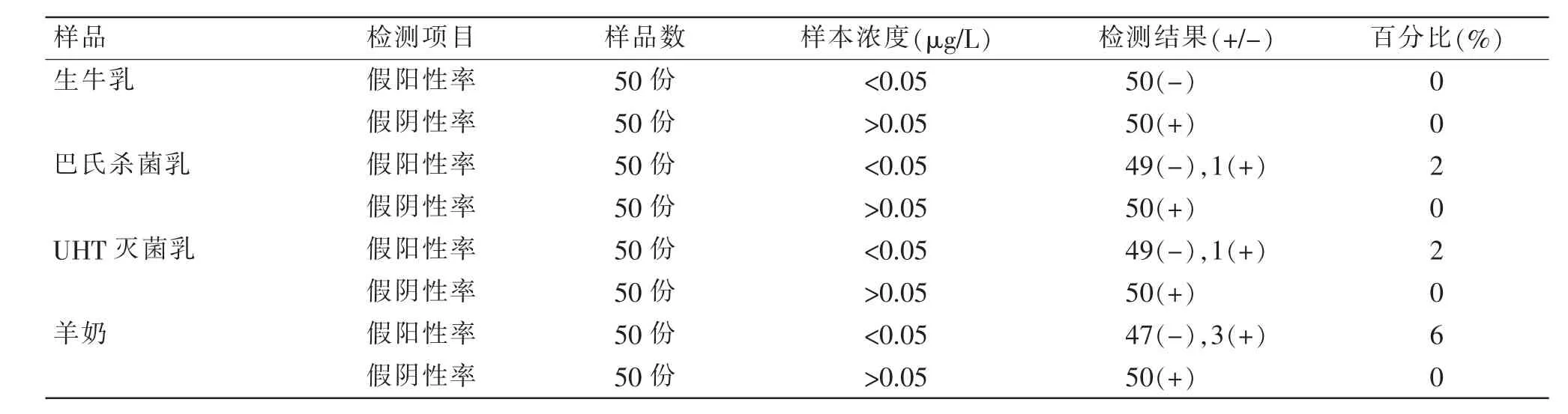
表3 准确性测定结果Table 3 Accuracy determination
测定结果的假阳性率和假阴性率是评价试纸条的重要指标, 部分省市的市场监督管理局颁发了相关的地方标准, 标准中均涉及到假阳性率和假阴性率的考察。 湖北省市场监督管理局发布的DB42/T 1868—2022 《食品快速检测产品评价技术规范》、深圳市市场监督管理局发布的DB4403/T 96—2020《食品快速检测产品评价技术规范》[14]中均规定:对没有国家规定食品快速检测方法的,假阳性率应≤15%、假阴性率应≤5%。 江西省市场监督管理局发布的DB36/T 1334—2020 《食品快速检测产品评价技术规范》[15]中规定:没有国家规定食品快速检测方法的,假阴性率和假阳性率应根据在实际样品的检出情况评估是否符合需求。 本试纸条满足上述标准要求。
2.7 试纸条特异性试验
向空白生牛乳、巴氏杀菌乳、UHT 灭菌乳、羊奶等乳品样本中, 各添加乳品中可能与美洛昔康联合用药的庆大霉素、卡那霉素、新霉素、大观霉素、链霉素、雌二醇、青霉素G、头孢氨苄、四环素、土霉素、玉米赤霉醇、黄曲霉毒素M1、三聚氰胺、诺氟沙星来进行试纸条的特异性分析,添加浓度至500 μg/L,用试纸条进行检测,每个浓度重复3 次。 结果表明,本研究的试纸条对美洛昔康具有特异性, 与所测药物无交叉反应(表4)。
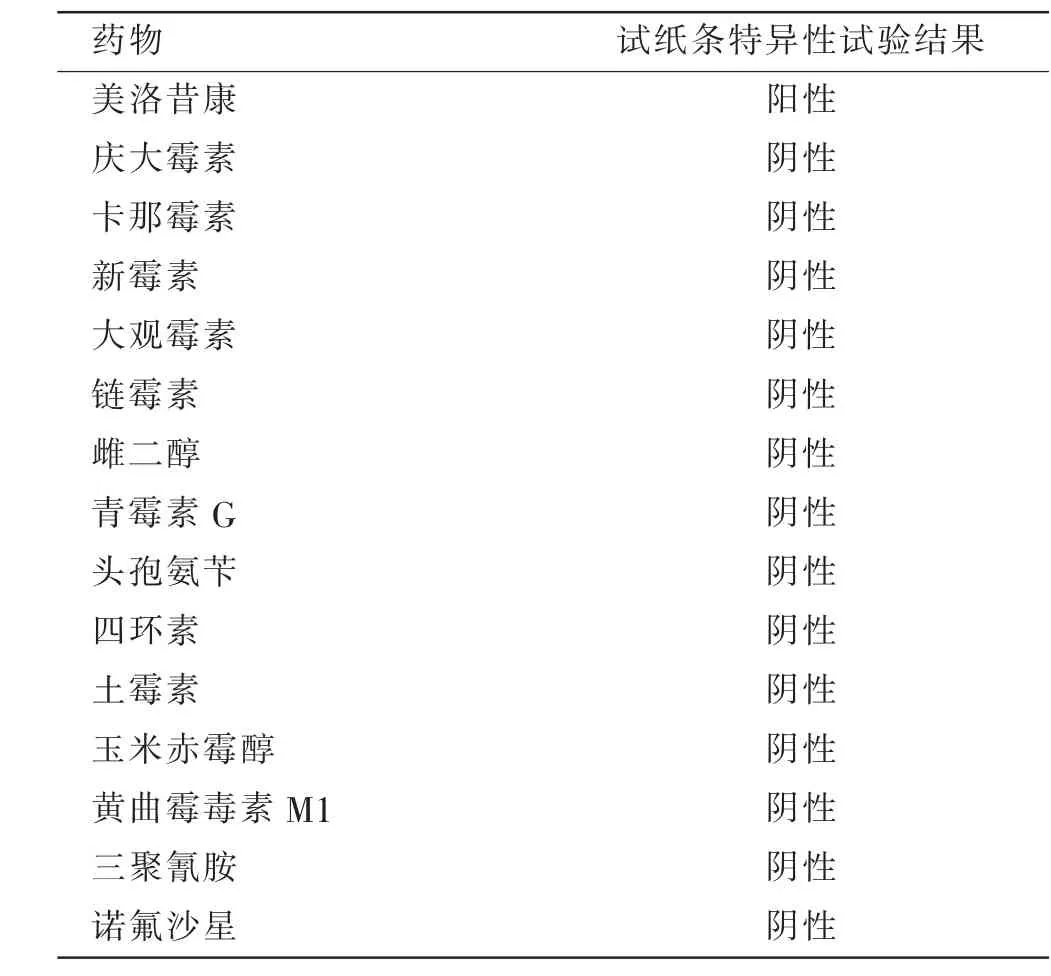
表4 检测美洛昔康试纸条的特异性试验结果Table 4 Test results of specificity of meloxicam test strip
2.8 试纸条稳定性试验
针对生牛乳、巴氏杀菌乳、UHT 灭菌乳、羊奶等乳品样本, 为评估不同保藏时长试纸条的稳定性,本研究统计假阳性结果或者假阴性结果的数量。 测定结果显示, 如果试纸条的保藏时长在12 个月以内,那么,试纸条不会出现假阳性结果或者假阴性结果;然而,试纸条的保藏时长为13 个月时,试纸条出现个别失效或者假阳性结果,准确性相对下降。
一般情况下, 胶体金免疫层析试纸条的保质期为1 年,这与试纸条的组成物质有关,尤其是与包被原、金标抗体等物质的活性有关,为了方便试纸条的保存,综合实际应用情况以及试纸条的保质期,将试纸条放置于4℃保存。
3 讨论
在现有文献中,通过仪器方法检测美洛昔康残留量的研究较多。 其中,彭涛等[3]采用超高效液相色谱-四极杆串联质谱仪(UPLC-MS/MS)同时测定了猪肝中18 种非甾体类抗炎药(NSAIDs)的残留量,其中检测美洛昔康的检出限(LOD)为0.2~10 μg/kg。彭涛等[4]首次建立了牛奶中64 种中性和酸性药物的高效液相色谱-串联质谱(HPLC-MS/MS)同时测定方法,其中检测美洛昔康的定量下限(LOQ)为1 μg/kg。 李娜等[9]建立了猪肉中美洛昔康等四种非甾体抗炎药残留量的超高效液相色谱-串联质谱(UPLC-MS/MS)检测方法,对猪肉中美洛昔康的定量限为1.6 μg/kg。肖倩文[10]建立了液相色谱-串联质谱(LC-MS/MS)检测猪牛可食性组织(肌肉、肾脏、肝脏、牛奶)中美洛昔康残留量的方法,牛奶中美洛昔康的定量限为1.5 μg/kg。
目前未检索到检测美洛昔康试纸或者美洛昔康半抗原改造的相关文献。美洛昔康为小分子物质,在动物体内无法产生免疫应答反应, 即仅用美洛昔康分子无法获得相应抗体,因此,本研究对其进行半抗原改造,并偶联相应蛋白成为大分子,才能免疫动物获得抗体。本研究通过该思路人工合成了美洛昔康半抗原,然后通过羧基与BSA、OVA 进行偶联,进而制备出美洛昔康的人工完全抗原, 获得美洛昔康单克隆抗体, 根据半固体培养基的方法来进行杂交瘤细胞的融合,筛选了3 株杂交瘤阳性细胞株,对其进行培养,腹腔法来获得美洛昔康单克隆抗体,并对单克隆抗体的特性进行鉴定, 其IC50为0.024 ng/mL,与乳品中可能与美洛昔康联合用药的15 种药物无交叉反应;结合胶体金免疫层析技术,研制了一种快速检测乳品中美洛昔康残留的胶体金免疫层析试纸条,制备的检测乳品中美洛昔康残留试纸条,检测限为0.05 μg/L。
不仅关键指标优于现有文献, 并且美洛昔康半抗原改造方法具有创新性,因此,本研究于2023年9 月4 日向国家知识产权局申请了发明专利 《一种检测美洛昔康的试纸条及其应用》, 专利号为2023111298704。
该试纸条成本低廉,稳定性良好,检测范围广,样品前处理简单检测限为0.05 μg/L,符合GB 2763规定的最大残留限量要求,且优于现有文献水平。该试纸条可准确检测出阳性样品,对于阴性样本,还可以通过使用胶体金读数仪来对结果进行分析, 以提高检测准确度。该方法作为一种快速筛查手段,可广泛用于乳品中美洛昔康残留的现场筛查, 很好地弥补了仪器分析法的不足, 具有重要的经济价值和社会价值。
