贝类中沙门氏菌、阪崎肠杆菌双重RT-PCR 检测方法研究
2023-11-01田立杰聂丹丹丁旭闫聪李玲孙玉罗雁非
田立杰 聂丹丹 丁旭 闫聪 李玲 孙玉 罗雁非*
(1.长春海关技术中心 吉林长春 130062;2.吉林国际旅行卫生保健中心;3.吉林省中医药科学研究院)
0 引言
食源性致病菌是引起食品安全问题的主要因素之一,新鲜水产品中往往带有大量微生物,多种致病菌可同时长期存活于水体环境中,增加水产品在养殖过程中被致病菌污染的可能性,进而造成人类食物中毒[1-4]。 沙门氏菌、阪崎肠杆菌等致病菌可导致许多严重疾病,沙门氏菌是一种广泛分布于自然界中的危害极大的肠道致病菌,人类感染沙门氏菌可引起伤寒、副伤寒、感染性腹泻、食物中毒、败血症、胃肠炎和菌血症等症状[1-2,4],感染阪崎肠杆菌主要表现为败血症、致死性小肠结肠炎、脓毒症、脑膜炎和菌血症等[4]。
随着人们对食品安全的重视程度与食品安全监督监测需求的不断提高,以及进出口贸易的需要,传统的微生物检测方法通过增菌培养、分离纯化、生化鉴定等进行鉴定[17],因检测步骤繁琐、检测周期长、效率低、对人员要求高,同时因低灵敏度和低特异性导致容易错判等问题[5-7],难以满足现代贸易快速检测的要求和食品安全监督监测的需要。 水产品中致病菌检测的现行标准GB 4789.20[8]仍要求使用传统方法,检测步骤繁琐、检测时间长,难以满足新鲜水产品的贸易和检测需求,因此,开发更加快速高效的检测水产品中沙门氏菌和阪崎肠杆菌的方法具有实际意义。
如今,有许多免疫学、分子生物学、生物传感器等新检测方法被应用于水产品中致病菌的检测鉴定[11-13,16]。目前,对于水产品中沙门氏菌的检测,有多重PCR 方法、实时荧光PCR、微滴数字PCR 方法[11-13,16],例如:麻丽丹等[2]建立了Taqman MGB PCR 定量检测水产品中沙门氏菌的方法;麻春阳等[14]建立了多重实时荧光串联PCR 技术高通量检测生蚝中9 种致病菌的方法;李亚茹等[15]采用免疫磁珠分离实时荧光PCR 快速检测虾中沙门氏菌。但对于水产品中阪崎肠杆菌的分子生物学等快速检测方法并不多见,尚未有一种简单高效的多重检测方法,能在短时间内同时快速地检测水产品中沙门氏菌和阪崎肠杆菌这2 种致病菌。
本研究以水产品中常见的贝类产品为目标,设计引物探针, 建立双重实时荧光PCR 检测方法,可用于水产品中沙门氏菌和阪崎肠杆菌的同时快速检测,对指导水产品中致病菌的检测、加强食品安全监督监测工作、保护水产品养殖业、促进水产品进出口贸易发展具有重要意义。
1 材料与方法
1.1 材料
研究中所需海虹、扇贝、蚬子、鲍鱼、牡蛎、毛蚶、血蚶、凤螺、乌贼、蛏子,10 种贝类产品均采购于当地市场。
对实验室样品(红贝、黄贝、纹贝、象贝)4 种贝类产品进行本底实验,每种平行3 次。
对未添加标准物质的样品进行本底测试实验,检测样品本底是否有含有目标菌。确定阴性样品后,将已购置的待检测2 种标准菌: 沙门氏菌(ATCC 12011)和阪崎肠杆菌(JL.2046),以及本研究选用的非目标菌株如上处理进行特异性实验, 选用的菌株如下:金黄色葡萄球菌(ATCC 12600)、蜡样芽胞杆菌(ATCC 11176)、李斯特菌(ATCC 19119)、普通变形杆菌(ATCC 33420)、小肠耶尔森菌(ATCC 23715)、大肠杆菌(ATCC 11229)、克雷伯氏菌(ATCC 43086)、粪肠球菌(ATCC 14500)、单核细胞增生李斯特氏菌(ATCC 19111)、阴沟肠杆菌(ATCC10146)、志贺氏菌(JL 08036)。
1.2 试剂
除另有规定外,所有试剂均为分析纯。实验用水符合GB/T 6682 中二级水的要求。
缓冲蛋白胨水(BPW,见GB 4789.4 中A.1):2×Taq PCR Master Mix(批号:N20630)、2% CTAB(批号:HC28172940)、10×Tris/Tricine/SDS Buffer(批号:20200510);蛋白酶K(批号:No.160020444,QIAGEN);三氯甲烷(氯仿) CHCl3(批号:20161225,北京化工厂);异戊醇C5H12O(批号:20000805,沈阳市水丰化学试剂);无水乙醇 C2H5OH(批号:20180518,北京化工厂);TIANamp Genomic DNA Kit 血液/细胞/组织基因组DNA 提取试剂盒(批号:#S7628);实时荧光PCR 2 倍预混液(批号:00699230,ABi)。
1.3 仪器
Milli-Q-Integral 5 型纯水/超纯水系统(美国密理博);AL104IC 型电子天平 (中国梅特勒);MLS-3780 型高压灭菌器 (日本三洋);7A0-0052 型核酸蛋白检测仪(日本日立公司);Elf-Pad 型金属浴(中国北京佰欧创投生物科技有限公司);FORCE 7 型离心机(美国丹法);E-centrlfuge 型离心机(美国威泰克);MICRO ONE 型离心机(日本 TOMY);S20K型酸度计(中国上海梅特勒);Vortex.Genie 2 型漩涡混合器(美国SI 公司);SLM-140AY65 型制冰机(日本三洋);QuantStudio 7 荧光定量PCR 仪 (美国ABI);0.1~2.5 μL 型移液器、2~20 μL 型移液器、20~200 μL 型移液器、100~1 000 μL 型移液器(德国eppendorf 公司)。
1.4 样品处理
对红贝、黄贝、纹贝、海虹、扇贝、蚬子、象贝7种常见水产品进行本底实验,每种平行3 次。 取样方法:使用无菌剪刀打开至少10 个贝类,取出贝类消化腺置于无菌培养皿中,收集2.0 g,将消化腺匀浆后装入无菌离心管中,在无菌条件下对贝类进行取样并均质。 对未添加标准物质的样品进行本底测试实验,检测样品本底是否含有目标菌。 确定阴性样品后,将已购置的待检测2 种标准菌复壮,制成阳性对照品,制成一定浓度的菌悬液,按照浓度0.5、1、5、10 CFU/mL对原样品进行添加、均质,做灵敏度实验及特异性实验。
沙门氏菌按照GB 4789.4—2016 方法进行[9];阪崎肠杆菌培养按照GB 4789.40—2016 方法进行[10];非目标菌株增菌采用LB 培养液36℃培养24 h 的方法。
1.5 细菌模板DNA 的提取
对于上述方法培养的增菌液,各取增菌液1 mL均加至1 个1.5 mL 无菌离心管中,8 000 r/min 离心5 min,尽量吸弃上清液,加入500 μL CTAB、40 μL蛋白酶K,震荡均匀,65℃温浴30 min;加入500 μL三氯甲烷:异戊醇(24∶1),震荡,12 000 r/min 离心15 min;吸取上层水相至1.5 mL 离心管中,加入等体积的异丙醇,震荡均匀,12 000 r/min 离心10 min;弃上清液,用预热至65℃TE 缓冲液溶解DNA(TE 量视DNA 沉淀的多少而定);加入5 μL RNA 酶溶液,37℃温浴30 min; 加入200 μL 三氯甲烷: 异戊醇(24∶1),震荡,12 000 r/min 离心15 min;吸取上层水相至新的1.5 mL 离心管中, 加入等体积的异丙醇,震荡均匀,12 000 r/min 离心10 min;弃上清液,加入70%乙醇洗涤沉淀DNA,12 000 r/min 离心1 min;弃上清液,干燥,加50 μL 预热至65℃TE 缓冲液溶解DNA。
取适量DNA 溶液原液加双蒸水稀释一定倍数后, 使用核酸蛋白检测仪测定260 nm 和280 nm 处的吸收值,从而确定DNA 浓度最优浓度范围,以便PCR 扩增。
1.6 引物探针
参考了国内外学者相关研究论文和试验结论,引物的序列见表1。 沙门氏菌特异性基因序列、阪崎肠杆菌的特异性基因序列。

表1 PCR 检测的靶基因、引物序列Table 1 Target Gene and primer sequence of PCR
沙门氏菌和阪崎肠杆菌得到如下的反应体系和扩增参数:沙门氏菌模板DNA 5 μL,上、下游引物各1 μL, 探针1 μL; 阪崎肠杆菌模板DNA 5 μL,上、下游引物各0.5 μL,探针0.5 μL;2×dd PCR 预混液15 μL,反应体积为20 μL(见表2)。
表2 双重PCR 反应体系Table 2 Dual PCR reaction system
1.7 目的基因片段PCR 扩增
实时荧光PCR 循环参数:50℃预变性2 min,94℃预变性10 min;95℃变性15 s,60℃退火60 s,循环40 次。
1.8 PCR 扩增产物测序及数据处理
将剩余的PCR 产物送至上海生工生物工程有限公司进行双向测序,应用EditSeq 软件编辑整理,在GenBank 上进行Blast 比对验证物种。
1.9 统计学分析
应用SPSS 17.0 软件对数据进行统计学分析,计量资料已均数±标准差(x±s)表示,数据符合正态分布,多组间比较采用单因素方差分析,两两比较采用LSD 法检验,检验水准(双侧),P<0.05 表示差异具有统计学意义,P<0.01 表示极差异具有统计学意义。
2 结果与分析
2.1 特异性试验
本研究采用双重实时荧光PCR 方法对沙门氏菌和阪崎肠杆菌的引物进行特异性研究 (见图1)。阴性菌为:副溶血弧菌(ATCC 17802)、霍乱弧菌(JL.08108)、单核细胞增生李斯特氏菌(ATCC 19111)、李斯特菌(ATCC 19119)、普通变形杆菌(ATCC 33420)、金黄色葡萄球菌(ATCC 12600)、小肠耶尔森菌(ATCC 23715)、克雷伯氏菌(ATCC 43086)、粪肠球菌(ATCC 14500)、蜡样芽胞杆菌(ATCC 11176)、奇异变形杆菌(JL08017)。沙门氏菌和阪崎肠杆菌均在35 个循环内发生显著扩增,而对照菌株均无显著性检测信号,亦未出现非特异性扩增信号,表明设计的2 对引物特异性好、识别度高、无干扰现象。 实验结果表明,引物对沙门氏菌和阪崎肠杆菌的扩增具有特异性。
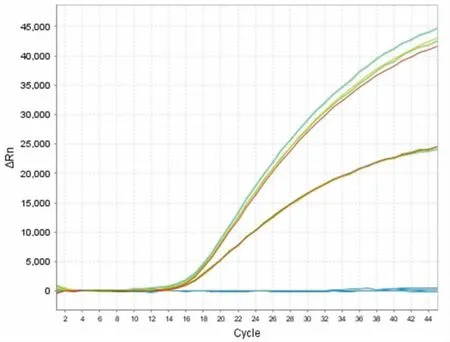
图1 沙门氏菌和阪崎肠杆菌双重引物特异性实时荧光PCRFig.1 Dual primer specific real-time fluorescent PCR of Salmonella and Enterobacter sakazakii
2.2 重复性试验
本研究对沙门氏菌和阪崎肠杆菌设定30 次重复性实验(见图2),实验结果表明,实时荧光PCR对其扩增稳定且重复性良好,实验数据可信。
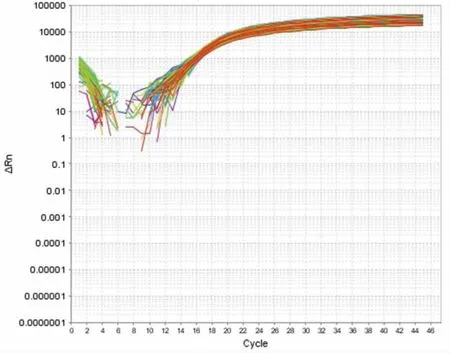
图2 沙门氏菌和阪崎肠杆菌重复性实验Fig.2 Repeatability experiment of Salmonella and Enterobacter sakazakii
2.3 灵敏性试验
将测得浓度为108CFU/mL 的DNA 溶液按照10 倍浓度依次稀释, 取浓度为108~103CFU/mL 的基因序列进行检测,前4 个梯度设置8 个重复,后4 个梯度设置4 个重复,其结果见图3 和图4。
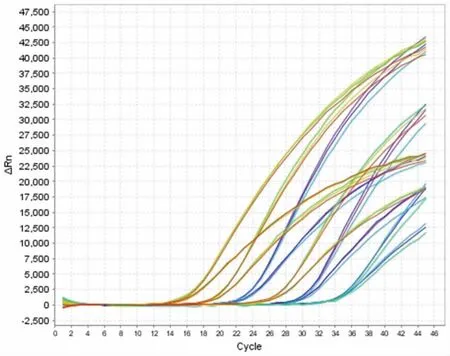
图3 沙门氏菌和阪崎肠杆菌双重灵敏性实验Fig.3 Double sensitive experiment of Salmonella and Enterobacter sakazakii
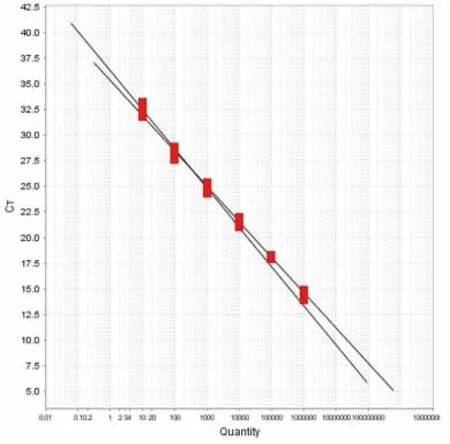
图4 沙门氏菌和阪崎肠杆菌6 个连续稀释度标准曲线Fig.4 Standard curves for six consecutive dilutions of Salmonella and Enterobacter sakazakii
从浓度103CFU/mL 开始,各梯度均出现明显扩增曲线,可判断该引物探针的检出限为浓度103CFU/mL。实验结果表明, 引物探针对沙门氏菌和阪崎肠杆菌的扩增有较好的灵敏性。
2.4 本底试验
本实验采用14 种贝类进行本底实验,每种平行3 次,进行本底实验,经实验验证均未检出沙门氏菌和阪崎肠杆菌。
3 讨论
按照我国食品安全国家标准要求, 沙门氏菌和阪崎肠杆菌在水产品中均不得被检出, 这2 种致病菌的快速检测方法开发也成为食品安全检测中的研究热点。
传统的水产品中沙门氏菌和阪崎肠杆菌的检测方法,对检验人员的经验要求较高,且耗时长、效率低,容易造成检测结果误判。 而实时荧光PCR 技术成本低、准确性高、灵敏度高、操作简单、自动化程度高,可同时检测大量样品,提高了检测效率,缩短了检测周期,实用性强,而且不易出现结果误判。
与传统培养法相比,RT-PCR 技术鉴定病原菌具有较高的灵敏度,且检测周期明显缩短,因可同时检测2 种致病菌, 比单一RT-PCR 检测更迅速、简便,且更节约成本。 双重RT-PCR 虽在时效性及操作简便等方面有明显优势, 但其要求多个不同靶基因片段同时扩增, 因而在引物设计、 反应条件的优化、反应体系的配置等环节均需反复试验,建立最佳反应条件, 以期最大程度上避免非特异性扩增及片段间的竞争性扩增,实现高效灵敏、特异性强的扩增反应,具有一定难度。
传统水产品中致病菌检测方法耗时较长, 在国际贸易中形成时间障碍, 应用有效的分子生物学等快速检测方法有助于解决主要问题。 本研究开发出了一种可用于贝类中沙门氏菌和阪崎肠杆菌的双重实时荧光PCR 检测方法, 可在一个PCR 管内特异灵敏地检测2 种目标致病菌, 适用于沙门氏菌和阪崎肠杆菌的鉴定, 在食品和水源的卫生监测和流行病学调查方面也有一定的应用潜力。 该方法具有成本低、可靠性高和检测快速的优点,易于推广使用,在食源致病菌同时多重检测平台的建立中具有广泛的应用前景。
4 结论
综上所述,本研究建立的双重实时荧光PCR 检测方法具有快速高效、灵敏度高、特异性好、重复性好的优点, 可用于贝类中沙门氏菌和阪崎肠杆菌的同时快速检测,本研究为贝类中沙门氏菌、阪崎肠杆菌的快速鉴定探索了有效的检测方法, 为控制贝类产品致病菌污染提供了有效手段。
