荧光纳米微球免疫层析技术检测新型冠状病毒研究
2023-11-01陈艳丁旭李朝阳邹明强殷宏齐小花薛强罗雁非金涌
陈艳 丁旭 李朝阳 邹明强 殷宏 齐小花 薛强 罗雁非 金涌*
(1.中国检验检疫科学研究院& 国家药监局体外快速诊断试剂技术转化与控制重点实验室 北京 100123;2.吉林国际旅行卫生保健中心;3.长春海关;4.长春海关技术中心)
0 引言
新型冠状病毒(Novel Coronavirus)感染的肺炎疫情暴发以来,核酸检测作为确诊方法,在患者临床诊断和疑似患者排查中发挥了重要作用。 但是,核酸检测存在较高的假阴性,且操作繁琐、耗时较长、对场地设备和技术人员要求较高,而免疫学检测因其快速可满足现场检测、 诊断较为准确可辅助临床确诊,故得到更多重视[1]。 新型冠状病毒抗体检测可用于新冠病毒感染的辅助诊断, 但自新冠疫苗广泛接种后,血清学抗体检测作为新冠核酸确诊的补充应用受到了一定限制[2]。 为进一步优化新冠病毒检测策略,2022 年3 月11 日,国务院联防联控机制综合组决定在核酸检测基础上,增加抗原检测作为补充,已制定印发《新冠病毒抗原检测应用方案(试行)》。 作为核酸检测的重要补充手段, 新冠抗原检测可用于特定人群的筛查,有利于提高“早发现”能力,对于快速控制疫情传播具有重大意义,但灵敏度较低。 因此,如何提供一种新冠病毒的检测试剂, 克服上述技术缺陷,是本领域技术人员亟需解决的问题。
稀土荧光纳米微球具有明显的信号放大效应,不同于量子点和荧光染料等其他荧光标记探针,稀土荧光纳米颗粒具有发射带窄、Stokes 位移大、荧光寿命长等特点,可以大大消除背景干扰,非常适用于荧光免疫分析中生物分子的荧光标记[3-4]。 本研究以稀土铕螯合物荧光纳米微球标记新冠病毒N 蛋白单克隆抗体,制备了具有高荧光强度、高稳定性的荧光纳米微球免疫探针, 建立的新冠病毒快速荧光检测侧流免疫层析技术,配套仪器使用,可实现定量分析和动态监测。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂
StedimUniSart CN140 硝酸纤维素膜(Sartorius公司);GFCP20300 玻纤、CFSP223000 吸水纸(Millpore 公司);PVC 底板(上海金标生物科技有限公司);牛血清白蛋白(BSA,98%)、碳二亚胺盐酸盐(EDC·HCl)、羊抗鼠IgG(Sigma 公司);Tween-20(北京化学试剂厂);新冠N 蛋白、新冠N 蛋白抗体(东莞菲鹏生物股份有限公司);荧光微球(0.2 μm,FCEU002,Bangs公司)。
1.1.2 主要仪器
Biodot XYZ 3050 喷膜仪、Biodot CM4000 切条机(Biodot 公司);JEM-2100 透射电子显微镜(JEOL公司);FIC-S1 荧光读数仪(苏州和迈精密仪器有限公司);ABI-Q5 荧光定量PCR 仪(赛默飞公司)。
1.2 方法与原理
1.2.1 荧光纳米微球免疫探针的制备
取0.05 M/pH 8.0 硼酸缓冲溶液400 μL,置于2 mL离心管中,加入100 μL 荧光微球,混匀;加入25 μL的EDC(10mg/mL)溶液,室温振荡活化15 min;20 000 r/min,10℃离心10 min,弃上清,用0.05 M/pH 8.0 硼酸缓冲液0.5mL 复溶;将溶液超声分散(100W,5 min)后,加入新冠N 蛋白偶联抗体,使终浓度为100 μg/mL,室温震荡反应2 h;加入BSA 使终浓度为1%,室温反应2 h;20 000 r/min,10℃离心10 min,弃上清,用0.05 M/pH 8.0 硼酸缓冲液复溶,于4℃恒温保存。
1.2.2 荧光免疫检测试纸条制备
用0.01 M 磷酸盐缓冲液(pH 7.4) 稀释新冠N蛋白抗体2 和羊抗鼠IgG 抗体, 用点膜仪将其包被于硝酸纤维素膜上, 形成间隔0.4 cm 的检测线(T线)和质控线(C 线),37℃烘干。 样品垫用0.01 mol/L Tris 溶液 (含0.5% Tween-20,pH 8.0) 浸泡后于37℃烘干。将样品垫、吸水垫分别粘贴在带硝酸纤维素膜的PVC 背衬上,用切条机切成4 mm 宽的条状,即制成试纸条,干燥保存备用。 在使用时,对样品进行一定处理后再滴入样品垫上即可(图1A),样品垫上可制作出专门的加样孔。
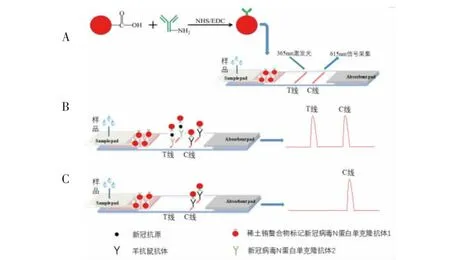
图1 新冠病毒抗原检测荧光免疫试纸条检测原理图Fig.1 Detection of novel coronavirus by fluorescent nanomicrosphere immunochromatographyprinciple model
1.3 荧光免疫检测试纸条检测原理
采用双抗体夹心法来检测待测样品中是否含有新冠状病毒。检测阳性样品时,样品中的新冠状病毒与荧光免疫探针上所连接的新冠状病毒抗体1 结合, 该复合物通过层析作用在硝酸纤维素膜内部向前移动, 经过检测区时与包被的新冠状病毒抗体2结合, 形成荧光微球—新冠状病毒抗体1—新冠状病毒—新冠状病毒抗体2 复合物(抗体1 和2 分别为针对N 蛋白不同表面决定簇的单克隆抗体),因此,T 线将出现条带,结果为阳性(图1B);检测阴性样品时,样本中不含新冠抗原,无法形成上述免疫复合物,则T 线不出现条带,结果为阴性(图1C)。通过荧光检测仪测定T 线上的荧光强度,测定新冠病毒的含量。
1.4 临床样品检测
取咽拭子采集的新型冠状灭活病毒上清液,用样品提取液分别进行10 倍、100 倍、1 000 倍稀释,用移液器准确吸取80 μL 待检样本,垂直缓慢滴加于检测卡加样孔中,加样后开始计时,10 min 读取结果。同时用荧光定量PCR 技术和胶体金试纸条进行检测,比较检测结果。
2 结果
2.1 荧光纳米微球免疫探针的表征
稀土铕螯合物纳米微球与新冠抗体通过碳二亚胺法共价偶联,获得荧光微球—抗体复合纳米颗粒,用透射电子显微镜对复合纳米颗粒结构进行表征。结果显示,荧光纳米微球表面光滑,内部包被有荧光物质(图2A);荧光纳米微球—抗体复合物表面有黑色物质附着,表明新冠抗体成功偶联在荧光纳米微球的表面(图2B)。

图2 透射电子显微镜表征荧光纳米微球免疫探针Fig.2 Fluorescent nanosphere immune probes characterized by transmission electron microscope
2.2 灵敏度实验及荧光检测标准曲线的建立
取新冠病毒N 蛋白,用样品提取液进行稀释,获得浓度为0、0.001、0.01、0.1、1、10 ng/mL, 用荧光免疫探针最佳反应浓度(0.01M PB(pH7.4)缓冲液稀释200 倍)的试纸条进行测试后,通过荧光检测仪检测T、C 线荧光强度, 以相对荧光强度为纵坐标,不同标品质量浓度为横坐标,绘制新冠病毒N-蛋白检测的标准曲线。由图3 可知,随着样品中新冠病毒N-蛋白含量的增加,检测线T 线颜色逐渐变深,当新冠病毒N-蛋白浓度为0.01 ng/mL 以上时,T、C 线显色。 由图4 可知,新冠病毒N-蛋白的标准抑制曲线回归方程为y=2 237.81 lgx+6 724.8,相关系数R2=0.99,检测范围为0.01~10.00 ng/mL。 根据空白测定平均值加3 倍标准偏差,求得最低检测限为0.01 ng/mL。

图3 新冠病毒N-蛋白试纸条检测灵敏度实验结果Fig.3 Test results of the sensitivity of novel coronavirus N-protein test strip
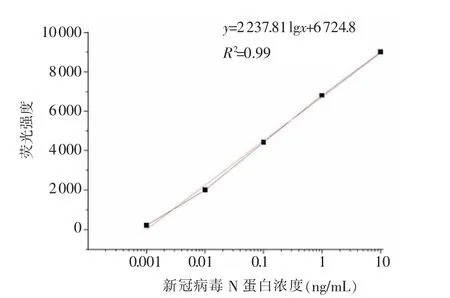
图4 新冠病毒N-蛋白的荧光检测标准曲线Fig.4 Standard curve of fluorescence detection of novel coronavirus
2.3 特异性试验
用于做特异性试验的病原菌或重组蛋白有新冠病毒S 蛋白、新冠病毒RBD 蛋白、禽流感H1N1 病毒分离物等。 将待测物的浓度稀释为100 ng/mL,用移液器准确吸取80 μL 待检样本, 垂直缓慢滴加于检测卡加样孔中,加样后开始计时,10 min 后读取结果。 试验结果见图5。

图5 特异性试验结果Fig.5 Specific test result
结果显示, 新冠病毒S 蛋白、 新冠病毒RBD 蛋白、甲型H1N1 病毒分离物等与本发明试纸条试剂盒无交叉反应,表明本研究试纸条具有良好的特异性。
2.4 新冠灭活病毒的检测
取新冠灭活病毒上清液, 用样品提取液10 倍、100 倍稀释,用移液器准确吸取80 μL 待检样本,垂直缓慢滴加于检测卡加样孔中,加样后开始计时,10 min 后读取结果,同时用荧光定量PCR 和胶体金试纸条进行检测,实验结果见图6 和表1。 当新冠灭活病毒培养上清液稀释10 倍和100 倍时,T、C 线显色,为阳性结果,表明本试纸条可以检测新冠灭活病毒。 使用荧光定量PCR 进行检测,至104倍稀释液检测结果为阳性,105倍以上稀释液检测结果为阴性。 使用新冠灭活病毒胶体金试纸条进行检测,10倍稀释液检测结果为阳性,100 倍以上稀释液检测结果为阴性。
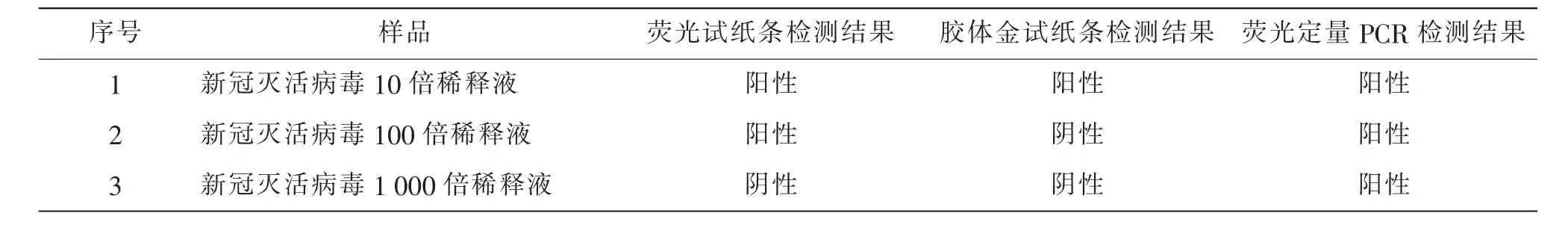
表1 新冠灭活病毒检测结果Table 1 Test results of inactivated novel coronavirus

图6 新冠灭活病毒检测结果Fig.6 Test results for inactivated novel coronavirus
2.5 稳定性试验
将试纸条室温干燥保存, 观察不同保存时间的检测结果,确定其有效期。试纸条在12 个月内,其外观、灵敏度、特异性均未发生变化,试验结果表明,本试纸条在室温干燥条件下有效期为1 年。
3 讨论
Novel Coronavirus 是发现的第7 种β 属冠状病毒, 含有14 个ORF 共编码27 种蛋白质。 靠近3′端约占基因组1/3 的ORF 编码至少4 种结构蛋白,包括特异性结合宿主细胞受体的棘突蛋白(S),包膜形成相关的膜蛋白(M)、包膜蛋白(E),病毒组装相关的核衣壳蛋白(N)[5-7]。 抗原检测通常测的是表达量高、 相对保守的核衣壳蛋白, 因此本研究采用N蛋白作为免疫学检测方法的靶标。
侧流免疫层析法LFIA 技术由BEGGS 等[8]最早开发。 目前在Novel Coronavirus 的LFIA 检测中,ZHOU 等[9]设计并开发了一种以量子点标记的LFIA,与重组Novel Coronavirus 的S 蛋白共价连接后,采用双抗原夹心法测定人血清中总抗体水平的方法。BAYIN 等[10]开发了一种以纳米磁珠标记的免疫层析技术,该技术基于超顺磁性纳米粒子(SMNP)和巨磁阻(GMR)传感系统的LFIA 方法(夹心法),可同时定量检测抗Novel Coronavirus 的IgM 和IgG, 其LOD分别为10 ng/mL 和5 ng/mL。
镧系元素螯合物具有出色的荧光特性,铕(Ⅲ)螯合染色微粒修饰的羧酸基团可增加荧光标记的稳定性并减少干扰,与传统的荧光标记相比,具有更高的分析灵敏度和更大的检测范围[11]。 本研究利用稀土铕荧光纳米微球表面的活性羧基和抗体的游离氨基发生缩合反应,将抗体共价结合于荧光微球表面,制备了具有高荧光强度、 高稳定性的荧光纳米微球免疫探针。 制备的荧光免疫层析试纸条与仪器配套使用,单样本全程检测时间10~15 min,最低检测限可达0.01 ng/mL, 与胶体金试纸条 (最低检测限为0.1 ng/mL)相比,灵敏度提高了10 倍。
综上所述, 本研究建立了一种基于稀土铕荧光纳米颗粒标记的新冠病毒荧光免疫快速检测技术,可实现对新冠病毒的定量分析和动态监测。 本方法操作简便、快速、灵敏、成本低、体积小,适合基层医疗机构、公共卫生应急监测场所,可用于新冠病毒的快速筛查诊断。
