一体化PET/MRI评估帕金森病患者脑葡萄糖代谢与局部一致性的关系
2023-10-31臧振享宋天彬崔碧霄杨宏伟
臧振享,宋天彬,崔碧霄,杨宏伟,张 春,卢 洁*
(1.首都医科大学宣武医院放射与核医学科,北京 100053;2.磁共振成像脑信息学北京市重点实验室,北京 100053)
帕金森病(Parkinson's disease, PD)是最常见的神经退行性疾病之一,主要临床表现包括静止性震颤、肌张力增高、强直、运动迟缓及平衡障碍等[1-3]。既往18F-FDG PET研究[4]发现PD患者大脑存在异常葡萄糖代谢模式,主要包括运动环路葡萄糖代谢异常上升,而视觉区、顶叶、前额叶等非运动相关脑区葡萄糖代谢异常下降。静息态功能MRI(resting-state functional MRI, rs-fMRI)空间与时间分辨率均较高,患者依从性好,是研究PD脑功能活动的常用影像学方法[5]。局部一致性(regional homogeneity, ReHo)反映相邻体素时间序列的一致性,常用于研究PD患者脑局部活动[6]。PD患者大脑运动区、基底节区ReHo降低而后扣带回、枕叶及颞叶ReHo升高[7]。葡萄糖代谢是评估脑活动的金标准,PD患者异常葡萄糖代谢与异常ReHo在运动环路、视觉区及顶叶等脑区的空间分布相似,但目前对于二者是否存在相关性尚不明了。本研究以一体化18F-FDG PET/MRI观察PD患者脑葡萄糖代谢与ReHo的关系。
1 资料与方法
1.1 研究对象 前瞻性纳入2019年10月—2020年5月34例于首都医科大学宣武医院确诊的PD患者(PD组),男13例、女21例,年龄45~72岁、平均(62.3±6.4)岁;满足各项中的至少3项[2]:①单侧起病;②静止性震颤;③疾病逐渐进展;④症状不对称,起病侧受累更重;⑤经左旋多巴治疗效果明显,统一PD评定量表(unified PD rating scale, UPDRS)-Ⅲ改善>30%;⑥左旋多巴导致严重异动症;⑦左旋多巴疗效持续5年或更长时间以上;⑧病程≥10年。同期招募25名性别、年龄相匹配的健康受试者为对照组,男8名、女17名,年龄54~70岁、平均(60.0±4.5)岁。本研究经院伦理委员会批准(临研审[2023]044号),检查前所有受试均签署知情同意书。PET/MR检查前以UPDRS-Ⅲ、Hoehn-Yahr(H&Y)分级、简易精神状态检查(mini-mental state examination, MMSE)及蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)对PD组患者进行评估。
1.2 仪器与方法 采用联影uPMR790一体化PET/MR扫描仪、24通道相控阵头线圈。嘱PD患者检查前12 h停药,所有受试者禁食6 h。检查前1 h经手背静脉注射18F-FDG显像剂(3.7 MBq/kg体质量),嘱受试者仰卧、闭目并保持安静状态,避免头动,行颅脑一体化PET/MR扫描,获取PET数据时间窗为10 min,采用时间飞跃法(time of flight, TOF)进行重建,层厚 2.8 mm,FOV 300 mm×300 mm,迭代次数4,子集20次,矩阵256×256,半高宽3 mm,体素2.4 mm×2.4 mm×2.8 mm。以TR 7.9 ms、TE 2.8 ms、矩阵256×256、扫描层数176、层厚1 mm、FOV 256 mm×256 mm 采集3D结构像T1WI。rs-fMRI参数:TR 2 000 ms,TE 30 ms,FA 90°,扫描层数31,矩阵64×64,FOV 256 mm×256 mm,体素3.5 mm×3.5 mm×3.5 mm,层间隔0.7 mm,扫描时间8 min。
1.3 数据处理 采用SPM软件,通过以下步骤对rs-fMRI数据进行预处理并计算ReHo:①校正头动;②校正时间层;③与高清3D T1WI进行配准;④分割解剖结构;⑤根据3D结构像T1WI进行空间标准化;⑥去除脑脊液、白质、头动及全脑平均信号;⑦采用0.01~0.1 Hz进行滤波;⑧计算时间序列内相邻27个体素之间的ReHo;⑨计算标准化ReHo;⑩高斯空间平滑,平滑核为8 mm。
基于高清3D结构像 T1WI对PET图像进行空间标准化,以8 mm平滑核进行高斯空间平滑。利用迭代技术计算标准摄取值比值(standard uptake value ratio, SUVR)[8]:①将全脑模板设置为参考区域,并命名为“Ref0”;②根据Ref0平均值计算SUVR,通过独立样本t检验计算与之存在差异的脑区(检验水准:未校正P<0.05),并将其命名为“SigRegion”;③将“SigRegion”自“Ref0”中剔除,剩余区域均为差异不显著脑区,将其定义为“Ref1”;④将“Ref1”定义为新的参考区域,重复步骤②~④,直至所生成 “Ref1”与“Ref0” 的残差≤5%;⑤将最后生成的“Ref1”定义为最终参考区域,计算SUVR。
1.4 统计学分析 采用SPSS 26.0和SPM 26.0统计分析软件。以频数表示计数资料,采用χ2检验比较组间患者性别差异;以±s表示计量资料,采用t检验比较组间年龄及头动幅度差异。以一般线性模型分析组间SUVR(以患者性别、年龄作为协变量)、ReHo(以性别、年龄及头动幅度为协变量)差异,并以FDR法校正结果。计算组间SUVR与ReHo均存在差异脑区(即差异重叠脑区)的SUVR和ReHo平均值,以Pearson相关性分析观察重叠脑区SUVR与ReHo的线性关系,以及PD患者差异重叠脑区SUVR、ReHo与PD病程和临床量表评分的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 PD组与对照组受试者性别(χ2=0.24,P=0.62)、年龄(t=1.55,P=0.13)及头动幅度[(0.21±0.08)mmvs. (0.22±0.09)mm,t=-0.53,P=0.60]差异均无统计学意义。PD组患者病程(9.59±4.04)年,UPDRS-Ⅲ评分(59.71±15.00)分,H&Y分级(3.00±0.83)级,MMSE评分(23.07±3.66)分,MoCA评分(26.67±2.97)分。
2.2 葡萄糖代谢与ReHo 相比对照组,PD组初级感觉运动区、中央旁小叶、壳核、苍白球以及丘脑SUVR升高(P均<0.05,经FDR校正),而视觉区、颞叶及顶叶SUVR降低(P均<0.05,经FDR校正),见图1;视觉区、颞叶及顶叶ReHo升高(P均<0.05,经FDR校正),中央旁小叶、壳核、苍白球、丘脑、脑干、额下回眶部及后扣带回ReHo降低(P均<0.05,经FDR校正),见图2。PD组与对照组SUVR与ReHo均存在差异的运动相关脑区为双侧壳核及双侧中央旁小叶,非运动相关脑区则为双侧颞下回、双侧枕中回及左侧距状裂,共715体素,见表1及图3。以上9个重叠脑区SUVR与ReHo的组间差异(t值)具有显著空间相似性(r=-0.84,P=0.005)。
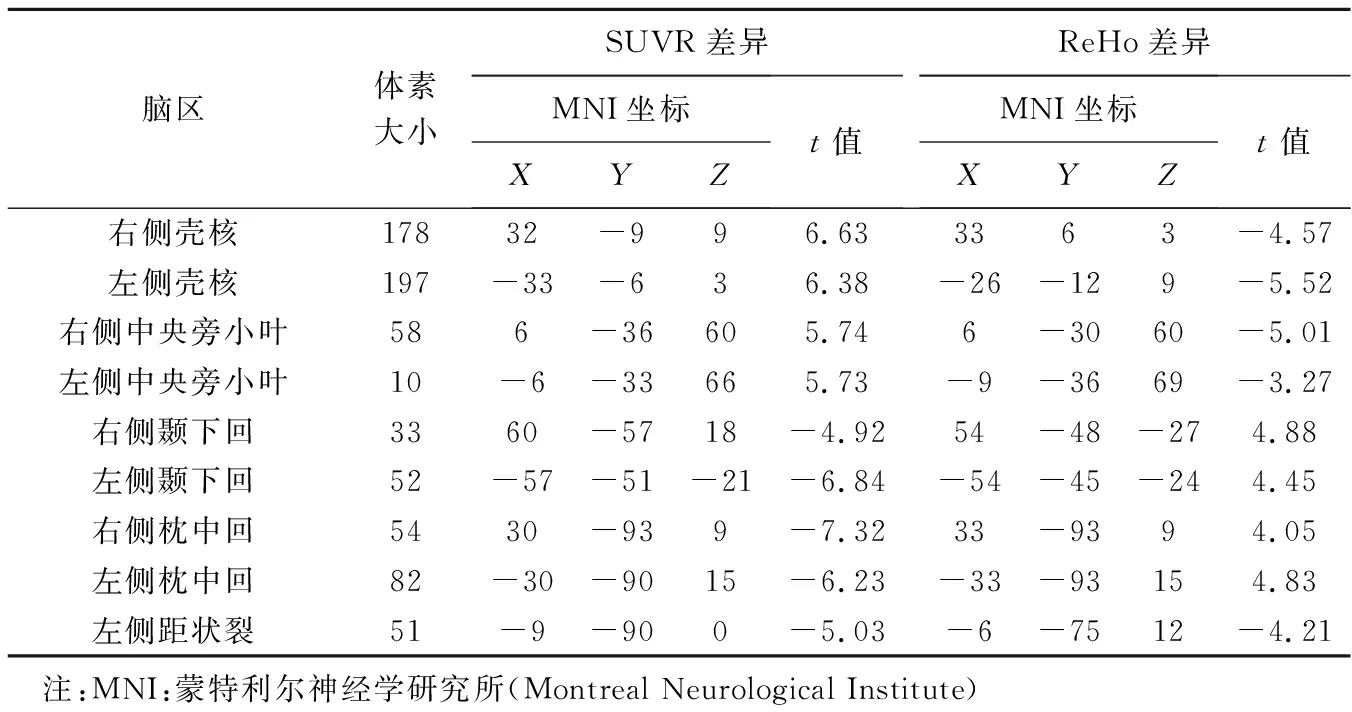
表1 对比PD组与对照组SUVR及ReHo差异重叠脑区
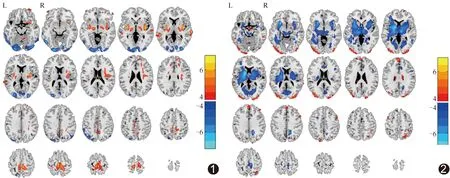
图1 PD组SUVR较对照组升高(暖色)及降低(冷色)脑区分布图 图2 PD组ReHo较对照组升高(暖色)及降低(冷色)脑区分布图
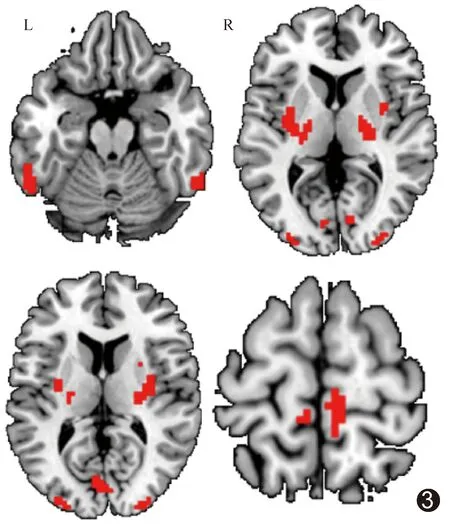
图3 PD组与对照组SUVR与ReHo均存在差异脑区分布图
PD组及对照组组内重叠脑区SUVR平均值与ReHo平均值均无显著相关(P均>0.05)。PD患者双侧壳核ReHo均与病程呈正相关(左侧:r=0.36,P=0.04;右侧:r=0.48,P<0.01),左侧距状裂SUVR与H&Y分级呈正相关(r=0.44,P=0.01)。各重叠脑区SUVR与ReHo均与UPDRS-Ⅲ评分无显著相关性(P均>0.05)。
3 讨论
运动相关脑区葡萄糖代谢升高及枕叶、顶叶等非运动相关脑区葡萄糖代谢降低是PD患者葡萄糖代谢异常主要表现[9-10],且多出现于PD临床前驱期[11],与疾病进展密切相关;其中,运动皮质、基底节及丘脑葡萄糖代谢升高与PD运动障碍相关,而视觉区、顶叶及额叶葡萄糖代谢下降则与非运动障碍如视幻觉和认知障碍有关[12-13]。本研究PD组脑ReHo表现为基底节、丘脑、中央旁小叶、距状裂及后扣带回异常下降,而视觉区、顶叶及颞叶异常升高,与既往研究[14-15]结果相符。PD患者葡萄糖代谢差异与ReHo差异的空间分布模式相似,涵盖中央旁小叶、壳核等运动相关脑区,以及枕叶、颞叶、顶叶等非运动相关脑区;各脑区葡萄糖代谢改变与ReHo呈相反趋势,即运动相关脑区葡萄糖代谢异常升高而ReHo降低,非运动相关脑区葡萄糖代谢异常降低而ReHo升高。运动相关脑区葡萄糖代谢升高表明PD患者静息态下脑活动增加,与其运动障碍相关[16-17];ReHo降低在上述区域中主要集中于基底节及丘脑区域,与PD患者多巴胺缺失相关[14]。
虽然PD患者脑葡萄糖代谢异常与ReHo异常空间分布相似而趋势相反,但本研究后验式分析结果表明,PD组及对照组组内差异重叠脑区SUVR平均值与ReHo平均值均无显著相关性,与WANG等[18]的结果相符,即葡萄糖代谢异常空间模式虽与ReHo相似,但二者之间并不存在线性相关关系,可能与以下因素相关:①二者之间缺少其他中介因素;②ReHo代表局部神经元信号的同步性,却不能反映神经元长程投射的信号传递情况,而葡萄糖代谢则可能与PD长程神经元信号传递能量消耗有关;③ReHo是通过动态时间序列计算而得出,体现相邻体素动态变化的相似性,而葡萄糖代谢则反映静态能量消耗。
综上,PD患者脑葡萄糖代谢与ReHo异常空间分布相似,但其间不存在线性相关关系;具体相关机制有待进一步观察。
