动态对比增强MRI及弥散加权成像参数预测结直肠癌微卫星不稳定
2023-10-31马文婷朱袁慧魏照坤王莉莉
马文婷,朱袁慧,魏照坤,王莉莉
(甘肃省人民医院放射科,甘肃 兰州 730000)
微卫星指由2~6个碱基重复串联组成的DNA序列;如其复制过程中发生错误,错配修复系统将对其修复;错配修复系统中的任一构成蛋白(hMLH1、hMSH2、hMSH6、hPMS2)失活[1]均可致微卫星不稳定(microsatellite instability, MSI),而构成蛋白均正常表达则微卫星稳定(microsatellite stability, MSS)。结直肠癌MSI发生率低于MSS,中位发生率仅19%[2]。相比MSS者,结直肠癌MSI患者总生存期较长,而3年复发率[3]和淋巴结转移均明显较低[4],即预后较好[5]。结直肠癌MSI患者对免疫抑制剂敏感[6],而MSS患者对5-氟尿嘧啶敏感[7]。美国国家综合癌症网实践指南[8]、欧洲肿瘤内科学会及日本结直肠癌协会均推荐对结直肠癌患者检测MSI及行KRAS、NRAS和BRAF基因检测,以助于选择免疫治疗方法及评估疗效。目前主要采用免疫组织化学或聚合酶链反应(polymerase chain reaction, PCR)检测微卫星[9],均需通过侵入性操作获取标本。本研究评价动态对比增强MRI(dynamic contrast enhanced-MRI, DCE-MRI)及弥散加权成像(diffusion weighted imaging, DWI)参数预测结直肠癌MSI的价值,以期以非侵入方法早期评估结直肠癌MSI。
1 资料与方法
1.1 一般资料 收集2015年1月—2023年1月于甘肃省人民医院就诊的66例单发结直肠癌患者,男38例、女28例,年龄22~83岁、平均(60.6±12.3)岁;其中11例MSI(MSI组)、55例MSS(MSS组)。纳入标准:①术后病理诊断为结直肠癌,且均有PCR检测MSI状态的结果;②于术前1周内接受DCE-MRI及DWI。排除标准:①MR检查前曾接受放射、化学等抗肿瘤治疗;②图像质量差。检查前患者均签署知情同意书。
1.2 仪器与方法 采用Siemens Magnetom Skyra 3.0T MR仪及16通道相控阵线圈扫描腹部,采集常规T1WI、T2WI、高分辨率T2WI及DWI(b=1 000 s/mm2);之后经肘前静脉以流率3.5 ml/s注射对比剂钆喷替酸葡甲胺(Gd-DTPA)0.2 ml/kg并跟注20 ml生理盐水,延迟16 s开始行DCE-MRI,总扫描时间为284 s。DCE-MRI参数:TR 5.08 ms,TE 1.77 ms,FA 15°,层厚3.5 mm,FOV 260 mm×260 mm,矩列154×192,每层采集时间0.36 s,总图像200幅。
1.3 分析图像 将数据发送至Siemens Tissue 4D后处理工作站。由2名工作3年以上的影像科主治医师采用双盲法于DCE-MRI中选取完整包括病变肠管及周围系膜筋膜区域的感兴趣体积(volume of interest, VOI),系统自动生成灌注图像。于灌注图内病灶灌注强度最明显区域分别放置2个圆形或椭圆形ROI(ROI1及ROI2),测量其灌注参数,包括容积转移常数(volume transfer constant, Ktrans)、血管外细胞外间隙容积分数(extravascular extracellular volume fraction, Ve)、速率常数(rate constant, Kep)和初始强化曲线下面积(initial area under the curve, iAUC);于表观弥散系数(apparent diffusion coefficient, ADC)图上相同区域放置2个ROI(ROI3及ROI4),记录其ADC。取2名医师测量结果的平均值进行分析。见图1、2。

图1 MSS组患者,女,55岁,直肠癌 A、B.腹部轴位灌注图,蓝箭示ROI1、红箭示ROI2; C、D.ADC图,蓝箭示ROI3、红箭示ROI4
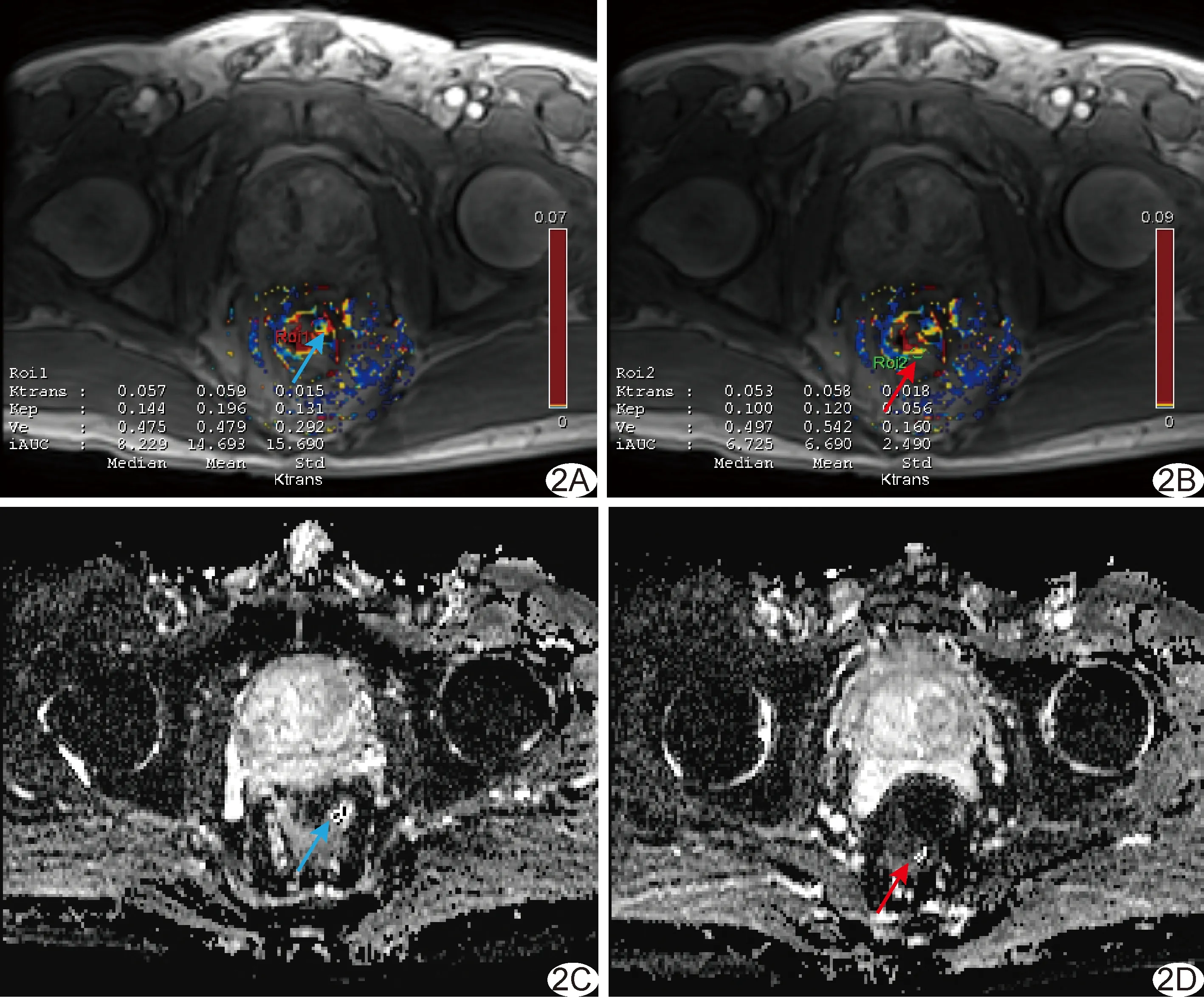
图2 MSI组患者,男,80岁,直肠癌 A、B.腹部轴位灌注图,蓝箭示ROI1、红箭示ROI2; C、D.ADC图,蓝箭示ROI3、红箭示ROI4
1.4 评估MSI 留取标本,采用MSI检测试剂盒(北京阅微基因技术)行多重PCR,检测BAT-25、BAT-26、NR-21、NR-24、NR-27和MON0-27共6种标记物;根据不稳定标志物种类数将微卫星状态分为3类:不稳定标志物种类数≥2为微卫星高度不稳定(MSI-high, MSI-H),≥1且<2为微卫星低度不稳定(MSI-low, MSI-L),0为MSS。参考贝塞斯达结直肠癌指南[10],将MSI-L归为MSS,以MSI-H为MSI。
1.5 统计学分析 采用SPSS 27.0统计分析软件。以Shapiro-Wilk检验分析计量资料的正态性。以±s描述符合正态分布者,行独立样本t检验;以中位数(上下四分位数)描述不符合者,行Mann-WhitneyU检验。以χ2检验比较定性资料。采用受试者工作特征(receiver operating characteristic, ROC)曲线评估冠状位参数及ADC预测结直肠癌MSI的效能,计算其曲线下面积(area under the curve, AUC),并以DeLong检验加以比较。采用多因素logistic回归,基于诊断效能最高的DCE-MRI参数及ADC建立联合模型并评估其诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 MSI组病理分化程度高于MSS组(P<0.001)。组间病灶发生部位差异有统计学意义(P<0.001),其余差异均无统计学意义(P均>0.05)。见表1。
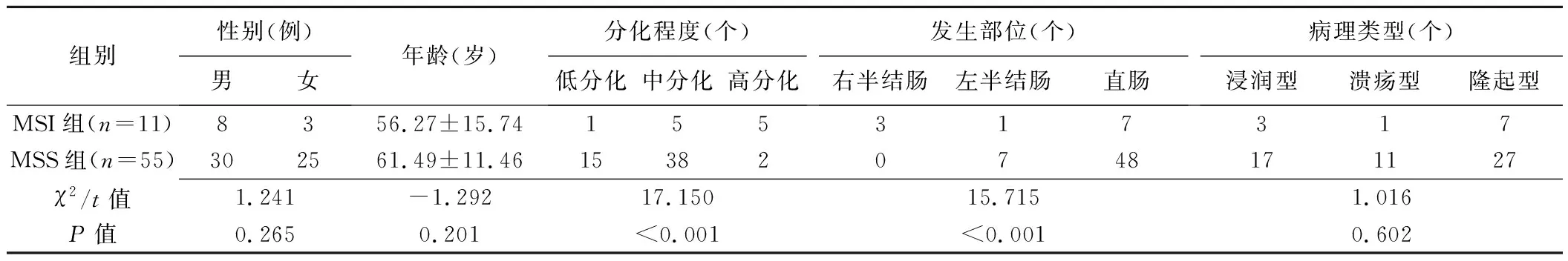
表1 66例直肠癌患者及病灶一般资料
2.2 MRI参数 MSI组Ktrans、Kep及iAUC低于MSS组(P均<0.05),ADC显著高于MSS组(P<0.001),而Ve与MSS组差异无统计学意义(P=0.536) 。见表2。

表2 66例直肠癌MRI功能参数
2.3 ROC曲线分析 灌注参数中Kep的AUC为0.890,高于Ktrans、iAUC、ADC(AUC=0.822、0.830、0.879,Z=3.456、3.173、3.170,P均<0.001)。Kep+ADC的AUC为0.970,高于单一Kep及ADC(AUC=0.890、0.879,Z=6.171、3.978,P均<0.001)。见表3、图3。

表3 MRI功能成像参数预测结直肠癌MSI的效能

图3 各MRI参数预测结直肠癌MSI的ROC曲线
3 讨论
了解结直肠癌微卫星状态对于制定治疗方案及评估预后意义重大。Ktrans及Kep是反映血管通透性的常用MRI参数[11]。Ktrans代表对比剂从血液转移到细胞间质的速率,显示肿瘤微循环状态,而Kep代表对比剂从血管外-细胞外间隙转移回血液的速率,显示实际肿瘤的供血量及毛细血管通透性,能准确反映肿瘤微血管环境[12]。半定量参数iAUC指一定时间内保留在肿瘤内的对比剂的量,与肿瘤血流灌注水平和组织间隙密切相关,反映肿瘤血供及其增殖速度[12-13]。本研究对66例结直肠癌行灌注成像及DWI,结果表明,结直肠癌MSI患者Ktrans、Kep及iAUC均低于MSS患者,ADC明显高于MSS患者,而Ve与MSS患者无显著统计学差异。MSS患者肿瘤增殖速度较MSI更快,肿瘤细胞密集致其ADC明显减低;且肿瘤快速增殖生成大量异常血管,血管壁扩张、血管内皮细胞间隙增大,使肿瘤血管通透性升高,故MSS患者Ktrans、Kep及iAUC更高。本研究中,相比结直肠癌MSS患者,MSI患者肿瘤增殖速度较慢,细胞相对稀疏,新生肿瘤血管较少,血管壁通透性较低,其肿瘤Ve略低于MSS但差异无统计学意义,与既往研究[14]结果相符;分析原因,可能是直肠腺癌微循环血流分布不均,而Ve间接反映局部细胞密度及通透性,具有不稳定性,不能准确反映整体肿瘤的血供状态。
Ktrans个体差异大,且易受全身血流灌注的影响,高血压等影响个体心输出量的情况均可对其产生影响。相比Ktrans,Kep能更准确地反映肿瘤微血管环境。本研究结果显示,单一以Ktrans、Kep、iAUC及ADC独立预测结直肠癌MSI的AUC分别为0.822、0.890、0.830、0.879,Kep的AUC高于Ktrans、iAUC及ADC;而Kep联合ADC可提高诊断效能,AUC达0.970,高于单一Kep及ADC。上述结果表明,DCE-MRI结合DWI可作为无创评估结直肠癌微卫星状态的方法。
本研究中MSI结直肠癌病理高分化型占比较高;右半结肠肿瘤发生MSI的概率亦较高可能与左、右半结肠血供、代谢、肠道微生物差异有关。临床实践中,结合临床资料有助于评估结直肠癌MSI。
综上,DCE-MRI联合DWI参数可有效评估结直肠癌MSI。但本研究为单中心回顾性分析,样本量小且分布不均,有待进一步完善。
