MR T1WI瘤体及瘤周影像组学联合临床特征预测乳腺癌新辅助化疗疗效
2023-10-31徐海敏马雨竹
徐海敏,戴 瑶,马雨竹,帅 鸽,张 妤*
(1.苏州大学附属独墅湖医院放射科,江苏 苏州 215004;2.苏州大学附属第一医院放射科,江苏 苏州 215006)
乳腺癌是威胁全球女性健康的恶性肿瘤之一[1]。新辅助化疗(neoadjuvant chemotherapy, NAC)已成为局部进展期乳腺癌早期治疗的标准方案,治疗后达病理完全缓解(pathological complete response, pCR)者无病生存期和总生存期更长,但仅占10%~50%[2]。除肿瘤自身异质性外,NAC治疗乳腺癌效果还受瘤周区域特殊细胞及组织如瘤周脂肪、腺体等的影响[3-4]。致密型乳腺肿瘤对NAC反应低[5],而MR T1WI评估乳腺密度百分比与X线摄影的相关性良好[6]。本研究观察基于T1WI瘤体及瘤周MR影像组学[7-8]联合临床及影像学特征预测乳腺癌NAC疗效的价值。
1 资料与方法
1.1 一般资料 回顾性收集2016年1月—2022年12月于苏州大学附属第一医院接受NAC的110例女性乳腺癌患者,年龄24~70岁、平均(45.5±10.9)岁;87例单发、23例多发(2~4个),对多发肿瘤选取最大者;43例NAC后达pCR、67例达非pCR(non-pCR)。纳入标准:①经活检病理诊断为原发肿块型浸润性乳腺癌;②NAC前2周内接受多参数MR检查,包括T1WI和动态对比增强MRI(dynamic contrast enhanced MRI, DCE-MRI);③NAC后均接受手术治疗,并以Miller-Payne评分系统评估NAC疗效,将1~4级归为non-pCR、5级归为pCR。排除标准:①临床或 MRI资料不全或质量不佳;②接受NAC外其他类型抗肿瘤治疗。本研究经院医学伦理委员会批准[(2022)伦研批第167号],检查前患者均签署知情同意书。
1.2 仪器与方法 采用 GE Signa HDx 3.0T或Siemens Skyra 3.0T MR扫描仪及8通道双侧乳腺专用相控表面线圈,嘱患者俯卧,使双乳自然悬垂于线圈内,采集乳腺MRI;参数(GE设备/Siemens设备):T1WI,TR 440 ms/6 ms,TE 7.86 ms/2.5 ms,层厚5.0 mm/1.2 mm;DCE-MRI,TR 4.32 ms/4.50 ms,TE 2.1 ms/1.7 ms,层厚1.4 mm/1.2 mm,FOV 350 mm×350 mm/448 mm×448 mm,矩阵512×512/320×320。以3 ml/s流率团注0.5 mmol/ml对比剂钆喷替酸葡甲胺(Gd-DTPA)0.1 mmol/kg体质量后采集5个时相图像,行动态增强扫描。
1.3 分析图像 由具有8及20年工作经验的影像科主治医师及主任医师各1名(医师A、B)以盲法阅片,依据乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)标准分析图像,记录纤维腺体组织量(fibro glandular tissue, FGT)(脂肪型、散在腺体型、不均匀型或致密型),DCE-MRI所示乳腺实质背景强化(background parenchymal enhancement, BPE)(极轻度、轻度、中度及重度),以及肿瘤形状(规则/不规则)、边缘(清晰/不清晰)和最大径;将脂肪型和散在腺体型FGT归为低FGT组,将不均匀型和致密型FGT归为高FGT组;将极轻度和轻度BPE归为轻微强化,中度和重度BPE归为明显强化[9]。2名医师意见有分歧时,经协商达成一致。
1.4 提取影像组学特征 将T1WI及DCE-MRI第2期图像导入3D Slicer软件(version 5.0.3, https://www.slicer.org/)行偏差校正,并重采样至体素1 mm×1 mm×1 mm。由医师参考DCE-MRI于T1WI中逐层手动勾画肿瘤ROI,软件自动将肿瘤边缘外扩8 mm为肿瘤边界,超出乳腺边界时手动予以去除,融合获得瘤体及瘤周感兴趣体积(volume of interest, VOI),见图1。采用Python软件中的PyRadiomics库分别基于瘤体及瘤周VOI提取1 130个影像组学特征,包括18个一阶特征、14个形态学特征、75个二阶特征、279个拉普拉斯-高斯滤波器滤波特征及744个小波变换特征;间隔1个月后随机抽取30例图像,由医师A再次提取影像组学特征,以组内相关系数(intra-class correlation coefficient, ICC)加以评估,之后保留观察者内和观察者一致性较好(ICC>0.80)者。
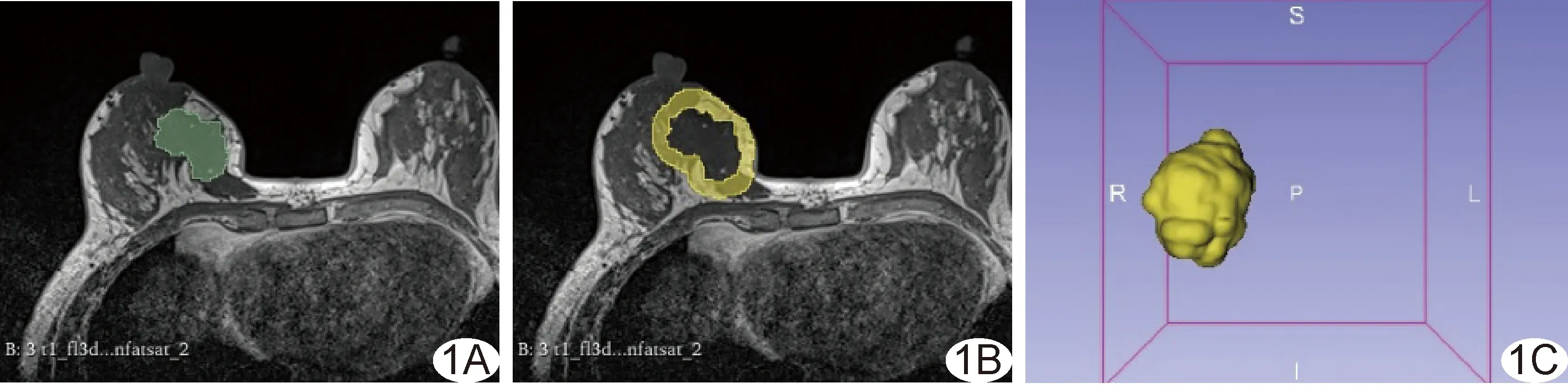
图1 基于乳腺轴位MR T1WI获得瘤体及瘤周VOI示意图 A.逐层勾画肿瘤ROI(绿色区域); B.肿瘤边缘自动外扩8 mm,获得瘤周ROI(黄色区域); C.融合形成瘤体+瘤周VOI
1.5 构建模型及统计学分析 按7∶3比例将110例分为训练集(n=76,30例pCR及46例non-pCR)和测试集(n=34,13例pCR及21例non-pCR)。采用R语言(版本3.5.3,www.R-project.org)构建模型及进行统计学分析。基于训练集数据以Mann-WhitneyU检验保留pCR与non-pCR肿瘤之间差异有统计学意义的特征(P<0.05),以随机森林法计算其权重,并行Spearman相关性分析,删除rs>0.9者;再以最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法及10折交叉验证筛选最佳特征。利用logistic回归分类器分别构建基于瘤体、瘤周、瘤体+瘤周的影像组学模型,即模型瘤体、模型瘤周及模型瘤体+瘤周,计算其放射学分数(Radscore)。
2 结果
训练集与测试集患者一般资料及病灶MRI表现差异均无统计学意义(P均>0.05)。见表1。

表1 训练集与测试集患者一般资料及病灶MRI表现比较
2.1 构建临床模型 单因素logistic回归分析显示,淋巴结转移、Ki-67指数、HER-2表达、ER表达、PR表达及MRI所示BPE和肿瘤形状均为NAC治疗乳腺癌效果的影响因素(P均<0.05,表2);多因素logistic回归分析显示,淋巴结转移(OR=0.17)、HER-2表达(OR=4.52)、PR表达(OR=0.20)均为独立预测因子(P均<0.05,表2)。临床模型在训练集和测试集的AUC分别为0.85和0.79(图2及表3)。

表2 单因素及多因素logistic回归分析筛选NAC治疗乳腺癌效果的临床及影像学独立预测因子

表3 各模型预测NAC治疗乳腺癌效果的效能
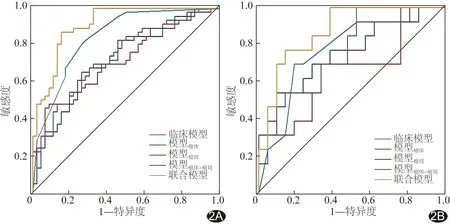
图2 各模型预测训练集和验证集乳腺癌NAC疗效的ROC曲线 A.训练集; B.测试集
2.2 构建影像组学模型 基于瘤体及瘤周VOI,经ICC检验分别保留867及850个影像组学特征,以Mann-WhitneyU检验保留85个特征,经Spearman相关性分析后保留28个特征。最后以LASSO算法筛选出4个瘤体特征和4个瘤周特征(图3)。模型瘤体在训练集及测试集的AUC分别为0.72及0.64,模型瘤周分别为0.72及0.75,模型瘤体+瘤周分别为0.74及0.75。见图2及表3。
2.3 建立联合模型 联合模型在训练集的AUC为0.91,高于临床模型、模型瘤体、模型瘤周及模型瘤体+瘤周(Z=-2.02、-3.82、-3.79、-3.71,P均<0.05);其在测试集的AUC为0.88,高于模型瘤体(Z=-2.16,P<0.05)而与其他模型的AUC差异均无统计学意义(P均>0.05)。见图2及表3。
临床模型、模型瘤体、模型瘤周及联合模型预测结果与实际结果一致性均较高,见图4A;阈值0.01~0.80时联合模型的净收益较大,见图4B。

图4 各模型预测测试集乳腺癌NAC疗效的校准曲线和DCA图 A.校准曲线; B.DCA图
3 讨论
NAC用于乳腺癌疗效的影响因素众多,目前尚缺乏公认的早期无创预测pCR手段。本研究基于淋巴结转移、HER-2表达及PR表达构建的临床模型预测训练集和测试集乳腺癌NAC后pCR的AUC分别为0.85和0.79,与LIU等[10]的结果相近。
CHEN等[11]基于瘤体DCE-MRI和弥散加权成像影像组学预测训练集和验证集乳腺癌NAC后pCR的AUC分别为0.75及0.79。瘤周脂肪百分比高及腺体致密与乳腺癌NAC疗效不佳有关[4-5]。常规MR T1WI仅可定性评估乳腺癌瘤周脂肪含量及腺体致密度[12];而影像组学能获取较T1WI更为全面、客观的信息,定量分析瘤周组织结构对乳腺癌NAC疗效的影响。本研究基于T1WI所示瘤体、瘤周VOI各选出4个最佳影像组学特征,其中tumor_wavelet-LLH_firstorder_Kurtosis为反映肿瘤异质性的生物标志物[13],peri_wavelet-LHL_glcm_Idn及peri_wavelet-HLH_glcm_MCC均属灰度共生矩阵特征,提示肿瘤异质性与T1WI瘤周纹理分布具有高度相关性。本研究基于瘤体最佳特征构建的模型瘤体在测试集的AUC为0.64,稍低于上述文献[11]结果,可能与平扫T1WI缺少肿瘤细胞密度、细胞膜完整性、血流动力学等生物学信息有关;而模型瘤周在训练集(AUC=0.72)和测试集(AUC=0.75)诊断效能均良好,表明所选瘤周影像组学特征与pCR之间显著相关。
乳腺癌具有高度异质性,仅凭单一临床或影像组学模型难以准确预测NAC疗效。本研究结合临床及影像组学特征构建的联合模型在训练集和测试集的AUC分别为0.91及0.88,均高于临床模型,且临床净收益较高,表明基于瘤体及瘤周影像组学结合临床特征的诊断效能更佳。
综上,MR T1WI瘤体和瘤周影像组学结合临床特征可有效预测NAC治疗乳腺癌效果。但本研究为单中心回顾性观察,样本量较小,有待积累更多病例、开展多中心前瞻性研究进一步深入分析。
