双胎妊娠中无创产前检测的胎儿游离DNA浓度特征及检测失败原因分析
2023-10-26钟佳通胡亮温丽娟李双武陈晓杭裴元元刘维强
钟佳通 胡亮 温丽娟 李双武 陈晓杭 裴元元 刘维强*
(深圳市龙岗区妇幼保健院/汕头大学医学院龙岗妇幼临床学院中心实验室,广东深圳,518172)
随着我国全面放开了二胎政策以及辅助生殖技术的不断发展和普及,双胎妊娠率逐年升高。既往研究显示,双胎妊娠容易出现流产、早产、胎盘功能不全、胎儿缺氧和染色体异常等问题[1,2]。双胎妊娠孕妇的产前筛查和咨询极为重要,尽早发现异常可以提供更好的医疗干预和治疗。无创产前筛查(noninvasive prenatal testing,NIPT)是一种通过高通量测序分析孕妇血液中胎儿游离DNA(cellfree fetal DNA,cffDNA)来筛查胎儿染色体非整倍体异常的高精确度产前筛查技术。目前在临床上被广泛应用于单胎妊娠的13、18、21染色体非整倍体的筛查,具有很高的灵敏度和特异度(检出率可达98%),已成为单胎妊娠常规筛查的重要工具[3-4]。随着全基因组大规模并行测序的快速发展和广泛应用,NIPT对双胎妊娠的筛查也已广泛应用于临床。由于双胎妊娠具有不同于单胎妊娠的独特生物学和遗传特征,NIPT对于双胎妊娠的筛查效果仍有待进一步的探讨和总结[5]。本研究以在本院接受行NIPT检测孕妇作为研究对象,分析NIPT双胎妊娠时的检测效率,并与单胎妊娠的筛查情况作比较,探讨NIPT在双胎妊娠染色体非整倍体异常筛查的临床价值,旨在为双胎妊娠的NIPT筛查在临床上的应用和遗传咨询提供更多的参考和理论依据。
1 资料与方法
1.1 研究对象 选取2017年11月至2023年6月在深圳市龙岗区妇幼保健院行遗传咨询,选择接受NIPT产前筛查的1685例双胎孕妇和109784例单胎孕妇。纳入标准:超声检查显示确定为双胎妊娠的孕妇;经过遗传咨询并签署知情同意书。排除标准:夫妇一方已知明确染色体异常;染色体异常分娩史;1年内接受过异体输血、移植手术、干细胞治疗或免疫治疗者等;胎儿超声结果提示有结构异常需行产前诊断;孕期合并恶性肿瘤;医生认为有明确影响结果的其他情形。本研究已经通过中国人类遗传资源采集审批(2023SLCJ1401),并通过医院伦理审批(LGFYYXLLL-2022-024)。
1.2 NIPT检测 采用联合探针锚定聚合测序法试剂盒(华大智造)在BGISEQ-500测序平台进行全基因组大规模平行测序。用EDTA抗凝管抽外周血5 ml,经低速1500G离心10 min后,吸取血浆再高速15000G离心10 min后二次分离血浆,取200 ml血浆应用磁珠吸附法提取游离DNA并纯化,然后进行末端修复、连接分子标签和PCR构建文库将各样本文库定量混合,再将混合后的文库进行单链环化DNA、滚环扩增,加载于芯片上,最后在BGISEQ-500测序仪上进行联合探针锚定聚合测序。所有NIPT样本的建库过程均未采用DNA富集技术。使用BGI Halos分析系统进行数据分析,通过序列对比获得每条染色体的有效DNA序列条数,计算各染色体的Z值,参照标准化来判断染色体是否异常。使用BGI Halos计算cffDNA浓度。cffDNA浓度低于3.5%、GC含量超过42%、有效数据量低于3.5M或异常染色体数量超过3个被认为检测不合格,其中第一次采血检测因GC含量超过42%、有效数据量低于3.5M或异常染色体数量超过3个检测失败的进行重建库,再次检测不合格进行第二次重新采血检测。第二次采血仍检测不合格定义为最终检测失败。
1.3 统计学方法 本实验数据采用R4.3.1软件进行统计分析,符合正态分布计量资料以x-±s表示,选择两独立样本t检验或Mann-Whilney秩和检验进行比较;计数资料比较采用Pearson X检验或Fisher确切概率法。P<0.05为差异有统计学意义。NIPT检测结果灰区定义为目标染色体Z值在[1.96,3)之间。
2 结果
2.1 入组孕妇特征 2017年11月至2023年6月在深圳市龙岗区妇幼保健院选择接受NIPT检测共计1685例双胎妊娠孕妇和109784单胎妊娠孕妇,1685例双胎妊娠孕妇年龄平均值为(30.39±4.73)岁,平均孕周(15.81±2.64)周。109784单胎妊娠孕妇年龄平均值为(29.39±4.59)岁,平均孕周(16.72±3.13)周。双胎妊娠孕妇的平均年龄大于单胎妊娠孕妇,平均孕周小于单胎妊娠孕妇,差异具有统计学意义(P<0.05)。
2.2 NIPT检测情况
2.2.1 检测流程 对纳入本研究的1685例双胎妊娠孕妇和109784单胎妊娠孕妇行NIPT检测,检测流程见图1。
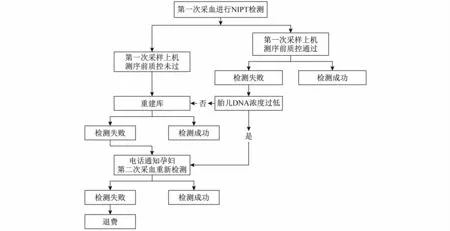
图1 NIPT检测流程图
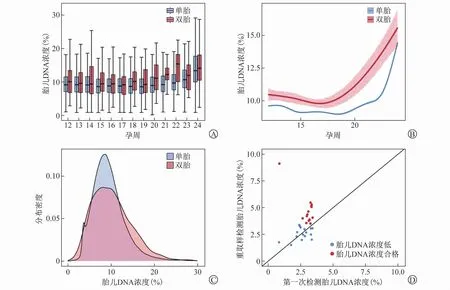
图2 cffDNA分析结果
2.2.2 检测完成情况 1685例双胎妊娠孕妇行NIPT检测第一次采样检测成功1645例(97.63%,1645/1685),检测失败40例(2.37%,40/1685),检测失败的原因主要为cffDNA浓度过低总计有35例(2.07%,35/1685)。第一次采血检测失败的40例双胎妊娠孕妇通知第二次重采血行NIPT检测仍然检测失败16例(0.95%,16/1685),其中因cffDNA浓度低失败14例(0.83%,14/1685)。最终1685例双胎妊娠孕妇中16例未能检测成功,最终失败率0.95%(16/1685)。109784例单胎妊娠孕妇行NIPT检测第一次采样检测成功108519例(98.85%,108519/109784),检测失败1265例(1.15%,1265/109784),检测失败的原因主要为染色体Z值处于灰区和胎儿cffDNA浓度低,1265例单胎妊娠孕妇通知第二次重采血行NIPT检测仍然检测失败449例,其中因cffDNA浓度低失败262例(0.24%,262/109784)。最终109784例单胎妊娠孕妇中449例未能检测成功,最终失败率0.41%(449/109784),单胎妊娠的最终失败率低于双胎妊娠,差异具有有统计学意义(P<0.05),见表1,表2。
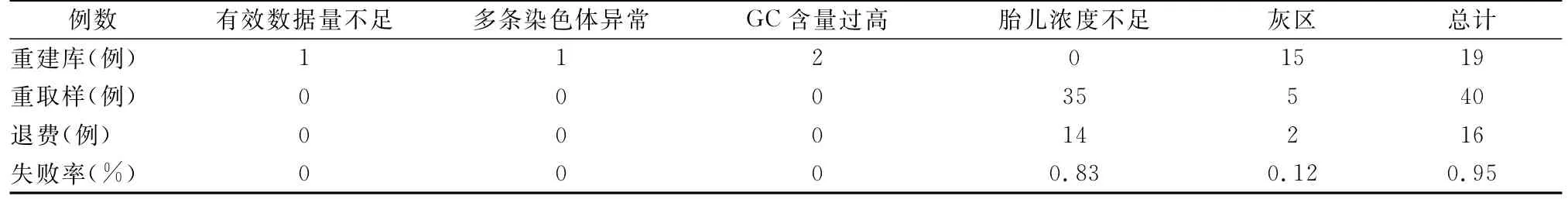
表1 1685例双胎妊娠孕妇NIPT检测失败情况

表2 109784例单胎妊娠孕妇NIPT检测失败情况
2.3 双胎妊娠中的cffDNA浓度 双胎妊娠及单胎妊娠孕妇的外周血cffDNA浓度整体趋势均随着孕周的增长而升高。在相同孕周下双胎妊娠孕妇的cffDNA浓度个体差异性较单胎妊娠更大,且整体cffDNA浓度比单胎妊娠的更高(P<0.05),见图1A、图1B。
本研究1685例双胎孕妇外周血cffDNA浓度在0.84%~41.22%,平均cffDNA浓度为(10.30±4.75)%。109784单胎妊娠孕妇外周血cffDNA浓度均在0.94%~49.83%,平均cffDNA浓度为(9.52±3.92)%。单胎妊娠的孕妇外周血cffDNA浓度分布集中于平均值附近范围,双胎妊娠的孕妇cffDNA浓度分布较单胎妊娠的孕妇更加分散,见图1C。
35例双胎妊娠孕妇第一次因cffDNA浓度较低(<3.5%)导致检测失败,电话通知重取样再次行NIPT检测,仍有14例因cffDNA浓度较低导致检测失败,且这35例双胎妊娠孕妇两次采样的整体cffDNA浓度变化不大,见图1D。
2.4 双胎妊娠孕妇NIPT检测结果 1669例NIPT检测成功的双胎妊娠孕妇中,共计1658例检测结果提示低风险,随访至出生后三个月,未出现假阴性。11例检测结果提示高风险,筛查阳性率为0.66%(11/1669),其中1例提示为13三体高风险,6例提示为18三体高风险,4例提示为21三体高风险。对NIPT提示高风险的双胎妊娠孕妇进行遗传咨询和产前诊断,染色体核型结果显示,确证1例13三体高风险、3例18三体高风险、3例21三体高风险,阳性预测值分别为100%、50%和75%。复合阳性预测值为63.63%(7/11)未发现漏检的假阴性孕妇,阴性预测值为100%。
3 讨论
本研究基于大样本量NIPT结果,对1685例双胎妊娠及109784例单胎妊娠中的胎儿游离DNA浓度和检测失败原因进行了分析,并进一步探讨了双胎妊娠对三大目标染色体的筛查效果。在本研究基于的研究对象为全妊娠人群,即不具有NIPT技术不适用情形的孕妇均被纳入筛查范围。在此基础上获得的人群数据具有更广泛的代表性。
cff DNA浓度是NIPT的重要质控参数[6],通常通过男胎Y染色体比例或利用深度学习算法对母胎游离DNA来源分布差异进行建模并预测,如SeqFF等[7]。cffDNA浓度对于NIPT的准确性有至关重要的意义。国内外大量研究表明cffDNA浓度高于3.5%~4%时,NIPT分析结果才具有意义[8,9]。本研究使用的BGI seq500平台采用3.5%作为cff DNA浓度的质控阈值。影响cffDNA浓度的因素较复杂,包括孕周、母体因素、胎儿因素、胎盘因素等[10]。本研究中的双胎妊娠cffDNA浓度呈现三个特点:①cffDNA浓度总体较单胎妊娠高;②分布较宽;③个体差异较单胎妊娠更大。单双胎妊娠的cff DNA浓度在20周左右开始均随孕周增加而明显上升,其中双胎妊娠上升的更早。由于胎儿游离DNA主要来自胎盘滋养层细胞[11],胎盘的发育情况和胎盘面积往往与cffDNA浓度相关,因此双胎妊娠可具有较高的cffDNA浓度。但双胎妊娠中胎盘面积受绒毛膜性的影响,并可能存在胎盘融合、发育不均等现象,因此双胎妊娠的cff DNA浓度分布较宽[12]。Yang Zhou等报道发现孕妇外周血cffDNA浓度会随孕周增加而升高,但增长速度不一致,从孕10周到孕21周,cffDNA浓度每周升高0.1%,孕21周之后每周升高1%[13]。本研究进一步发现,双胎妊娠cffDNA浓度在18周左右即开始明显增高,而单胎妊娠则约在22周开始上升,较双胎妊娠更晚。
NIPT在双胎妊娠中的检测失败总体较单胎妊娠高,标本cffDNA浓度不足是检测失败的主要原因。由于cffDNA浓度在双胎妊娠中具有较大分布宽度,因此双胎妊娠更易发生cffDNA浓度过低。本研究发现相较于单胎妊娠,双胎妊娠因cffDNA低而导致检测失败的比例要明显更高。这也是双胎妊娠在临床应用中作为慎用指征的原因之一。Yaron等的研究显示,NIPT的检测失败率大约为0.12%~8.09%[14]。Palomaki GE等的一项研究结果显示当孕妇外周血的cffDNA浓度<4%时,将会极大的影响NIPT的检测,较低的cffDNA浓度会加剧cffDNA受到母体DNA的影响,使得在NIPT测序过程中无法准确识别到cffDNA,导致检测失败[15]。本研究中40例双胎妊娠孕妇在知情同意的情况下进行第二次采血重新行NIPT检测,仍有14例因cffDNA浓度较低而检测失败,成功率与Kinnings SL等研究接近[16]。同时值得注意的是,双胎妊娠较单胎妊娠少发生检测灰区,这一原因尚不完全明确,可能与检测平台所用得到生物信息学算法针对双胎进行了优化所致。除此之外,有效数据量不足和GC含量过高也是导致检测失败的原因,主要可能与实验操作有关,通过复查可避免。多染色体异常导致检测失败原因尚不明确,可能于孕妇本人存在体细胞嵌合等因素有关[17]。
本研究通过随访双胎妊娠产前诊断结果发现,双胎妊娠同样具有的较高的阳性预测与阴性预测值,有良好的临床应用价值。但由于阳性样本量较少,暂无法与单胎妊娠比较。由于双胎妊娠的胎儿游离DNA浓度具有上述特点,且检测失败率较高,临床应用时是需向受检者明确这些局限性和可能存在的假阳性、假阴性风险。本研究还存在一些局限性,例如未探讨双胎妊娠中不同绒毛膜性对胎儿游离DNA及检测失败率的影响,未对假阳性的发生原因进行验证,可在后续研究中进一步完善。
综上,NIPT在双胎妊娠中具有较好的临床应用价值,但更易存在因胎儿游离DNA浓度不足导致检测失败的情形,在临床应用中需向受检者完善知情同意,阐明NIPT在双胎妊娠检测中的局限性。
