胎儿游离DNA浓度的影响因素及相关产前筛查/诊断策略探讨
2023-10-26邢铃苓刘洪
邢铃苓 刘洪
(1.四川大学华西第二医院医学遗传科/产前诊断中心;2.四川大学华西第二医院妇产科出生缺陷与相关妇儿疾病教育部重点实验室,四川成都,610041)
1 概述
正常人血液及体液循环中存在来源于细胞核DNA和线粒体DNA的少量游离DNA(cell free DNA,cfDNA)。1997年,Lo等人[1]在母体血浆中发现了游离的胎儿DNA片段(cell free fetal DNA,cffDNA)。cffDNA主要来自胎盘和胎儿细胞,片段较小,长度在75bp~205bp左右。胎盘滋养层细胞分泌cffDNA进入母体血浆,在孕4周左右即可检出,孕8周建立胎盘循环后cffDNA则以一定比例稳定存在于母体外周血血浆中(图1)。妊娠使母体循环中cfDNA的总量增加了约3%~13%。胎儿游离DNA浓度(fetal fraction,FF)是cffDNA占母体cfDNA总量的百分比[FF=cffDNA/(cffDNA+母源cfDNA)×100%]。既往研究表明,受孕妇和胎儿特征的影响,FF在孕10至15周之间约为10%~20%[2-3]。无创产前筛查(non-invasive prenatal screening,NIPS)就是采用大规模平行测序等技术检测孕妇外周血血浆游离DNA,对测序结果进行生物信息学分析,来量化胎儿染色体非整倍体异常的风险。该检测技术于2011年进入临床应用,因筛查效能高于传统血清学筛查,逐步成为美国妇产科医师学会(ACOG)推荐的染色体非整倍体一线筛查方法。在我国,NIPS也在临床广泛应用。其中,FF是影响NIPS检测准确性的重要因素,FF过低也是NIPS检测失败的主要原因。
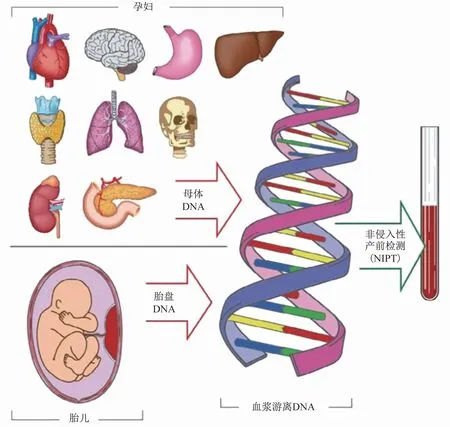
图1 孕妇血浆cfDNA的来源[5]
研究表明,因低FF导致NIPS检测失败的孕妇群体,其胎儿发生染色体异常的风险较普通孕妇群体偏高[4]。本文主要对影响FF的胎儿因素、母体因素、实验室因素进行探讨,并结合孕妇相关临床特征、妊娠结局对进一步产前检查的选择进行探讨,以期为临床遗传咨询提供参考。
2 NIPS中FF的检测方法
FF是NIPS测序结果的主要生物信息学分析质控因素,现有的FF检测方法如表1[6]。
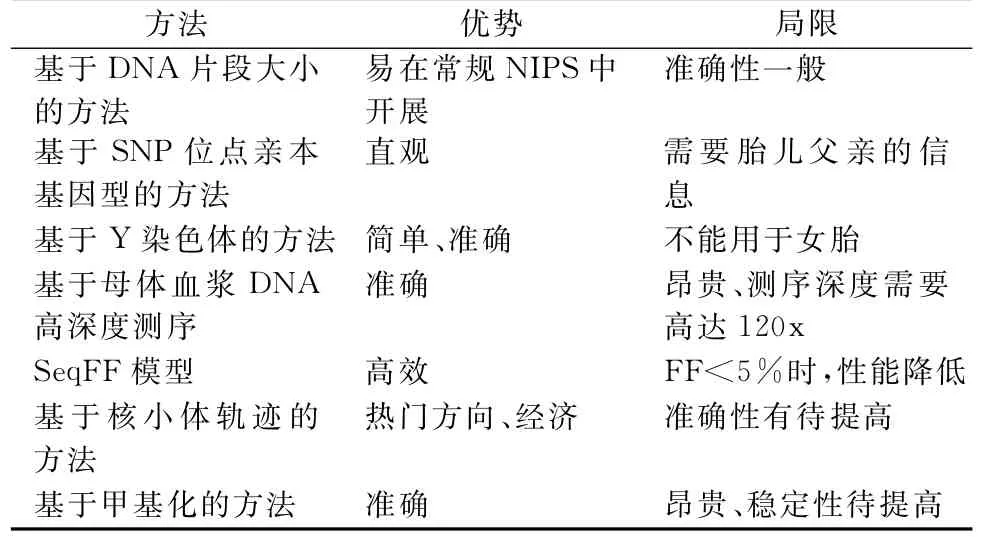
表1 现有不同FF检测方法的优势及局限
2.1 基于DNA片段大小的方法 cfDNA的大小分布在不同群体中具有共同的特征,呈“阶梯”状分布,在166bp处有一个优势峰。然而,cfDNA由于特定的起源组织而表现出轻微的差异特征。胎儿和母体cfDNA片段的优势峰分别为143 bp和166 bp[7],即胎儿cfDNA通常比母体cfDNA短。因此,较高的FF在理论上应该与短cfDNA分子的百分比增加有关。该方法的关键是找到分属于胎儿和母体本身的片段长度区间,然后计算出胎儿序列片段的占比。2014年,Lo等通过计算孕妇血样中长度在100~150bp之间的DNA片段与长度在163~169bp之间的DNA片段的相对比例来估算胎儿浓度,并与基于Y染色体的方法对比,结果发现两种估算胎儿浓度的结果高度一致[8]。
2.2 基于SNP位点亲本基因型的方法 这是一种通过检测双亲单核苷酸多态性(SNP)位点来确定FF的方法。由于胎儿的遗传物质一半来自父亲,另一半来自母亲,对于父亲和母亲均为纯合但基因型不同的SNP位点,胎儿的基因型为杂合。因此,基于此种SNP位点,通过识别母体血浆中胎儿特异性等位基因,计算其与血浆中总等位基因的比率是量化FF的直接而准确的方法。但这种方法的可行性受样本限制,因为临床上常规NIPS只收集孕妇的外周血样本,父亲血样的获取比较困难。
2.3 基于Y染色体的方法 孕妇血浆中的Y染色体DNA片段通常来自男性胎儿。在以往基于Y染色体测定FF的研究中,使用最多的方法是定量荧光扩增(quantitative fluorescence amplification,qPCR),该方法主要通过对孕妇血浆中Y染色体上的基因(如SRY、DYS14、ZFY等基因)定量来代表胎儿来源DNA量,对X染色体上的基因如ZFX定量来代表游离DNA总量。另外,临床上利用二代测序数据来分析Y染色体的含量的方法,降低了成本、提高了效率[9]。虽然基于Y染色体的方法简单准确,但只能针对男胎,不适用于女胎。
2.4 基于母体cfDNA高深度测序 为了消除对亲本基因型信息的依赖,科学家们开发了一种被称为FetalQuant的方法,通过使用高深度靶向大规模平行测序来测量FF,该方法的预测结果与基于亲本基因型的方法推导的结果非常接近,但局限性为测序深度需要高达120x才能可靠地确定胎儿等位基因[10]。
2.5 SeqFF模型 Sung K.Kim团队开发的SeqFF模型,尝试从NIPS常规深度的测序数据中直接计算胎儿DNA分数。这是一种更加准确和高效的方法,但是这种高维模型在构建过程中需要大规模的样本数据,且当FF低于5%时,性能大大降低,可能是因为FF<5%的病例数相对较少,不足以构建Enet模型[11]。
2.6 基于核小体轨迹的方法 血浆DNA核小体测定FF是一个比较热门的方向。Straver等收集孕妇血样,基于游离DNA的单端测序数据生成全基因组核小体图谱,以产生假设的“核小体轨迹”。研究发现核小体中心上下游73 bp区域内的reads数与FF呈正相关。然而,相关系数仅为0.636,较其他方法低。因此,基于“核小体轨迹”的方法有待进一步开发[12]。
2.7 基于甲基化的方法 母胎存在甲基化差异性位点,Nygren团队开发了一种FF检测方法-FQA,通过比较胎盘组织和母体血沉棕黄层的5个差异甲基化区域,测量甲基化敏感限制性内切酶酶切后的总DNA(母体和胎儿)和胎儿甲基化DNA的拷贝数来估算FF。其检测结果与基于Y染色体的定量方法具有较好的一致性。但因实验涉及甲基化敏感限制酶的消化,其稳定性还需要更多的实验验证[13]。
大规模平行亚硫酸盐测序作为另一种基于甲基化的方法,是根据cffDNA在差异甲基化区域的比例来估算FF[14]。有研究利用全基因组亚硫酸氢盐测序获取cfDNA的甲基化谱,分析了多个甲基化标记区域关联组织的甲基化谱来推断血浆中不同组织的占比[15]。这种方法与基于亲本基因型的方法对比,准确性得到了验证,但检测成本较高。
3 低FF发生率
国际产前诊断学会(ISPD)发表的声明提示,在一些大型实验室报告中NIPS检测失败率约为1.9%~6.4%[16]。不同测序平台,包括Verinata,LifeCodexx,Sequenom,BGI,Ariosa,Natera等,报告的检测失败率范围从1.6%到6.4%不等[17]。多中心研究表明,FF低于4%是NIPS检测失败的主要原因(41.88%~100%,71.32%),其他原因包括测序失败以及母体外周血血浆总DNA浓度高于质控标准等。笔者汇总了国内外部分NIPS检测实验室提供的检测失败率及FF<4%占比情况,检测失败率低于前期文献报道,见表2。
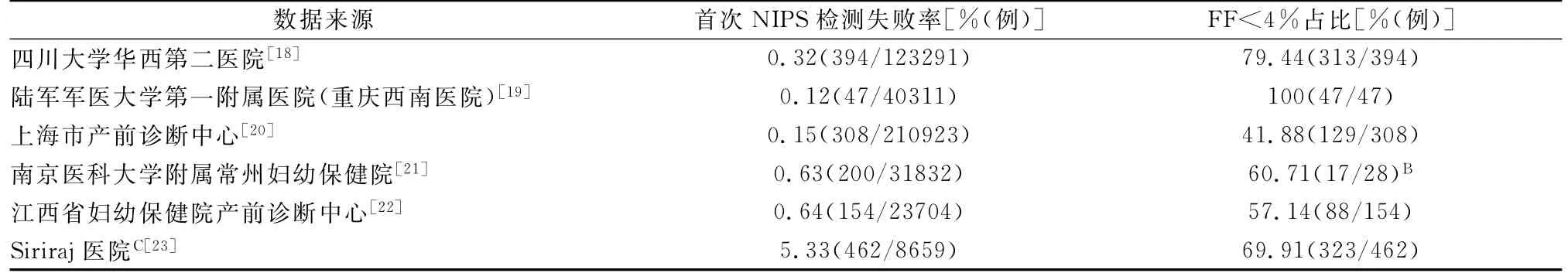
表2 国内外医院NIPS样本的检测失败率及FF<4%占比A
4 FF的影响因素
FF存在较大的个体间差异,任何增加母体贡献和/或减少胎儿、胎盘贡献的疾病都可能降低FF。除母体、胎儿、胎盘以外,实验室技术和FF的计算方法也可能影响FF。近期一篇文章总结了FF的影响因素,见表3[5]。
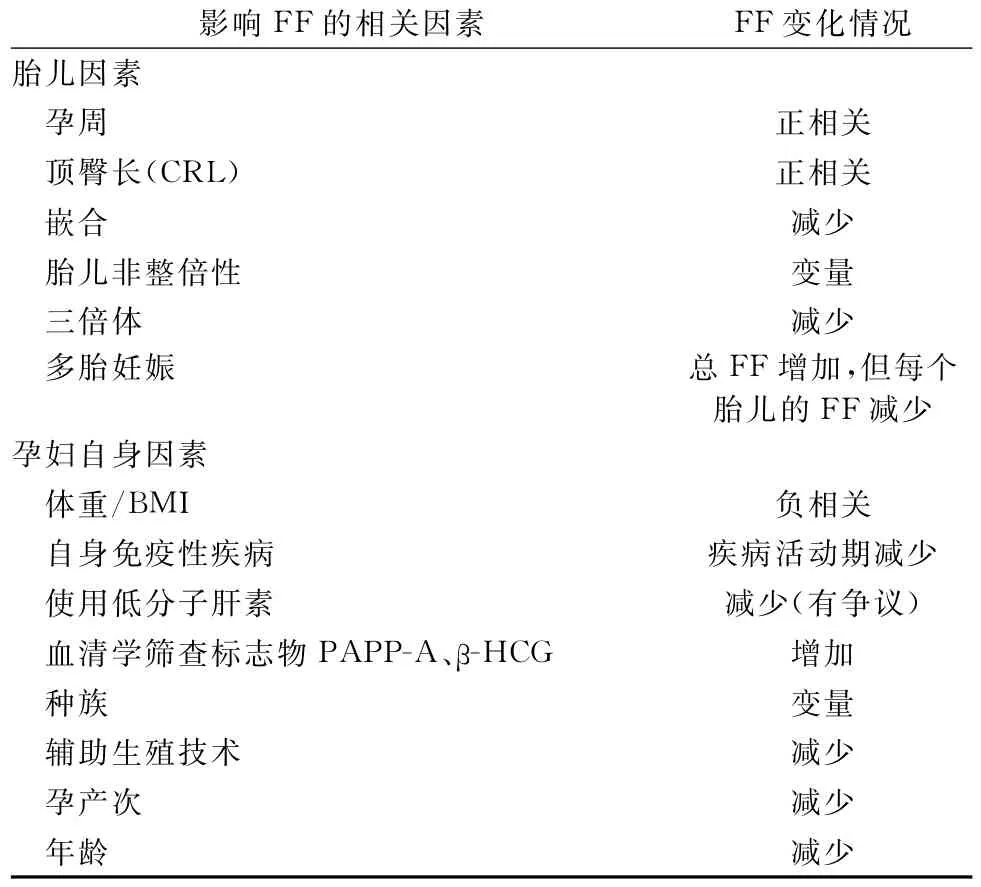
表3 影响FF的相关因素引起FF变化的情况
4.1 cffDNA过低(胎儿因素)4.1.1 胎龄 现有研究表明,FF通常与孕周(胎龄)呈正相关,不同妊娠阶段的胎儿DNA分数增加速率不同,可能是由于随着胎龄的增加,胎盘体积逐渐增加,凋亡滋养层细胞也逐渐增加导致更多的cff DNA片段被释放到母体血浆中,导致FF增加[24-26]。
4.1.2 胎儿染色体异常 既往研究表明,低FF导致NIPS失败的孕妇中,胎儿三倍体较常见,且胎儿非整倍体的风险增高。NIPS检测失败后报告的非整倍体包括:T13、T18、T21、T16嵌合和X单体[5]。同时,怀有非整倍体胎儿的孕妇血浆中FF随非整倍体类型不同而有差异[3,26-28]。研究发现,T21、T18和T13胎儿的孕妇Z值与FF之间存在很强的正相关关系,而在T18低风险样本中观察到负相关[29]。与T21相比,T13和T18的中位FF值较低,总体检出率也较低[30-32]。这些发现或许可以通过T18和T13的胎儿生长受限或胎盘尺寸较小导致FF小于整倍体胎儿来解释,进而可以部分解释为何NIPS对T21的检测效能优于T18和T13。4.1.3 其他 胎儿顶臀长、嵌合等也被一些学者认为可影响FF。FF随CRL增加而增加,胎盘嵌合FF减少[3,33]。
4.2 母源cfDNA过高(母体因素) FF降低的另一种可能是由于稀释效应或由于母体cfDNA的增加而导致cffDNA含量的相对降低。任何可引起cf DNA增高的母体因素均可引起母体外周血cffDNA浓度降低,即FF降低[3,32]。
4.2.1 孕妇BMI值 母体BMI值过高是FF过低致NIPS检测失败的相关因素之一。随着孕妇BMI升高,循环血容量增加导致血浆中游离DNA总量增加,稀释了胎儿来源的cfDNA,导致FF降低。另外,肥胖孕妇血浆中的母体cfDNA不仅来源于凋亡造血细胞,还来自脂肪和基质血管组织的凋亡和坏死细胞[28]。
4.2.2 孕妇自身疾病及妊娠相关并发症 本中心NIPS随访数据提示,总cfDNA浓度过高的孕妇中,约70%合并了自身免疫性疾病(systemic autoimmune diseases,SAD)如抗凝脂综合征(antiphospholipid syndrome,APS)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、干燥综合征(sjogren syndrome,SS)以及妊娠高血压(pregnancy induced hypertension,PIH)等妊娠相关并发症。与总cfDNA浓度正常的相比,有统计学差异。
根据孕妇BMI与FF的负相关性推测,临床上常伴有肥胖的疾病如多囊卵巢综合征(polycystic ovary syndrome,PCOS)、激素治疗的SAD和糖尿病也可能会导致FF降低,使NIPS失败的发生率增加,但目前的研究结果尚未证实这一观点[34]。
对于有母体疾病或并发症的患者,母体血浆cfDNA的浓度普遍增加[35]。母体合并肿瘤,cf DNA含量增加可能与肿瘤细胞坏死和凋亡有关,循环肿瘤DNA(ctDNA)可通过降低血浆中cffDNA的占比而增加NIPS假阴性的可能性。
SAD是一种多因素疾病,其特征是出现自身反应性免疫细胞和特异性自身抗体。多种疾病机制包括细胞凋亡、坏死、炎症反应或活性细胞的释放,都被认为是这些SAD患者cfDNA的来源。此外,cfDNA产生和清除之间的不平衡已被假定为另一种机制[36]。值得注意的是,一项研究显示APS患者与健康受试者孕妇的cffDNA定量分析结果无显著性差异[37]。这表明,孕妇增加的cfDNA部分可能主要来自母体细胞,而不是胎儿细胞。同样,现有文献表明SLE及SS患者的cfDNA浓度较正常人群明显升高。此外,与处于非活动期的患者相比,处于疾病活动期的SLE患者的cfDNA水平更高[38-39]。
同时,越来越多的证据表明,胎盘来源的cff DNA升高与PIH相关,PIH作为产科常见疾病,是妊娠特有的一种综合征。关于PIH与cf DNA的关系,前期研究提示妊娠中转运的母、胎cfDNA浓度与PIH异常增高,且DNA释放量与疾病严重程度相关。亦有学者指出[40],在PIH预测中,总cfDNA似乎比cffDNA增加更明显,cffDNA水平升高与妊娠并发症之间没有关系,但总cfDNA作为PIH的生化标志物发挥作用,则需要具有同质人群和标准化方法的大型前瞻性研究来进一步确认其预测价值[40-44]。究其机制,PIH患者的主要病理学因素可能是由于滋养层不能有效地侵入蜕膜和缺乏动脉导管壁的侵入导致胎盘的缺陷,胎盘滋养层和合体滋养层细胞凋亡率增加,引起更多的cffDNA释放入血,cffDNA在PIH出现症状之前水平的增加可能是由于缺氧和氧化应激导致胎盘细胞凋亡和坏死增加,另外cff DNA可以通过激活先天免疫DNA传感器来损害滋养层迁移,从而对胎盘功能产生局部影响;有研究发现PIH的孕妇有核细胞通透性增高,在PIH发生前的几个星期,母循环中有核红细胞的数量异常增加,cfDNA升高可能还与其清除率下降有关,因为在PIH患者中已经发现包括肝脏、肾脏在内的病理学改变,因此可能器官损害导致cfDNA清除异常,最终导致cfDNA水平升高;与正常妊娠源性cff DNA相比,PIH的cffDNA增加了炎症细胞因子水平,循环cfDNA和cffDNA升高可诱发胎盘炎症反应,导致PIH病理特征加速[45-50]。
4.2.3 孕期用药 既往研究发现,低FF导致的NIPS失败可能发生在多达18%的接受低分子量肝素(low molecular weight heparin,LMWH)治疗的孕妇中,即使在控制了母亲体重和过度紧张之后,与未经治疗的女性相比也有显著差异[51-52]。可能的机制包括,肝素对DNA聚合酶具有很强的亲和力,并影响PCR检测中Mg2+的浓度;孕妇血浆DNA中含有较高比例的小片段DNA,其GC含量很高。将采集血液样本的时间调整到下一次用药前,可能会提高这些孕妇复查NIPS的成功率[53]。同时,也有一些学者指出,这些研究缺乏适当的方法,证据不足。母体因素可能是cfDNA浓度升高的主要原因,低FF和LMWH之间的关系是由于潜在的疾病而不是治疗本身[54]。然而,美国妇产科学杂志近期发表的一篇文章认为,使用抗凝药(非阿司匹林)与cfDNA片段大小或GC含量的差异无关,且染色体水平Z值的差异不会对临床非整倍体检测产生影响。这表明抗凝治疗对FF可能有稀释作用,从而导致基于cfDNA的NIPS检测失败,而不是实验室或测序水平的变化[55]。LMWH和低FF导致NIPS失败之间相互作用的确切机制仍有待阐明。4.3 实验室因素 FF的测量并不精确,目前的方法无法对FF进行可靠、一致地估算,实验室之间的FF阈值也存在很大差异,低于阈值就无法获得检测结果[56]。阈值取决于每个实验室使用的技术平台和生物信息学算法,以及单个样本特征。实验室应对其检测范围和低FF结果阈值进行内部验证[61]。
生物信息学分析方法可能对FF的测定产生较大的影响。以基于DNA片段大小的方法为例,由于胎儿来源的DNA通常较短,而母源DNA中较短的片段可能会被误解为胎儿来源。未来的研究应以建立最佳的生物信息学工具为方向。
5 NIPS检测失败的孕妇妊娠结局追踪
笔者摘取了四川大学华西第二医院378例NIPS检测失败病例随访资料[18],发现产前、产后共检出15例染色体异常,约10%的孕妇出现异常妊娠结局;在染色体异常病例中,拷贝数变异占66.67%(10/15),见表4。另有不同研究中心NIPS测试失败后行羊水细胞核型分析的染色体异常,见表5。上述结果提示,由于核型分析分辨率的局限,NIPS检测失败的病例中,胎儿染色体异常比例可能高于既往研究报道。

表4 四川大学华西第二医院NIPS检测失败病例妊娠结局[18]
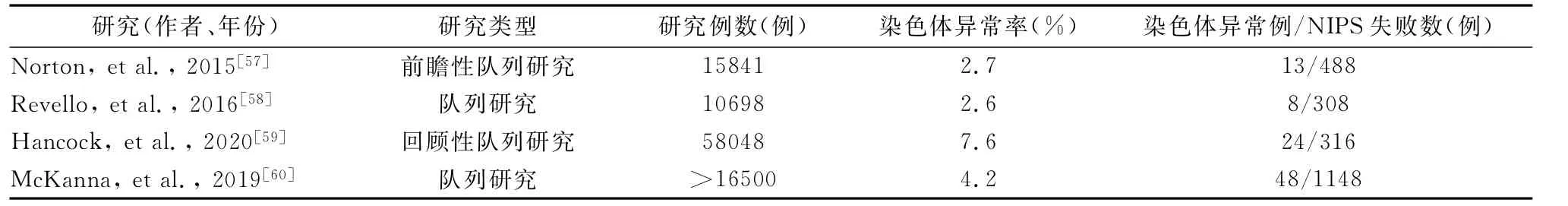
表5 不同研究中NIPS测试失败情况下的染色体异常率
6 进一步产前检测方法选择的思考
ISPD在2023年声明指出,胎儿游离DNA浓度是一项重要的质控指标,但实验室之间和检测方法之间存在很大差异,实验室应对其检测限和检测失败结果的阈值进行内部验证。医疗服务提供者(实验室和临床医生)应建立临床路径,以管理NIPS检测失败的患者。这可能包括详细的超声检查、提供重复NIPS、替代筛查试验和/或产前诊断[61]。
根据首次NIPS检测失败的原因规范临床路径管理对于为孕妇提供准确的信息和减少焦虑非常重要[62]。以FF<4%导致NIPS检测失败为例,临床医生在提供建议前,要考虑到以下因素[5]:
(1)孕妇的身体质量指数(BMI)是多少?
(2)是否有可能的相关母体疾病(如抗凝脂综合征、系统性红斑狼疮等自身免疫性疾病;妊娠高血压等并发症)?
(3)是否使用低分子量肝素或其他抗凝药物?
(4)是否通过辅助生殖技术怀孕,是否已通过超声检查确定妊娠情况?
(5)是否为多胎妊娠?绒毛膜性如何?
(6)超声是否提示染色体异常相关表型?
进一步可选的非整倍体风险评估方式包括:
6.1 NIPS重采血复检 研究提示,在NIPS首次检测失败的孕妇进行重采血复检,超过60%的孕妇获得了有效的NIPS结果。且FF<4%或Z值临界致NIPS失败的孕妇,其复检成功率远高于因基因组图谱改变(z值异常)致NIPS失败的病例[21-23,62]。若孕妇的产前超声等检查正常,且未合并影响FF的情况,同时孕妇明确表达希望避免介入性产前诊断,则可以为她提供染色体非整倍体的替代筛查如妊娠中期血清学联合筛查,或重复抽血进行NIPS。需要特别考虑到孕周,通过重采血复检获得有效NIPS结果的成功率随着胎龄的增加而增加,但可能会导致胎儿非整倍体产前诊断时机延迟。因此,重采样时间应严格把控,保证孕妇在NIPS重采血复检失败时,能有时机进行血清学联合筛查或介入性产前诊断;复检结果提示高风险时,能够进行介入性产前诊断。若孕妇正在使用低分子肝素,则建议其在下一次用药前采样。
6.2 介入性产前诊断 美国妇产科医师学会(ACOG)和母胎医学协会(SMFM)提出,低FF导致NIPS检测失败的人群发生非整倍体的风险增加,这些患者应进一步接受遗传咨询,并提供全面的超声评估和诊断性检测。他们指出,那些在适当的孕周采血的孕妇,虽然可以再次检测,但可能导致胎儿非整倍体异常的诊断延迟,可能会限制生育选择,而且只有50%~60%的重复筛查可成功得到检测结果[60-64]。且有研究表明NIPS失败的胎儿染色体异常类型主要为拷贝数变异(66.67%),这使得NIPS检测失败病例染色体异常发生率较以往研究增加[18]。此外,虽然羊膜腔穿刺术和绒毛取样(CVS)的妊娠期胎儿丢失率分别约为1/1000和1/500[65-66],但有创手术后进行的产前诊断检查成功率高,使孕妇能够根据随后的有创产前诊断结果更好地决定妊娠管理。文献表明,检测产前样本(羊水、脐血或绒毛组织)的总体成功率可高达98%~99%,几乎不受样本类型的影响[67-68]。因此,权衡利弊,对于胎龄相对较大的孕妇在NIPS失败后进行介入性产前诊断确定胎儿是否有染色体异常比不进行的孕妇综合风险更小,更有利于临床医生及孕妇决定随后的妊娠管理。
6.3 其他 对于重采血复检仍提示FF<4%,且孕妇自身合并了影响FF因素的孕妇,可在充分告知不同检测技术的优势、局限性及风险前提下,遵循孕妇意愿选择其他替代筛查或介入性产前诊断。另外,研究提示低FF导致NIPS失败的孕妇发生早产的风险增加[69],但低FF在预测不良妊娠结局方面的价值需要进一步确定[70]。遗传咨询时临床医生可提醒孕妇警惕早产的可能性。
