0PN来源胚胎形成的影响因素及其利用价值分析
2023-10-24李澎涛殷晨星孟娜娜王娜曹娟张佳妮王玉真
李澎涛,殷晨星,孟娜娜,王娜,曹娟,张佳妮,王玉真
(保定市妇幼保健院生殖医学科,保定 071000)
体外受精-胚胎移植(IVF-ET)过程中,一般在受精后16~18 h观察卵母细胞原核情况来判断其是否受精,具有两个原核(2PN)的为正常受精卵。大多数未出现原核的卵母细胞为未受精卵,但有时也会存在一些无原核(0PN)的受精卵,其发生率为11.3%~20%[1],这些受精卵能够继续发育成卵裂胚甚至囊胚,我们称这些胚胎为0PN来源胚胎。有一些研究认为0PN受精卵可能为孤雌激活或胚胎染色体异常导致原核不能形成,不建议移植0PN来源胚胎[2-4]。但Manor等[5]认为0PN来源胚胎形成的主要原因是由于观察受精时间是固定的,而原核出现的时间不确定,导致当那些提早发育的胚胎原核出现时,未能及时观察到而错过。正常受精卵原核一般在受精后23~25 h消失,而对于少部分发育比较快的受精卵,其原核消失的时间要早于大多数正常受精卵[6-7],而这部分受精卵在定时观察原核时就可能被判定为0PN。近年来,一些研究表明将0PN来源胚胎移植后也可以妊娠并成功分娩健康婴儿[8-12]。0PN来源胚胎的利用不仅避免了胚胎的浪费,而且给了患者更多的妊娠机会,尤其对于那些卵巢储备功能减退的高龄患者尤为重要。Time-lapse时差培养箱在临床的应用,极大扩展了原核的观察时间范围,避免了错失原核的最佳观察时间,但由于设备昂贵,限制了其应用范围。因此对于那些未使用Time-lapse时差培养箱的生殖中心来说,如何安全有效地利用这些0PN来源胚胎具有重要意义。本研究通过对IVF-ET过程中的临床及实验室数据进行回顾性分析,探讨影响0PN受精卵形成的影响因素、0PN来源胚胎发育潜能及其利用价值。
资料与方法
一、研究对象
回顾性分析2019年1月至2021年12月在保定市妇幼保健院生殖医学科接受IVF-ET及冻融胚胎移植(FET)治疗的患者的临床、实验室数据及妊娠结局。
纳入标准:(1)受精方式为常规IVF;(2)FET周期均为囊胚移植;(3)双方均无遗传性疾病。
排除标准:(1)FET周期排除子宫内膜异位症患者;(2)FET周期排除内膜转化日内膜厚度<8 mm者。
本研究共纳入符合标准的1 597个常规IVF周期及596个FET周期。
二、诊疗回顾
1.控制性促排卵、受精及胚胎培养:依据患者年龄、卵巢储备情况、体质量指数(BMI)等自身情况制定适合患者的促排卵方案,于HCG注射36 h后经阴道超声引导下取卵。男方患者于女方获卵后手淫取精,精液液化后均采用密度梯度离心法对精液优化处理,所用梯度液为瑞典Vitrolife公司的SpermGradTM,洗精液、受精液、卵裂培养液及囊胚培养液均为瑞典Vitrolife公司的G-seriesTM培养液。于HCG注射39~40 h后在双井皿中授精,授精浓度10~30万条/ml,5 h左右去除颗粒细胞,观察极体情况,有两个极体(2PB)的卵母细胞判断为受精卵,对于受精卵比例小于30%的患者进行早补救授精。授精后17~19 h进行原核评价,依据原核数量分为2PN受精卵(正常受精)、0PN受精卵[未观察到原核,有两个极体,授精后第2天(D2)发生卵裂的受精卵]、1PN受精卵(仅观察到1个原核的受精卵)等。继续培养至授精后第3天(D3),依据ASEBIR卵裂期胚胎评价标准[13]对胚胎进行评价,将D3卵裂期胚胎分为Ⅰ~Ⅳ级。将Ⅰ、Ⅱ级正常受精卵裂胚选择性移植或冷冻后剩余卵裂期胚胎继续囊胚培养至D5/D6,依据Gardner囊胚分级法[14]对形成的囊胚进行评价,选择3期及以上且滋养层或内细胞团评级不同时为C的囊胚冷冻保存。本中心将所有0PN来源胚胎培养至囊胚阶段冻存,在没有足够2PN来源的胚胎情况下用于FET。
2.FET周期:囊胚的冷冻和解冻均使用日本Kitazato公司的冷冻及解冻套装。囊胚冷冻前均进行激光打孔皱缩。按照试剂说明书对胚胎进行冷冻及复苏,复苏后将3/4期囊胚进行激光辅助孵化。胚胎复苏后,在37℃、6%CO2培养箱内继续培养2 h后观察并记录解冻胚胎细胞的存活细胞数、坏死细胞数及继续培养后的生长情况。复苏后3~4 h,用移植管连接1 ml气密注射器,一段式装管后,B超引导下将胚胎移植入子宫腔中后部。胚胎移植后35 d腹部B超下观察到宫腔内孕囊及心管搏动为临床妊娠。妊娠后随访,记录流产、胎停、出生情况等数据。
三、研究分组
常规IVF-ET周期分为3组:A1组(无0PN受精,731个周期)、A2组(0<0PN受精率≤20%,495个周期)和A3组(0PN受精率>20%,371个周期)。
依据行囊胚培养的D3剩余胚受精来源不同分为2组:B1组(0PN来源胚胎,2 409枚)和B2组(2PN来源胚胎,6 602枚)。
依据FET周期移植囊胚来源分为2组:C1组(0PN来源冻融囊胚,85周期)和C2组(2PN来源冻融囊胚,511周期)。
四、观察指标及判定标准
患者基线资料,包括年龄、不孕年限、BMI、抗苗勒管激素(AMH)水平、基础激素水平、促排卵方案及受精相关指标;剩余D3胚的囊胚培养结局,包括囊胚形成率、可冷冻囊胚形成率;FET周期结局,包括移植囊胚数量/质量、妊娠结局及新生儿结局。
0PN来源胚胎形成率=(D1未观察到原核,有两个极体,D2发生卵裂的受精卵数)/获卵数×100%;囊胚形成率=(D5/D6形成的2期以上囊胚数)/继续培养胚胎数×100%;可利用囊胚形成率=(D5/D6形成的可冷冻囊胚数)/继续培养胚胎数×100%;临床妊娠率=(超声下能检测到孕囊的妊娠周期数)/移植周期数×100%;种植率=(超声下检测到的孕囊数)/移植胚胎数×100%;流产率=(孕周<28周的流产周期数)/临床妊娠周期数×100%;活产率=活胎分娩周期数/移植周期数×100%;早产率=(孕周<37周的分娩周期数)/分娩周期总数×100%。
五、统计学分析
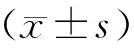
结 果
一、常规IVF周期患者临床资料
1.基线资料:本研究共纳入1 597个常规IVF周期。其中,A1组(无0PN受精)731个周期、A2组(0<0PN受精率≤20%)495个周期、A3组(0PN受精率>20%)371个周期。A2、A3组患者的年龄低于A1组(P<0.05),AMH水平显著高于A1组(P<0.05),基础FSH值显著低于A1组(P<0.05)。 三组间不孕年限、BMI比较无显著差异(P>0.05)(表1)。
表1 常规IVF周期3组患者基本情况比较(-±s)
2.促排卵资料:A2、A3组患者用药天数、长方案占比、获卵数显著高于A1组(P<0.05);A2组拮抗剂方案占比最低、获卵数最高,与其余两组有显著差异(P<0.05)(表2)。
表2 常规IVF周期3组患者促排卵治疗情况比较[(-±s),%]
二、剩余D3卵裂期胚行囊胚培养情况
常规IVF周期共授精17 882枚卵母细胞,形成2 422枚0PN受精卵,0PN受精卵形成率为13.54%。D3剩余卵裂期胚胎继续培养至D5/6,其中,B1组(0PN来源D3胚胎)2 409枚,B2组(2PN来源D3胚胎)6 602枚。两组的囊胚形成率无显著差异(P>0.05),B1组的可利用囊胚形成率显著高于B2组(P<0.05)(表3)。
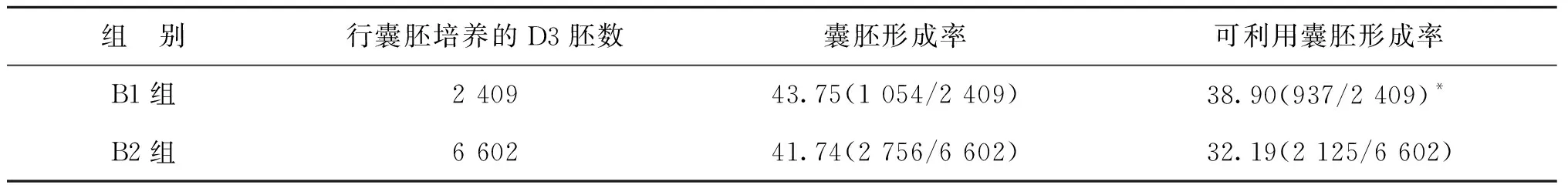
表3 两组剩余D3卵裂期胚胎进行囊胚培养情况比较(%)
三、FET周期临床结局
本研究共纳入了596个FET周期,其中C1组(移植0PN来源冻融囊胚)85周期,C2组(移植2PN来源冻融囊胚)511周期。两组患者一般情况年龄、不孕年限、BMI、优质囊胚比例、D5囊胚占比比较均无统计学差异(P>0.05);C2组的平均移植胚胎数显著高于C1组(P<0.05)。囊胚移植后妊娠结局,两组间胚胎种植率、临床妊娠率、孕周、多胎分娩率、早产率、新生儿体重、新生儿体长比较均无统计学差异(P>0.05),C1组流产率显著高于C2组、活产率显著低于C2组(P<0.05)(表4)。
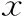
表4 FET周期两组患者基本情况及胚胎移植后临床结局比较[(-±s),%]
讨 论
随着辅助生殖技术的发展,胚胎体外培养体系在模拟体内生长环境方面日趋完善,然而与生理状态相比,体外培养仍存在一些不尽如人意的地方如延迟细胞分裂、降低胚胎氧化代谢及增加乳酸的产生等。在胚胎的动态的生长发育过程中,细胞形态评价仅能提供有限的参考信息,比如授精后17~19 h对原核数量及形态的观察,一些发育较快的受精卵的原核在此时可能已经消失。Campbell等[15]通过Time-lapse时差培养箱观察发现15%~20%受精卵的原核在受精后16 h内就消失了。
本研究通过对IVF-ET周期患者基本情况、临床治疗及实验室数据的比较,发现女方患者年龄、AMH水平、基础FSH水平、获卵数及促排卵方案的选择等因素对0PN受精卵的发生有显著影响。赵双丹等[8]对10 834个IVF周期进行了回顾性分析,利用二元Logistic回归对患者基本情况及获卵数进行分析,发现患者年龄、平均周期数、获卵数多等因素与0PN来源胚胎发生率具有显著相关性。在本研究中,与无0PN来源胚胎发生的患者相比,有0PN来源胚胎的两组的女方患者年龄小、AMH值高、FSH值低、长方案促排占比高、获卵数高,且均有显著性差异,以上参数情况也反映了有0PN来源胚胎的两组的女方患者卵巢储备功能要好于无0PN来源胚胎发生的患者,这一结果与刘景等[16]的报道一致。由于卵巢功能好的患者一般较多的会选择卵泡期长方案促排卵,这一方案获卵数显著高于其他方案[17],并且卵泡发育不同步明显,因此获卵后即使表观成熟度相同的卵母细胞,实际上其卵母细胞成熟度也并非完全一致[8],每个卵母细胞的受精时间点不同,卵母细胞间的原核呈现时间不同步,这就会导致一些发育快的合子的原核出现得早于我们的常规观察受精时间(16~18 h)[5]。在本研究中为探究0PN来源胚胎率高于正常值的影响因素,将有0PN来源胚胎的患者做了进一步的分组比较,两组间患者自身因素数据无显著差异,只有在促排方案选择及获卵数上存在显著差异,0PN来源胚胎率低的组获卵数显著高于0PN来源胚胎高的组,从而推测获卵数及促排卵方案仅影响了0PN来源胚胎的产生,并未对其0PN来源胚胎率的高低造成显著影响。
本研究中0PN受精卵发生率13.54%(2 422/17 882)。在1 597个常规IVF周期中无0PN受精卵周期占45.77%(731/1 597),0PN受精卵率在0%~20%之间的周期占31.00%(495/1 597),0PN受精卵率20%以上的周期占23.23%(371/1 597)。在没有Time-lapse时差培养箱的情况下0PN受精卵发生是不可避免的,囊胚培养不仅能形成比卵裂胚更具发育潜能的囊胚,而且在培养过程中染色体异常、发育潜能差的胚胎会被淘汰。有文献报道0PN来源囊胚染色体正常率(60%)显著高于D3卵裂期胚胎(40%)[18],所以囊胚培养可以对胚胎进行筛选。本中心对于0PN来源胚胎在D3均不选择移植,而是继续培养至D5/D6囊胚阶段选择冷冻保存。有研究发现利用Time-lapse时差培养箱培养,发育快的胚胎原核消失要早于正常发育的胚胎,在授精后固定时间16~18 h观察受精形成的0PN受精卵大多数是由于错过了这些发育快的胚胎的原核观察时间,在随后的囊胚培养过程中,0PN来源胚胎的囊胚形成率与2PN来源胚胎的囊胚形成率比较无显著差异[19]。Yao等[18]将1 649枚临床废弃胚胎(包括正常及异常受精胚胎)行囊胚培养,发现那些发育快、在观察受精时未观察到原核的0PN来源胚胎的囊胚形成率为16.7%,与2PN来源胚胎的囊胚形成率22.6%相近;而那些在观察受精时已经卵裂的胚胎的囊胚形成率达63.8%,显著高于2PN来源胚胎的囊胚形成率。在本研究中0PN来源胚胎的囊胚形成率与2PN来源胚胎的囊胚形成率比较无显著差异,与以上文献一致;并且0PN来源胚胎可冷冻囊胚形成率显著高于2PN来源胚胎(P<0.05),造成这种差异的可能因素为2PN优质卵裂胚进行了移植或冷冻,剩下质量较差的胚胎行囊胚培养。这一结果与Fu等[20]报道一致。但也有报道发现0PN来源胚胎的囊胚形成率(30.03%)显著低于2PN来源胚胎的囊胚形成率(45.71%)[21]。
人类辅助生殖技术的最终目的是使患者获得妊娠并成功分娩健康的婴儿。关于0PN来源胚胎移植是一个备受关注的问题。近年来,一些研究利用囊胚培养技术或Time-lapse时差培养箱对0PN来源胚胎选择移植并成功分娩健康婴儿[8-12,16,19]。本研究将0PN来源胚胎继续培养至囊胚,冷冻保存,在无2PN来源胚胎可以利用的情况下,对0PN来源囊胚复苏移植。比较同期0PN、2PN来源囊胚移植后的妊娠结局及新生儿情况,尽管2PN来源囊胚移植的临床妊娠率、胚胎种植率高于0PN来源囊胚妊娠率、种植率,但无显著差异(P>0.05),这与刘景等[16]的研究一致。在陈国勇等[22]的研究中,0PN来源囊胚冻融移植的种植率、临床妊娠率均显著高于2PN来源囊胚(P<0.05)。马水英等[9]则认为0PN来源囊胚移植的临床妊娠率、种植率显著低于2PN来源囊胚,该研究分别对IVF、ICSI两种受精方式不同受精来源的囊胚的FET周期妊娠结局进行了对比分析,发现IVF受精方式无论D5还是D6的2PN来源囊胚的临床妊娠率、种植率均显著高于0PN来源囊胚(P<0.05);而ICSI受精方式中相同发育天数的0PN来源囊胚与2PN来源囊胚的临床妊娠率、种植率无显著差异(P>0.05);同样,在该研究中也报道了IVF受精方式0PN来源囊胚冻融移植的流产率、活产率与2PN来源囊胚相比均有显著差异(P<0.05)。本研究也有相似结果,0PN来源囊胚对比2PN来源囊胚冻融移植的流产率(40.0% vs. 20.8%)更高、活产率(24.71% vs. 38.75%)更低。
在体外受精-胚胎移植过程中,染色体非整倍体是导致胚胎停育、自发性流产的主要原因。石小丹等[23]通过植入前遗传学检测技术(PGT)对78枚0PN来源囊胚检测,发现整倍体率仅为28.21%,显著低于2PN来源囊胚的46.53%及1PN来源囊胚的63.33%(P<0.05)。在本研究中,0PN来源囊胚与2PN来源囊胚冻融移植后比较妊娠患者的多胎分娩率、孕周、早产率、新生儿畸形率、体重、体长等指标,均无显著差异(P>0.05),与Chen等[24]研究一致。本研究中2PN来源囊胚移植患者孕周较低、早产率较高的主要因素是2PN来源囊胚移植患者多胎分娩率高于0PN来源囊胚(20.71% vs. 9.52%),2PN来源囊胚移植46例早产患者中30例多胎分娩,2PN来源囊胚移植的新生儿4例畸形(卵圆孔闭合2例、右手拇指缺如1例,以及肛门闭锁1例出生后存活10 d)。
本研究还有一些不足之处,比如由于未对冻融囊胚移植周期的流产绒毛进行核型分析,因此不能确定0PN来源囊胚如此高的流产率是否由于染色体异常所致。
综上所述,接受常规体外受精-胚胎移植治疗的患者卵巢储备情况可能会对0PN来源胚胎的形成有一定影响;与2PN来源囊胚相比,0PN来源囊胚移植后流产率、活产率存在一定差异,但在患者无2PN来源胚胎可移植的情况下,0PN来源囊胚移植提高了胚胎利用率,降低了患者诊疗费用,减少了患者精神及身体上的痛苦,有很大利用价值。当然0PN来源囊胚移植的风险也是一个值得关注的问题,Time-lapse时差培养箱及植入前诊断技术是目前尽量避免这类风险的有效途径。
