shRNA-Survivin基因对A549细胞增殖、迁移和凋亡的影响
2018-03-11吴呈霖王梅芳雷怀定
吴呈霖 王梅芳 雷怀定
近50年来,肺癌的发病率和死亡率逐年增加,已经超过其他肿瘤,成为威胁人类健康的“杀手之一”[1]。据人群统计学大数据显示,在男性人群中,肺癌的发病率和死亡率占所有恶性肿瘤的第一位;在女性人群中,肺癌占据第二位[2]。目前肺癌的治疗以手术为主,但术后复发率高,效果不佳[3]。因此,寻找更好的基因治疗靶点,为临床上肺癌患者提供新的治疗思路,仍然具有十分重要的意义。
RNA干扰(shRNA)技术可以有效沉默基因表达,该过程主要通过双链RNA(dsRNA)使目标基因相应的mRNA选择性失活得以实现的[4]。shRNA干扰技术是通过短反义核酸锁定细胞mRNA,从而实现其随后的降解。其反过来又阻断了该蛋白的进一步表达/聚集,导致其水平下降,抑制基因表达[5]。Survivin是凋亡抑制蛋白家族的新成员,Survivin具有肿瘤特异性,只表达于肿瘤和胚胎组织,且与肿瘤细胞的分化增殖及浸润转移密切相关。有研究发现Survivin基因在鼻型NK/T细胞淋巴瘤的发病发展过程中具有高表达的特性,并且与p53、bcl-2蛋白的表达具有相关性[6]。本文旨在探讨shRNA干扰 Survivin质粒对肿瘤细胞的增殖,凋亡和迁移的影响。
资料与方法
一、实验材料
1. 肺腺癌细胞系A549的培养: 本实验以人肺腺癌细胞系A549为实验材料。所有细胞购自中科院上海细胞研究院。细胞经离心收集后,以2×104/cm2的密度将其种植于25×25 cm2的培养瓶中。加入含10%胎牛血清(Gibco-BRL, Gaithersburg, MD)的RPMI 1640培养液(Gibco-BRL, Gaithersburg, MD),而后将细胞进行后续实验。
2. 构建shRNA干扰 Survivin慢病毒载体: sh RNA Survivin质粒由上海吉凯公司合成,选择pHBLV-U6-ZsGreen-PGK-Puro作为质粒的克隆载体。shRNA干扰 Survivin载体病毒载体的克隆切入点是XhoI/BamHI,编号为ENST00000003424。经过基因测序,从而证明序列的正确性。
三、实验方法
1. 实验分组: 将A549细胞分成3组,即空白对照组,空白病毒载体对照组和shRNA干扰 Survivin慢病毒载体组。空白对照组为未做任何处理的细胞组,空白病毒载体对照组是经空白载体的慢病毒转染的细胞组,shRNA干扰 Survivin组是由shRNA干扰 Survivin慢病毒的干扰载体构建的慢病毒转染细胞组。以ZsGreen为慢病毒荧光探针,用荧光显微镜观察细胞慢病毒的转染效率。
2. 实时荧光定量PCR检测: 3组细胞在融合率达80%以上后,用0.25%胰蛋白酶消化后放入15 ml离心管中,加入1 ml的Trizol RNAiso,裂解细胞,提取RNA后根据Takara逆转录试剂盒(DRR820A,Takara,日本)的说明书进行实验,将逆转录的cDNA保存在4 ℃冰箱中备用。根据Takara荧光定量PCR试剂盒的说明书的要求,采用20 μl的反应体系,加入各样品,进行荧光定量PCR的检测。采用FS2000系统对PCR进行分析,反应条件预设为预变性95 ℃ 30 s; 95 ℃ 5 s;60 ℃ 30 s, 40个循环。溶解曲线:95 ℃ 5 s; 60 ℃ 1 min。降温: 50 ℃ 30 s,1个循环。内参基因GAPDH和表皮成纤维细胞的标志物小鼠抗波形蛋白(Vimentin)引物由上海生工公司生产,见表1。采用2-△△Ct的方法计算目的基因的相对表达量。

表1 目的基因的引物序列
3. Western-blot检测: 3组细胞处理后,加入1 ml RIPA细胞裂解液,各组细胞在冰上裂解30 min,收集入1.5 ml的离心管中,在预冷4 ℃的离心机中离心,预设:以离心半径8 cm,5 000 r/min,离心5 min后提取上清,经95 ℃煮沸后,收集蛋白备用。按照说明书制备浓缩胶10 ml,分离胶20 ml。上样后电泳分离,转PVDF膜后孵育一抗,在4 ℃冰箱避光孵育过夜(>12 h)。Survivin一抗(ab76424, Abcom公司,中国)经一抗稀释液1︰10 000稀释后加入样本离子膜。第2天用PBST稀释液洗膜,重复3次,加用山羊抗小鼠IgG二抗(P-2771MP, ThermoFisher,中国)经二抗稀释液1︰1 000稀释后孵育二抗1.5 h,用PBST稀释液洗膜,重复3次,而后用DAB显影液处理样本。Image J软件分析蛋白条带。
4. Transwell小室实验检测细胞的迁移: 将空白对照组,空白病毒载体组,shRNA干扰 Survivin载体病毒组等细胞经胰蛋白酶消化后收集,按照试剂盒(康宁Transwell小室3402,Costar)的说明书,将基底膜的基质原液放在冷藏冰箱(4 ℃)过夜融化,然后与预冷的无血清的RPMI-1640按照1︰3的比例配置侵袭上室凝胶液体,以每孔55 μl的量包被Transwell小室的上室,放置在37 ℃的孵育箱,2 h后使上室成胶。然后上室每孔接种200 μl不含血清的细胞培养液,下室加入10%胎牛血清的RPMI-1640培养液500 μl。然后将Transwell板放置在37 ℃的孵育箱中培养24 h后用结晶紫染色。然后将Transwell板用倒置光学显微镜,拍照,并且进行细胞计数。所有实验均重复3次。
5. CCK-8实验检测细胞的增殖: 将空白对照组,空白病毒载体组,shRNA干扰 Survivin载体病毒组等细胞经胰蛋白酶消化后收集,按照CCK-8试剂盒(CA1210,索莱宝,中国)的说明书,将3组转染后的细胞接种在96孔板中,转染细胞以每孔5 000个/100 μl的接种量接种,72 h后每孔加入10 μl的CCK-8的试剂,放到37 ℃的孵育箱中培养2 h。然后用酶标仪在450 nm波长处测定吸光度,每组设置3个复孔。
6. AV-PI双染检测细胞的凋亡: 将空白对照组,空白病毒载体组,shRNA干扰 Survivin载体病毒组等细胞经胰蛋白酶消化后收集,按照AV-PI的试剂盒的说明书(4830-01-1,深圳纽邦,中国)检测3组细胞的凋亡率。流式细胞仪分析各组样本,计算各组的凋亡率,凋亡率的计算=(早期凋亡细胞数+晚期凋亡细胞数)/细胞总数。Annexin V+/PI-为早期凋亡细胞,Annexin V+/PI+为晚期凋亡和坏死细胞,Annexin V-/PI-为具有正常活性的细胞。
四、统计学方法
结 果
一、shRNA干扰 Survivin病毒载体的构建和转染
慢病毒转染效率,见图1。慢病毒滴度的检测结果:shRNA干扰 Survivin病毒组的慢病毒的滴度为1×108TU/ml,这说明慢病毒转染细胞具有较高的转染效率。

图1 shRNA干扰 Survivin载体病毒载体的转染;注:用0.11 μl和0.033 μl慢病毒转染肺癌细胞系A549细胞,慢病毒滴度的检测结果:shRNA干扰 Survivin载体病毒组慢病毒的滴度为1×108 TU/ml
二、Transwell实验检测细胞的迁移
Transwell实验结果显示,空白对照组中透过分子筛的细胞数为(131.32±18.39,n=3),空白载体病毒对照组中透过分子筛的细胞数为(142.11±14.02,n=3),shRNA干扰 Survivin载体病毒组中透过分子筛的细胞数为(52.11±4.09,n=3)。三组之间比较具有明显的统计学差异(F=31.982,P<0.05)。其中shRNA干扰 Survivin载体病毒组和空白载体病毒组相比,具有明显的统计学差异(P<0.05)说明shRNA干扰 Survivin载体病毒组细胞的迁移比空白载体病毒组细胞数少,见图2。

图2 Transwell实验检测细胞的迁移检测结果;注:A:空白对照组;B:空白载体病毒对照组;C:shRNA Survivin慢病毒载体组
三、CCK-8检测细胞的增殖
CCK-8检测结果显示,空白对照组细胞的增殖率(%)为(60.34±1.24,n=3),空白载体病毒对照组的增殖率(%)为(51.12±2.47,n=3),shRNA干扰 Survivin载体病毒组的增殖率(%)为(24.27±3.11,n=3),三组比较有明显的统计学差异(P<0.05)。shRNA干扰 Survivin载体病毒组与空白载体病毒对照组比较具有明显的统计学差异(P<0.05)提示shRNA干扰 Survivin载体病毒组细胞的增殖率比空白载体病毒对照组低,见图3。

图3 CCK-8检测细胞的增殖(×100)
四、AV-PI检测细胞的凋亡
AV-PI检测结果显示,空白对照组细胞的凋亡率(%)为(4.21±1.24,n=3),空白载体病毒对照组的凋亡率(%)为(3.09±1.13,n=3),shRNA干扰 Survivin载体病毒组的凋亡率(%)为(35.21±13.31,n=3),三组比较具有明显的统计学差异(P<0.05)。shRNA干扰 Survivin载体病毒组与空白载体病毒对照组比较具有明显的统计学差异(P<0.05)。说明shRNA干扰 Survivin载体病毒组细胞的凋亡率比空白载体病毒对照组要高,见图4。
五、RT-qPCR和Western-Blot检测各组的凋亡基因Caspase-3,Caspase-9的表达
shRNA干扰 Survivin载体病毒组与空白载体病毒组相比,具有统计学差异(t=2.097,P=0.0219<0.05)。从mRNA水平上说明shRNA干扰 Survivin载体病毒组中Caspase-3与空白载体病毒组相比,表达量降低,表明shRNA干扰 Survivin可以有效抑制凋亡蛋白Caspase-3的表达,从而可以抑制凋亡。shRNA干扰 Survivin载体病毒组与空白载体病毒组相比,具有统计学差异(P<0.05)。shRNA干扰 Survivin载体病毒组中Caspase-9与空白载体病毒组相比,前者表达量降低,表明shRNA干扰 Survivin可以有效抑制凋亡蛋白Caspase-9的表达,从而可以抑制凋亡。Western-Blot检测结果显示,shRNA干扰 Survivin载体病毒组与空白载体病毒组相比,具有统计学差异(P<0.05)。shRNA干扰 Survivin载体病毒组中Caspase-3与空白载体病毒组相比,表达量降低,表明shRNA干扰 Survivin可以有效抑制凋亡蛋白Caspase-3的表达,从而可以抑制凋亡。shRNA干扰 Survivin载体病毒组与空白载体病毒组相比,shRNA干扰 Survivin载体病毒组中Caspase-9表达量降低(P<0.05),表明shRNA干扰 Survivin可以有效抑制凋亡蛋白Caspase-9的表达,从而可以抑制凋亡,见图5。
讨 论
shRNA技术相较于siRNA技术具有明显的优势,具体优势在于shRNA技术可以稳定的表达于细胞体系中,并且不会随着细胞的不断传代,表达效价随之降低[7]。shRNA技术可以更好的针对基因进行沉默,可以使基因获得更加稳定。鉴于以上优点。shRNA技术越来越引起大家的注意,为临床上进行基因治疗提供了新的研究方法。唐益庭等[8]用shRNA下调泛素表达,探究shRNA对肺癌细胞的作用,发现shRNA可以抑制人肺癌H1299细胞生长并促进其凋亡。本研究采用shRNA技术,构建shRNA干扰 Survivin病毒载体,从基因水平将Survivin基因沉默,抑制Survivin基因的表达,观察了Survivin基因沉默后的肿瘤细胞的凋亡,迁移和增殖的水平。
Survivin是凋亡抑制蛋白家族的新成员,Survivin具有肿瘤特异性,只表达于肿瘤和胚胎组织[9-10]。‘梦泽等[11]采用survivin基因表达对肿瘤细胞A549和Hela S3细胞的影响进行探讨,发现siRNA能有效沉默survivin基因在多种肿瘤细胞中的表达,从而抑制肿瘤细胞的增殖。本研究探讨shRNA-Survivin基因对肺癌细胞增殖、迁移和凋亡的影响,旨在寻求新的基因治疗方法,为临床上肺癌的治疗提供新的思路。

图4 AV-PI检测细胞的凋亡;注:A:空白对照组的凋亡检测;B:空白载体病毒组的凋亡检测;C:shRNA干扰 Survivin载体病毒组的凋亡检测;D: 三组凋亡的检测结果分析
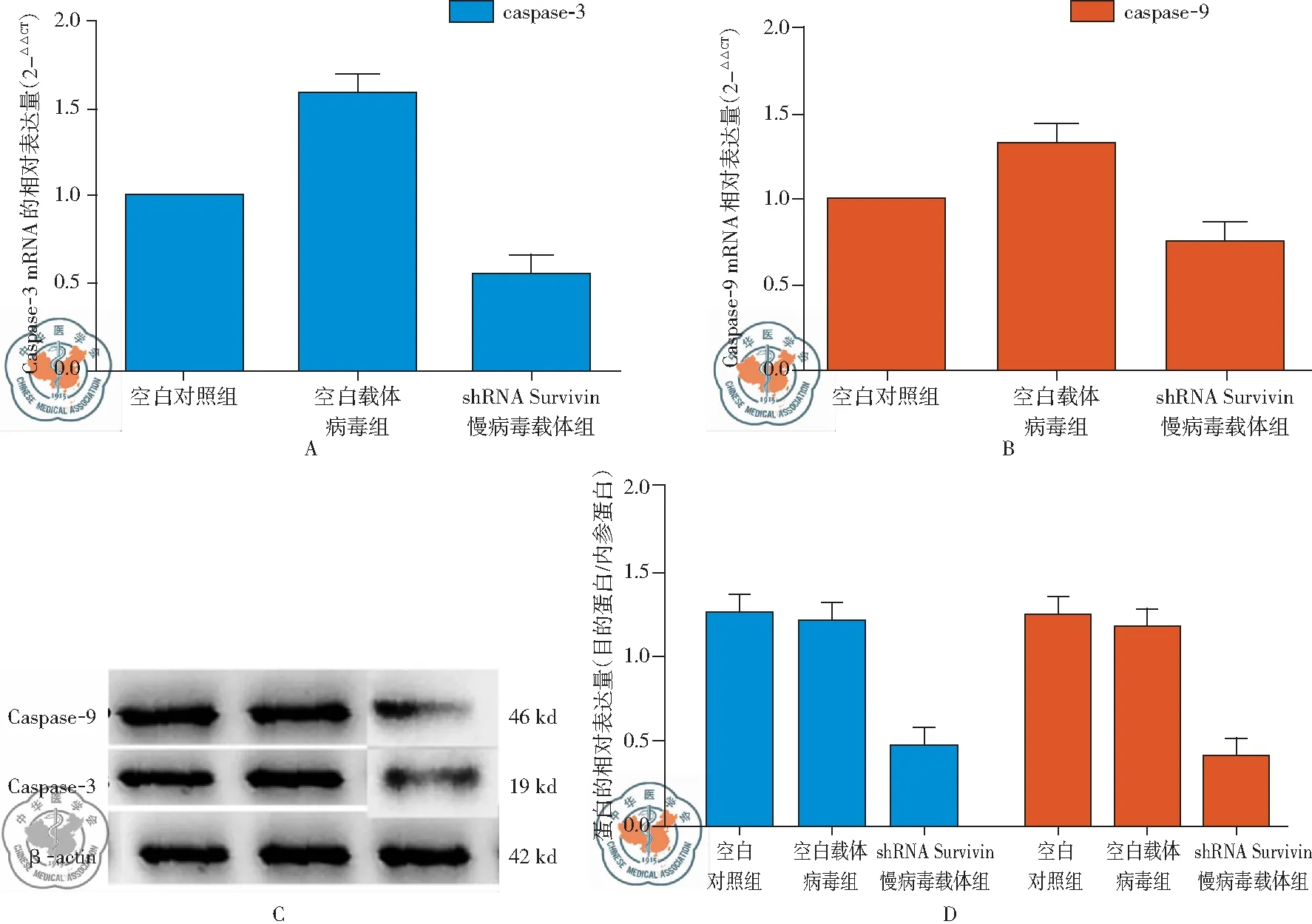
图5 RT-qPCR和Western-Blot检测空白对照组,空白载体病毒组和shRNA干扰 Survivin载体病毒组的凋亡基因Caspase-3,Caspase-9的表达水平;注:A:Caspase-3基因的mRNA表达水平;B:Caspase-9基因的mRNA表达水平;C:Western-Blot检测结果;D:Western-Blot检测结果的蛋白相对表达量的结果分析
Caspase家族是近年来细胞凋亡领域中分子生物学研究的重要发现之一,在凋亡的最后阶段是通过Caspase家族的激活和表达而实现的。其中Caspase-3和Caspase-9是Caspase家族中与凋亡密切相关的蛋白酶[12-13]。郭晓东等[14]的研究表明Caspase-9蛋白酶与肝癌细胞的凋亡有密切联系。本研究将Caspase-3和Caspase-9作为肺癌细胞凋亡的标志蛋白,研究在shRNA作用下,其对肺癌细胞凋亡的影响。通过RT-qPCR方法检测shRNA-Survivin对肺癌细胞中凋亡基因Caspase-3和Caspase-9的mRNA水平表达的影响。结果显示,shRNA-Survivin载体病毒组与空白载体病毒组相比,前者可以明显提高肺癌细胞的凋亡率,由此可见shRNA-Survivin在肺癌细胞的凋亡中具有明显的作用。另外通过蛋白水平Western-Blot检查结果也表明了此种趋势,进一步证实了shRNA干扰 Survivin载体在肺癌细胞的凋亡中具有明显促进作用。
王俊钢等[15-18]研究证实了非小细胞肺癌的迁移与小RNA有关,本研究进一步利用Transwell的实验方法检测shRNA干扰 Survivin对肺癌细胞的迁移的作用。发现shRNA干扰 Survivin对肺癌细胞的迁移具有明显的抑制作用。另外,本研究还利用CCK-8实验方法检测了肺癌肿瘤细胞的增殖,发现shRNA干扰 Survivin对肺癌细胞的增殖具有明显抑制作用。本研究利用AV-PI凋亡检测试剂盒检测细胞的凋亡,结果表明shRNA干扰 Survivin对肺癌细胞的过度凋亡也具有明显增强作用。
然而本文结果,只是初步探讨了shRNA干扰Survivin对肺癌细胞的作用,发现其可以有效的抑制肺癌细胞的迁移和增殖,并且提高其凋亡率,但是对其具体起作用的分子生物学机制并不完全明了,尚需进一步的研究。shRNA干扰 Survivin可以有效的抑制肺癌细胞的迁移和增殖,并且提高其凋亡率,为临床上肺癌的预防与治疗提供了新的思路与方法。
