GC-PFD法检测果蔬农药残留的基质干扰及判定
2023-10-21姚晓寒魏山友
沈 欢,姚晓寒,王 蕾,魏山友
(1.贺州市检验检测中心,广西 贺州 542899;2.富川瑶族自治县检验检测中心,广西 富川 542700)
长期以来,农业生产依靠农药对农作物病虫害进行防治,因此,农药残留问题已成为制约农业高质量发展的主要因素。农药残留是指农药使用后残存于生物体、食品和环境中的微量农药原体、有毒代谢物、降解物和杂质的总称[1]。农药残留超过最大残留限量时,会对人畜产生不良反应,或通过食物链对生态系统中的生物造成毒害[1]。在实行“从农田到餐桌”的食品安全保障体系中,农药残留检测工作起到了关键的作用。
气相色谱-火焰光度检测法(GC-FPD)对含硫、磷化合物具有高选择性和高灵敏度[2-3],因具有选择性好、灵敏度高、重复性好等优点,它仍然是有机磷农药残留检测的重要方法之一[4]。但GC-FPD技术的局限性在于利用保留时间定性,当样品基质中含有硫、磷化合物时,易出现基质干扰峰(假阳性),影响检验结果的判定。基质干扰是指样品中非目标化合物对检验结果的干扰。在气相色谱分析中,基质干扰主要表现为样品基质中的某些成分在检测时与目标物质发生相同或相近的保留行为,从而在色谱图中出现重叠或相近的色谱峰。近年来,关于果蔬基质对农残检测干扰的研究较多[5-7],但大多涉及的基质种类单一,农药品种较少。
本研究考察了100多种果蔬基质对29种有机磷农药残留检测的干扰,探究不同类别果蔬的基质干扰峰特点,并采用气相色谱-质谱联用技术(GC-MS)对干扰峰进行定性确认,以期为果蔬农残检测提供更精准的判定。
1 材料与方法
1.1 材料与试剂
本研究所用材料均为2017—2023年广西种植业产品质量安全例行监测的样品;29种有机磷类农药(敌敌畏、敌百虫、甲胺磷、速灭磷、乙酰甲胺磷、灭线磷、治螟磷、甲拌磷、氧乐果、特丁硫磷、二嗪磷、久效磷、地虫硫磷、乐果、磷胺、甲基毒死蜱、甲基对硫磷、毒死蜱、杀螟硫磷、对硫磷、马拉硫磷、倍硫磷、水胺硫磷、喹硫磷、丙溴磷、杀扑磷、甲基硫环磷、硫环磷、三唑磷)标准品:100 μg/mL,农业部环境保护科研检测所;乙腈、丙酮(HPLC级,美国Fisher公司);氯化钠(分析纯,国药集团化学试剂有限公司);QuEChERS提取盐包(4 g MgSO4、1 g NaCl、0.5 g DHS、1 g TSCD)、QuEChERS净化管(150 mg PSA、15 mg GCB、885 mg MgSO4),岛津(上海)实验器材有限公司。
1.2 仪器与设备
GC-2010 Plus气相色谱仪,配有双火焰光度检测器(FPD),双aoc-20i自动进样器(日本岛津公司);GCMS-TQ8040 气相色谱/三重四级杆质谱联用仪(日本岛津公司);T25 basic型匀浆机(德国IKA公司);L550离心机(湘仪离心机仪器有限公司);Multi Reax涡旋振荡器(德国Heidolph公司);Micro17微量离心机(美国赛默飞公司);TTL-DCⅡ型氮吹仪(北京同泰联科技发展有限公司)。
1.3 实验方法
1.3.1 样品前处理方法
气相色谱样品前处理:准确称取 25.0 g 试样、7.0 g 氯化钠于 100 mL 塑料具塞离心管中,加入 50 mL 乙腈,在匀浆机中高速匀浆 2 min,室温下静止 10 min。然后以 5000 r/min 高速离心 5 min,吸取上层清液 2 mL 于离心管中,50 ℃ 氮吹至近干,丙酮定容至 1.4 mL,过 0.2 μm 滤膜,待测。
质谱定性样品前处理:称取 10.00 g 试样于 50 mL 塑料离心管中,加入 10 mL 乙腈、QuEChERS提取盐包(4 g MgSO4、1 g NaCl、0.5 g DHS、1 g TSCD)及1颗陶瓷均质子,盖上离心管盖,剧烈震荡 1 min 后以 4200 r/min 离心 5 min。吸取 6 mL 上清液于QuEChERS净化管(50 mg PSA、50 mg C18、150 mg MgSO4),旋涡混匀 1 min,以 4200 r/min 离心 5 min。准确吸取 2 mL 上清液于 10 mL 离心管中,40 ℃ 水浴中氮吹近干,加入 1 mL 乙酸乙酯复容,过0.2 μm微孔滤膜用于测定。
1.3.2 标准溶液配制方法
将各农药标品(100 μg/mL)用丙酮配制成 10 μg/mL 的标准储备液,贮存在 -18 ℃ 条件冰箱,备用。用丙酮将 10 μg/mL 的标准储备液分组配制成质量浓度为0.01、0.04、0.1、0.2、0.4 μg/mL 的混合标准工作液,现配现用。
1.3.3 气相色谱条件
参照NY/T 761-2008检验方法,色谱柱:Agilent DB-17(30 m×0.25 mm,0.25 μm),Agilent DB-1(30 m×0.25 mm,0.25 μm);升温程序:120 ℃ 保持 1 min,以 15 ℃/min 升至 240 ℃,保持 18 min;载气(N2)流速 1.2 mL/min,压力 2.4 kPa,进样量 1 μL;不分流进样;V(氢气)∶V(空气)=62.5/90.0;柱流量:1.50 mL/min;进样口温度:220 ℃;检测器温度:250 ℃。
1.3.4 气相色谱-质谱条件
参照23200.113-2018检验方法,色谱柱:岛津SH-I-5Si MS(30 m×0.25 mm,0.25 μm),升温程序:初始温度 50 ℃ 保持 1 min,以 25 ℃/min 升至 125 ℃,再以 10 ℃/min 升至 300 ℃ 并保持 15 min;进样口温度 250 ℃;载气(He)柱流量 1.69 mL/min;进样量 1 μL;不分流进样;电子轰击(EI)离子源,离子源温度 200 ℃;接口温度 250 ℃,检测器电压 1.0 kV,选择Scan全扫描方式进行数据采集,扫描范围50~500m/z。
1.3.5 数据处理
采用oringin2018软件进行数据处理并绘制图谱。
2 结果与分析
2.1 果蔬样品的整体基质干扰峰情况
通过对4000多批次100多种果蔬样品的GC-FPD检验结果进行分析,发现水果表现为无基质干扰峰,色谱图呈一条直线;白萝卜(白萝卜苗)、部分鳞茎类、芸薹属类、白菜类有基质干扰峰出现,且不同类别的蔬菜有各自特征基质干扰峰。白萝卜(白萝卜苗)有独特的基质干扰峰,农残检测不受基质干扰峰影响;芸薹属、白菜类蔬菜在甲胺磷、甲拌磷、氧乐果附近有基质干扰峰出现;韭菜在乙酰甲胺磷处常出现基质干扰峰;葱蒜类蔬菜由于基质富含挥发性硫化物,基质干扰峰成片出现,如表1所示。进一步采用GC-MS技术分析上述存在基质干扰峰的样品,结果:基质干扰峰与有机磷农药均不匹配,与异硫氰酸酯、硫醚等物质高度匹配。

表1 果蔬基质干扰峰情况
2.2 白萝卜(白萝卜苗)的基质干扰峰情况
图1为DB-17柱上白萝卜样品的色谱图。白萝卜基质在DB-17柱上有4个明显的谱峰(6.573、9.283、10.255、13.04 min),且响应值强烈。利用外标法对这几个峰进行判定,发现与1.1节中的29种农药的保留时间都不相同。通过分析比较大量白萝卜色谱图,发现大部分白萝卜基质在DB-17柱都出现上述4个干扰峰,部分出现3个、5个干扰峰,白萝卜苗也出现相似现象。因此,判定这几个峰为白萝卜(白萝卜苗)的特征基质干扰峰。有文献报道,十字花科植物中含有异硫氰酸酯等物质[7]。进一步气相色谱-质谱验证,排除有机磷类农药,结论与上述分析一致,为基质干扰峰。
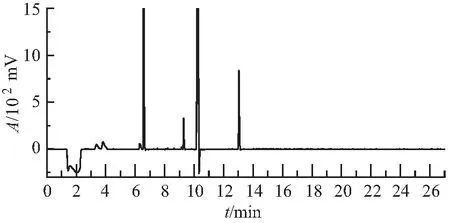
图1 白萝卜样品色谱图
2.3 部分芸薹属、白菜类蔬菜基质干扰峰情况
如图2所示,包菜、青花菜在DB-17色谱柱常出现3个峰,保留时间分别为7.089、8.261、9.069 min。其中,8.261 min 与甲拌磷峰(8.405 min)重叠。通过比较DB-1柱的出峰情况,发现在甲拌磷处没有峰,因此可以判定RT 8.261为基质干扰峰。通过分析近几年色谱图发现,几乎所有的包菜、青花菜样品都有RT 8.261色谱峰出现,部分样品还会出现另外2个峰(5.185、5.333 min)。其中, 5.185 min 与甲胺磷峰(5.156 min)重叠,进一步比较DB-1柱出峰情况,发现在甲胺磷处没有峰,判定此峰为基质干扰峰。
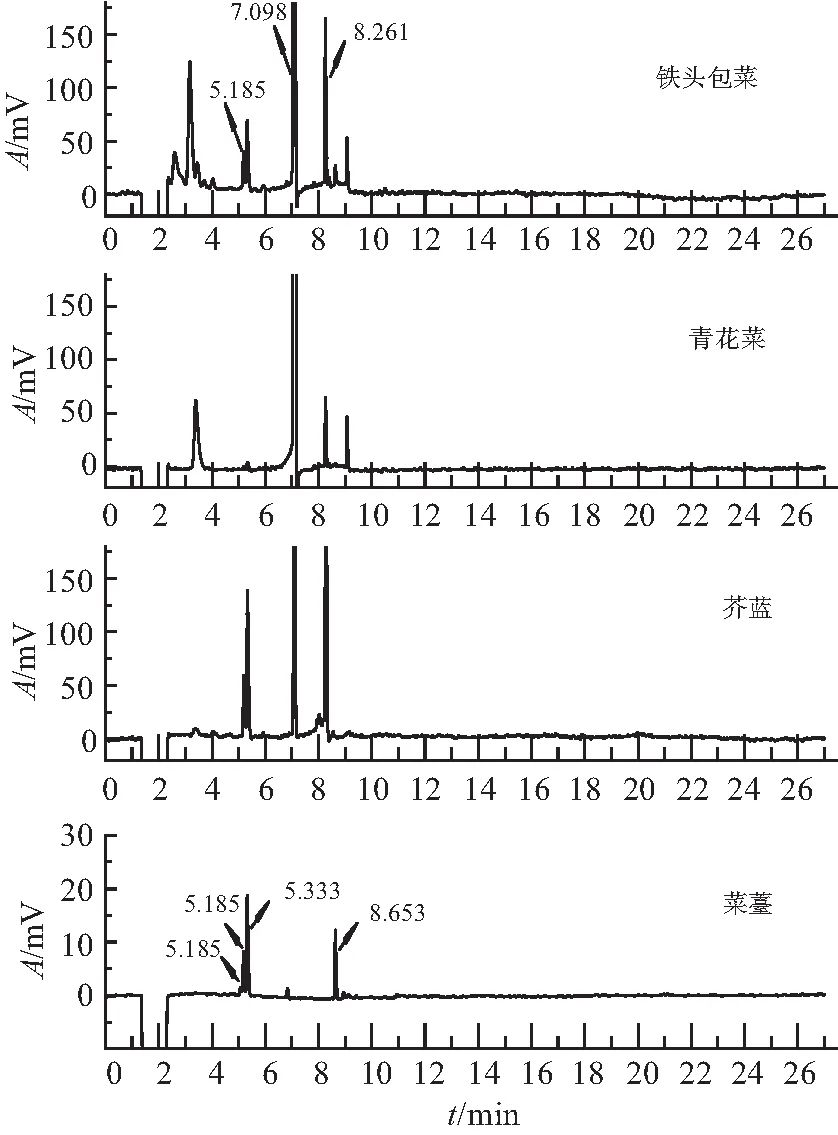
图2 包菜、青花菜、芥蓝、菜薹样品色谱图
芥蓝一般出现4个干扰峰,干扰时间分别为5.185、5.333、7.080、8.273 min,谱峰呈现规律性。与包菜、青花菜类基质干扰峰相似,其在 5.185 min 处与甲胺磷峰重叠,8.273 min 处与甲拌磷峰重叠。通过比较DB-1柱的色谱图,未发现有甲胺磷峰、甲拌磷峰,判定为基质干扰峰。
部分菜薹、上海青、白菜在DB-17柱常出现5个干扰峰,保留时间分别为5.080、5.185、5.333、6.835、8.653 min,前3个干扰峰5.080、5.185、5.333 min 常常连在一起出现。其中,5.185 min 与甲胺磷峰(5.156 min)重叠,8.653 min 与氧乐果峰(8.656 min)重叠。进一步比较DB-1柱的保留时间,结果显示,DB-1柱并无甲胺磷峰和氧乐果峰出现,由此可以判定甲胺磷、氧乐果为基质干扰峰。通过分析近几年色谱图发现,大部分的菜薹、上海青、白菜常出现上述5个干扰峰中的几个,或者不出峰。
进一步气相色谱-质谱验证,基质干扰峰均为假阳性,结论与上述分析一致。结果表明,包菜、青花菜、芥蓝、菜薹、上海青、大白菜类蔬菜既有相同或相近的基质干扰峰,又有各自独特的基质干扰峰。GC-FPD法检测农药残留时,包菜、青花菜、芥蓝、菜薹、上海青、大白菜类蔬菜在甲胺磷、甲拌磷、氧乐果附近常有基质干扰峰出现,通过DB-17、DB-1双柱定量定性,能对有机磷农药残留进行有效判断。有文献资料研究发现,基质干扰峰可能是因为这些蔬菜样品中含有硫醚、硫醇和异硫氰酸酯等挥发性有机硫化物的缘故[4]。
2.4 鳞茎类蔬菜基质干扰峰情况
如图3所示,韭菜基质在DB-17色谱柱出现3个谱峰(7.062、8.136、10.061 min)。其中, 7.062 min 与乙酰甲胺磷峰(7.022 min)重叠。进一步比较DB-1柱的谱峰情况,发现在乙酰甲胺磷处没有峰,因此可以判定乙酰甲胺磷峰为基质干扰峰,韭菜基质中含有与乙酰甲胺磷结构类似的物质。通过比较近几年的韭菜谱图发现,几乎所有的韭菜都在乙酰甲胺磷处出现假阳性峰,大部分韭菜基质易出现3个基质峰,部分出现2个,或4个干扰峰。
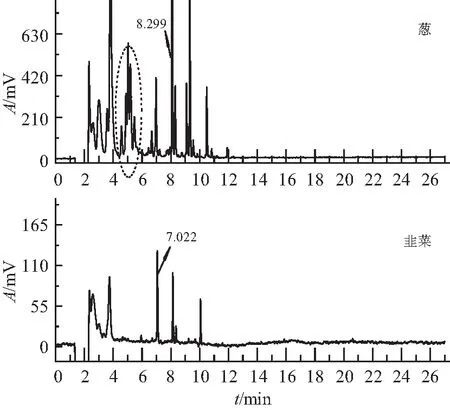
图3 韭菜、葱样品色谱图
葱和青蒜类蔬菜的基质干扰较强,常以片状色谱峰出现。通过比较大量的谱图,我们发现此类蔬菜在DB-17色谱柱上,谱峰一直延续到 12.5 min。其中,保留时间(4.577、4.887、5.032、5.194、5.455 min)呈现5连峰,6.675、6.970 min、8.083、8.299 min,9.089、9.309 min,10.490、10.828 min 常常一起出现,谱峰呈现明显规律性。通过比较保留时间,我们发现 5.194 min 与甲胺磷峰重合,8.299 min 在治螟磷峰(8.32 min)附近。进一步比较DB-1柱的保留时间,结果显示,DB-1柱并无甲胺磷峰和治螟磷峰出现,由此可以判定甲胺磷峰、治螟磷峰为基质干扰。进行气相色谱-质谱验证,基质干扰峰均为假阳性,结论与上述分析一致。有文献资料报道,葱蒜类蔬菜样品中含有大量硫醚、硫代磺酸酯等挥发性有机硫化物[4],这可能是基质干扰峰出现的原因。
GC-FPD技术检测蒜米(干大蒜)时,蒜米的基质干扰峰强烈,在1.3节实验条件下部分干扰峰的响应值达到2×105mV 或更高(0.4 μg/mL 的氧乐果响应值约为2×102mV),远远超过标准曲线的响应值(标准曲线质量浓度为:0.01、0.04、0.1、0.2、0.4 μg/mL)。如图4所示,虚线部分为蒜米的谱图,以片状谱峰出现且响应值较强,实线为有机磷标准溶液谱图。其中,氧乐果(8.656 min)等农药由于响应值较小,已完全掩盖在蒜米基质干扰峰下。分析近几年蒜米的检测结果,采用加标回收等方法,并对比气相色谱-质谱检验结果,我们发现在蒜米的强烈基质干扰峰下,仍然能利用DB-17、DB-1双柱定性对有机磷农药残留进行有效判断。这是由色谱分离技术的基本原理决定的,不同物质分配系数不同,流出色谱柱的保留时间不同,各物质之间的相互作用并不影响其保留时间,因此能进行有效判断。
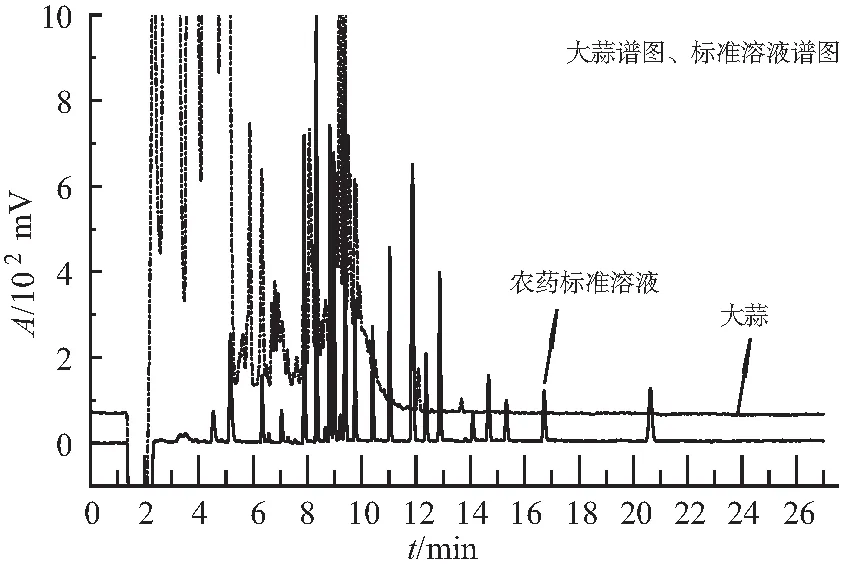
图4 大蒜和农药标准溶液色谱图
3 结论
采用GC-FPD技术检测果蔬有机磷农药残留时,蔬菜基质干扰峰保留时间在 15 min 以内。白萝卜(白萝卜苗)、鳞茎类(韭菜、葱、青蒜、洋葱、蒜米)、芸薹属(甘蓝、青花菜、花椰菜、芥蓝、菜薹)及部分白菜类有各自独特的基质干扰峰,谱峰规律。芸薹属、白菜类蔬菜在甲胺磷、甲拌磷、氧乐果附近有基质干扰峰出现;韭菜在乙酰甲胺磷处常出现基质干扰峰;葱蒜类蔬菜基质干扰峰强烈,谱峰成片出现,利用外标法双柱定性均能对有机磷农药残留进行有效的判定。水果类未发现有基质干扰峰,有机磷农药检测不受影响。
