大孔树脂纯化青蒿多酚的工艺设计及其体外抗病毒活性研究
2023-10-20王云雨王健张丽万新焕牛凤菊周长征
王云雨,王健*,张丽,万新焕,牛凤菊,周长征
(1. 山东中医药大学药学院,山东济南 250300;2. 新疆医科大学第五附属医院药学部,新疆乌鲁木齐 830011)
青蒿又名“方溃”“草蒿”“荻”和“菣”等[1],为黄花蒿(Artemisia annuaLinn.)的干燥地上部位,属一年生型菊科蒿属的清热解毒草本植物[2]。 青蒿作为一种医食两用植物[1],除富含多糖、蛋白质、萜类等有机活性成分之外[3],还含有抗氧化、抗病毒、抗疟、抗肿瘤、防治心血管疾病等活性的“健康卫士”——多酚类化合物[4-7]。 多酚类物质的提取方式通常包括溶剂萃取法、超临界CO2萃取法、超声波辅助提取法、生物酶提取法等[8-9],其分离纯化方法则有配位沉淀法、分子筛层析分离法、大孔吸附树脂分离法及膜分离法等[7]。
目前对多酚类化合物的体外活性研究主要集中于其抗氧化活性,且研究表明其具有一定的抗病毒活性[5]。 人呼吸道合胞病毒(RSV)作为肺炎链球菌科的一种包膜病毒,是引起免疫低下人群下呼吸道感染最常见的病原菌之一,且目前尚无批准的疫苗或特异性药物来对抗其感染[10]。近年来以干扰素和病毒唑治疗RSV 等病毒感染性疾病的研究屡见不鲜,但因其临床效果不太理想且价格昂贵,所以仍存在较大的争议[11]。 单纯疱疹病毒(HSV)是α 疱疹病毒亚科的病原体,一般在外周组织中增殖继而于三叉神经节的神经元细胞核中以双链-DNA(ds-DNA)片段体的形式建立潜伏期,被激活后可到达神经末梢感染邻近的周围上皮组织,如口腔、生殖器黏膜和眼上皮等[12]。 研究表明,青蒿提取物可在分子水平上发挥抗ds-DNA 抗体的活性,故猜测其具有抑制潜伏期HSV 的活性[13]。 传统抗病毒药物多为化药,一般对机体刺激性较大且极易产生耐药性,故可能给患者带来二次伤害。 我国传统中草药因分布广泛易得、药效温和且可避免耐药性的产生等优点,或将成为研制抗病毒制剂的“新星”[14]。
本研究旨在筛选适宜的大孔树脂型号及最优提纯工艺以提高青蒿中多酚类化合物的提取纯度,并采用体外试验对其抗病毒活性加以验证及进一步的研究,以期为青蒿资源的开发与应用提供一定的依据。
1 材料与方法
1.1 材料与试剂
青蒿,安徽省亳州市;Vero 细胞,山东省第一医科大学微生物研究所;呼吸道合胞病毒(RSV)、单纯疱疹病毒(HSV)、肠道病毒71 型(EV71),中国疾病预防控制中心病毒病研究所流感病毒研究室。
福林-酚(folin-ciocaileu)试剂、胰酶、青链霉素混合液(100×,penicillin-streptomycin solution)双抗、MTT(二苯基四氮唑溴盐)、大孔树脂(D101、DM130、X-5、HPD-100、NKA-9、AB-8),北京索莱宝科技有限公司;二甲亚砜,天津富宇精细化工有限公司;1640 培养基,Gibco;胎牛血清、PBS,美国Biological Industries 公司;利巴韦林注射液(产品批号:2104030641),山东鲁抗辰欣药业有限公司;阿昔洛韦(CAS 号:59277-89-3),上海皓鸿生物医药科技有限公司;没食子酸、无水乙醇、无水碳酸钠、浓盐酸、氢氧化钠等均为国产分析纯。
1.2 试验仪器
WD-9415F 型超声波清洗器,北京六一生物科技有限公司;微型中药粉碎机,邢台润联科技开发有限公司;SHZ-D(Ⅲ)循环水式真空泵,郑州巩义市英峪予华仪器厂;离心机,长沙湘智离心机仪器有限公司;FA-1004N 电子天平,上海精密科学仪器有限公司;旋转蒸发仪,上海亚荣生化仪器厂;冷冻干燥机,北京博医康实验仪器有限公司;水浴振荡器,上海博迅医疗生物仪器股份有限公司;紫外可见分光光度计X-5 型,上海元析仪器有限公司;P301 酸度计,山东欧莱博仪器有限公司;CO2恒温培养箱,日本三洋公司;生物安全柜,Thermo 公司;倒置显微镜,日本Olympus 公司;超低温冰箱,中科美菱低温科技股份有限公司;细胞培养瓶、96 孔细胞培养板,美国Corning 公司;酶标仪,美国BioTek 仪器有限公司。
1.3 试验方法
1.3.1 粗青蒿多酚样品的制备 称取洗净、烘干(30 ℃)后的粗碎青蒿300 g,粉碎后过0.25 mm筛,精确称取200.0 g 粉末于圆底烧瓶中,以固液比为1∶10(g/mL)、40%乙醇浸泡6 h。 后于功率125 W、40 ℃条件下水浴超声提取2 次,每次30 min。 提取液以32 层纱布过滤,合并滤液。 将滤液抽滤,3 000 r/min 离心10 min 后以40 ℃减压浓缩至含生药量1 g/mL。 按照样品∶无水乙醇(mL ∶mL)为1∶0.25、1∶0.5、1∶1、1∶2 依次加入相应体积的无水乙醇以除去粗提液中的部分多糖及蛋白质,静置2 h 后以4 000 r/min 离心10 min,取上清液进行减压浓缩(40 ℃)至无醇味,将浓缩液保存于-20 ℃冰箱中,后进行冷冻干燥,冻干后的粗品置于4 ℃条件下备用。
1.3.2 提取液中多酚含量的测定 采用福林-酚比色法[15]。 精密称取没食子酸标准品(≥98%)0.0100 g 于100 mL 容量瓶中,以纯水溶解并定容,摇匀即得质量浓度为0.1 mg/mL 的没食子酸标准品溶液。 分别移取标准品溶液0、0.2、0.4、0.6、0.8、1.0 mL 于10 mL 棕色容量瓶中,后分别加入1.0 mL 福林酚试剂、质量浓度为10%的碳酸钠溶液2.0 mL并以纯水定容,摇匀后避光反应2 h,测定760 nm 波长处的吸光度值,得到没食子酸标准曲线回归方程:y =11.9810x +0.0454,相关系数R2=0.9996。 式中x 为没食子酸标准溶液的质量浓度C(mg/mL),y 为吸光度值A。 标准曲线见图1。

图1 没食子酸标准曲线
移取样品溶液0.5 mL 于10 mL 棕色容量瓶中,加入1.0 mL 福林酚试剂与10%碳酸钠溶液2.0 mL后以纯水定容,摇匀后避光反应2 h,测定760 nm 波长处的吸光度值并代入回归方程,得其多酚质量浓度。
1.3.3 大孔树脂的预处理 分别取10.0 g D101、DM130、X-5、HPD-100、NKA-9、AB-8 大孔树脂,以体积分数为95%乙醇活化24 h,搅拌均匀放出气泡后以纯水洗至无醇味,以5 倍柱体积的5% HCl 浸泡2 h 后以纯水洗至中性,以相同体积2% NaOH 浸泡2 h 后以纯水洗至中性,最终以大量纯水浸泡,备用。
1.3.4 大孔树脂型号的筛选 取预处理的6 种湿树脂各10.0 g 于250 mL 具塞锥形瓶中,各加入10.0 mL 质量浓度为1 g/mL 的青蒿多酚粗提液,吸附30 min 后置于28 ℃、150 r/min 水浴恒温振荡仪上,振荡吸附6 h 并收集其上清液(0.5 mL/h)。自收集的各组(以0.5 mL/h 收集的单个样品为一组)上清液中分别取样以测定多酚浓度C1,同时测定初始提取液的多酚浓度C0。 将吸附饱和的树脂进行抽滤,并以40 ~60 mL 纯水润洗2 次至表面无明显残留的多酚溶液。 加入10.0 mL 体积分数为70%乙醇后再次置于摇床上,相同条件下恒温振荡6 h 并收集上清液(0.5 mL/h),测其多酚浓度C2。 将所得数据代入公式(1)~(3)以计算各树脂的吸附量(mg/g)、吸附率及解吸率(%)即可筛选出最佳型号。
式中,m 为湿树脂质量,V 为上样液体积。
1.3.5 HPD-100 树脂的静态吸附动力学分析分别取1.3.4 中HPD-100 树脂静态吸附过程中每小时所得样液,按1.3.2 中的测定方式得其多酚浓度,计算吸附率并绘制吸附曲线。
1.3.6 上样液质量浓度对吸附率的影响 取10.0 g 预处理的HPD-100 湿树脂6 份,加入质量浓度分别为25、50、100、200、500、800 mg/mL 的青蒿多酚粗提液各10.0 mL,密封置于28 ℃水浴恒温振荡仪上,以150 r/min 振荡吸附6 h 并收集其上清液(0.5 mL/h),测其多酚浓度并按公式(2)计算吸附率。
1.3.7 上样液pH 值对吸附率的影响 取10.0 g预处理的HPD-100 湿树脂8 份,加入pH 值分别为1、2、3、4、5、6、7、8 的青蒿多酚粗提液(质量浓度为50 mg/mL)各10.0 mL,密封置于28 ℃水浴恒温振荡仪上,以150 r/min 振荡吸附6 h 并收集上清液(0.5 mL/h),测其多酚浓度并按公式(2)计算吸附率。
1.3.8 乙醇体积分数对解吸率的影响 取10.0 g预处理的HPD-100 湿树脂7 份,加入质量浓度为50 mg/mL、pH 值为2.0 的青蒿多酚粗提液各10.0 mL,密封置于28 ℃水浴恒温振荡仪上,以150 r/min振荡吸附6 h,加入体积分数分别为40%、50%、60%、70%、80%、90%、100%的乙醇洗脱液各10.0 mL,密封置于28 ℃水浴摇床上,以150 r/min振荡6 h 并收集其上清液(0.5 mL/h),测其多酚浓度并按公式(3)计算解吸率。
1.3.9 HPD-100 树脂的动态吸附与解吸 (1)动态吸附曲线的绘制:取20.0 g 预处理的HPD-100 湿树脂1 份,以湿法装柱的方式装入半径为2.0 cm 的层析柱,以纯水平衡24 h 后加入质量浓度为50 mg/mL、pH 值为2.0 的青蒿多酚粗提液,以2 BV/h(1BV=36.4 mL)的流速过柱并测定每1 BV 流出液中的总多酚浓度Ct,当其达到泄漏点[流出液的总多酚含量(C′t)开始不低于上样液中总多酚含量(C′0)10%时的上样体积]停止上样并绘制动态吸附曲线。
(2)洗脱曲线的绘制:按1.3.9(1)中的方式装柱并将质量浓度为50 mg/mL、pH 值为2.0 的青蒿多酚粗提液以2 BV/h 的流速上样13 BV,经5 BV 纯水洗脱除杂后,以体积分数为70%乙醇洗脱至无紫外吸收(280 nm),每0.5 BV 收集一次洗脱液并测定其总多酚浓度,绘制洗脱曲线。
将含总多酚的洗脱液进行减压浓缩至无醇味,冷冻干燥后测定多酚纯度(混合物中总多酚的质量占其总质量的百分比)。
1.3.10 青蒿多酚抗病毒活性的研究 (1)细胞复苏:将保存于液氮中的Vero 细胞取出并置于37℃条件下融化,后将其放入离心机中以1 500 r/min离心5 min,弃去上清液后以1 mL 细胞生长液(10% 1640 培养基)吹打后移入细胞培养瓶,补加培养液使瓶内液体容积达6 mL。 标记后置于37 ℃、5% CO2培养箱中培养并定时镜检(12 h检1 次)。
(2)细胞传代:待Vero 细胞长成单层且在细胞培养瓶瓶底覆盖率约90%时,弃去原培养液并以2 mL PBS 冲洗2 ~3 次,后向瓶中加入1 mL 0.25%胰酶细胞消化液(含EDTA),轻轻晃动使其覆盖瓶底,置于培养箱中消化5 ~8 min。 轻轻拍打培养瓶使贴壁细胞脱落,立即加入3 mL 10%1640 终止消化,吹打均匀后以1 传2 的方式进行传代,标记后继续培养。
(3)病毒毒力的测定:将冻存于-80 ℃冰箱中的RSV、EV71 和HSV 病毒“三冻三融”之后在1 000 r/min 条件下离心5 min 并收集上清液,将其进行10 倍比稀释(100~1011)后依次加入100 μL 于被单层Vero 细胞覆盖的96 孔板中,每孔平行3 次并设置细胞对照组,标记后置于培养箱中静待48 h。 终止培养后弃去原培养液,以PBS 冲洗两遍后以MTT 在避光条件下染色处理4 h,之后弃去MTT 并以DMSO 进行脱色,在气浴恒温振荡器中振荡15 min 后于酶标仪中测定A490,采用Reed-Muench 两氏法即式(4)计算病毒的半数细胞感染量TCID50。
细胞存活率(%)=试验组A490值/对照组A490值×100 ;
细胞病变率(%)=1-细胞存活率 ;
细胞比距(pd)=(高于50%的细胞病变率-50%)/(高于50%的细胞病变率-低于50%的细胞病变率) ;
式中,C 为高于50%病变率时的首个稀释度,Cm为倍比稀释系数。
(4)药物毒性的测定:将所得冻干青蒿多酚样品以2% 1640 配制成50 mg/mL 药物后过0.22 μm 无菌微孔滤膜除菌除杂,取100 μL 以2 倍比稀释(20~211)加入长好单层Vero 细胞的96 孔板中,设置细胞对照(100 μL 2% 1640)、病毒对照(50 μL 2% 1640+50 μL 病毒)和同浓度阳性药(RSV 与EV71 以利巴韦林为阳性药,HSV 以阿昔洛韦为阳性药;50 μL 阳性药+50 μL 2% 1640),标记培养。 待病毒组病变达90%时终止培养并弃去原培养液,以PBS 冲洗2 遍后依次进行染色、脱色处理,脱色后振荡15 min 并于酶标仪中测定A490,依据式(5)计算药物的半数中毒浓度(TC50)。
式中C药物首孔表示96 孔板中首列药物的浓度,即50 mg/mL。
(5)青蒿多酚体外抗病毒试验:将青蒿多酚药物的最大无毒浓度设置为初始浓度,以2%1640 依次进行2 倍比稀释(20~211)并各加入50 μL 于长好Vero 细胞的96 孔板中,同时设置对照组[同1.3.10(4)的处理方式]。 标记后置于培养箱中,待病毒组病变程度约为90%时进行染色、脱色处理,经振荡后以酶标仪测定A490,并采用Reed-Muench 两氏法即式(6)(7)计算药物的半数有效浓度(EC50)和治疗指数(TI 值)。 其中,TI值为判定药物是否具有抗病毒效果的主要指标。
1.4 数据整理及分析
采用SPSS 20.0 对试验数据进行显著性分析,以Origin 2022 与Microsoft Excel 作图。
2 结果与分析
2.1 六种大孔树脂性能的比较
相关研究表明,树脂的主要功能基(极性)及其孔径、孔隙率、比表面积等因素是影响其性能的关键所在,而被吸附化合物的分子量也是影响大孔树脂“去粗取精”不可忽略的因素[16]。 如表1所示,一般来说酚类化合物应在极性树脂上具有较好的性能,但本试验结果表明NKA-9 的性能并不出众,推测青蒿多酚的化合物分子量偏小,即影响其吸附、解吸效果的主要是孔容、比表面积等空间因素。 HPD-100 在这6 种树脂中的平均孔径最小且平均孔容和比表面积最大,故其吸附青蒿多酚的纯度最高且解吸性能最佳。 6 种树脂的吸附率不存在较大差异,但HPD-100 的解吸率优于其他5 种树脂。 综合考虑,HPD-100 是纯化青蒿多酚的最适树脂。
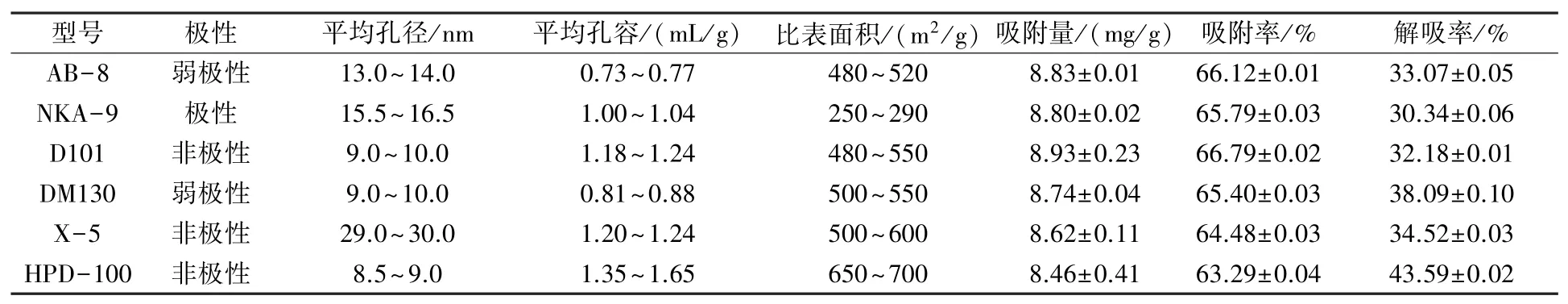
表1 六种大孔树脂空间结构、吸附与解吸性能等的比较
2.2 HPD-100 树脂的静态吸附饱和曲线
如图2 所示,自吸附开始的0.5 h 内青蒿多酚被迅速吸附至HPD-100 树脂内部使其吸附率迅速升至46.70%,至2 h 后达到饱和状态,此后吸附率几乎不再变化。 故选择2 h 为青蒿总多酚的HPD-100 最佳吸附时间。

图2 HPD-100 树脂的静态吸附饱和曲线
2.3 上样液质量浓度对吸附率的影响
如图3 所示,当青蒿多酚上样液的质量浓度为50 mg/mL 时其在HPD-100 树脂上的吸附率明显优于其他浓度。 低于该浓度时吸附率较小的主要原因是树脂上的吸附位点仍有剩余,从而降低了树脂的利用率。 当质量浓度高于50 mg/mL时化合物堵塞引起传质阻力增大,进而影响物质的扩散和吸附,造成多酚化合物的损失。 故确定50 mg/mL 是其最佳上样浓度。

图3 上样液质量浓度对吸附率的影响
2.4 上样液pH 值对吸附率的影响
如图4 所示,当上样液的pH 值为1 ~3 时多酚吸附质主要以分子状态存在,此时其在HPD-100 树脂上的吸附率高于90%,且不存在显著性差异(P>0.05)。 上样液的pH 值不低于7 时青蒿多酚主要以离子态分布,此时不易被树脂所吸附[17]。 当pH 值为4 ~6 或8 时部分苷键发生断裂形成了苷元和糖。 一方面,糖类化合物占领了部分吸附位点,造成了多酚的损失;另一方面,多酚苷元释放后被吸附,导致此时多酚吸附率较中性条件时更高。 故认为pH =2.0 时青蒿多酚在HPD-100 树脂上的吸附效果最佳。

图4 上样液pH 值对吸附率的影响
2.5 洗脱液体积分数对解吸率的影响
如图5 所示,当乙醇洗脱液体积分数为40%~70%时,青蒿多酚的解吸率随乙醇体积分数的升高而增大。 推测其原因为青蒿多酚提取液成分复杂,随乙醇体积分数增大,避免了极性较大的杂质被洗脱下来并增大了树脂的溶胀程度而使多酚类化合物更易被洗脱。 当体积分数继续增大时解吸率反而降低,但均高于40% 乙醇的解吸率(43.59%)。其原因可能是青蒿多酚极性高于该体积分数下的乙醇极性而使其溶解度降低所致。 故认为乙醇洗脱液的最适体积分数为70%。

图5 洗脱液体积分数对解吸率的影响
2.6 HPD-100 树脂的动态吸附与解吸
2.6.1 动态吸附曲线 大孔吸附树脂的纯化性能是其大分子功能基团的吸附性及其孔隙的筛分性相结合的结果[18]。 当吸附目标物的浓度高于限定值时会因吸附位点不足或孔隙堵塞等造成目标物质的泄露,且自其泄漏量开始高于上样液中目标物含量的10%时认定吸附物在目标树脂上达到了泄漏点。 如图6 所示,以pH =2、质量浓度为50 mg/mL 的青蒿总多酚提取物上样,当上样液为13 BV 时其流出液中总多酚浓度开始达初始浓度的10%(11.39%),继续上样发现流出液中多酚浓度迅速升高使树脂利用率显著降低。 故青蒿多酚的最大上样体积为13 BV。

图6 青蒿多酚在HPD-100 树脂上的吸附饱和曲线
2.6.2 动态洗脱曲线 如图7 所示,以70%乙醇溶液对青蒿多酚进行洗脱,当洗脱液体积为2.5 BV 时流出液总多酚质量浓度达到最大(17.48 mg/mL),继续洗脱至流出液在280 nm 处无明显紫外吸收(5 BV)即认为此时多酚已被完全洗出。故认为洗脱液的最佳用量为5 BV。

图7 青蒿多酚在HPD-100 树脂上的洗脱曲线
2.7 青蒿多酚纯度
分别将最佳条件(HPD-100 树脂;上样:pH =2.0、质量浓度为50 mg/mL、13 BV;洗脱:70% 乙醇、5 BV)下所得的洗脱液与粗提液减压浓缩后进行冷冻干燥,测其多酚含量以计算纯度。 结果如表2 所示,此条件下青蒿多酚纯化后的纯度较纯化前增加1.63 倍。

表2 HPD-100 树脂纯化前后青蒿多酚纯度
2.8 青蒿多酚抗病毒活性
2.8.1 病毒TCID50的测定 根据式(4)计算得RSV、HSV-1、HSV-2、EV71 的TCID50分别为10-4.601、10-3.852、10-4.460、10-3.637,试验用100 倍TCID50作为病毒液浓度。
2.8.2 药物TC50的测定 50 mg/mL 青蒿多酚溶液(纯化后)自加入4 h 后,在显微镜下可见Vero细胞明显破裂(约10%),加药24 h 后细胞破裂率可达90%以上。 胞中颗粒物增多且形态改变,随药物浓度降低对细胞毒性减小。 而对照组细胞排列紧凑且无颗粒物出现,细胞形态完整。 药物与阳性药对细胞的TC50见表3。

表3 青蒿多酚与利巴韦林、阿昔洛韦对细胞的TC50值比较
2.8.3 青蒿多酚体外抗病毒试验 (1)青蒿多酚抗RSV:如表4 所示,青蒿多酚溶液对RSV 的抑制效果显著强于阳性对照药,表明其具有显著的抗病毒效果。 推测其原因可能是提取物中的成分多样且各物质间可协同发挥作用,值得推广用于制备相应抗RSV 制剂。

表4 青蒿多酚与利巴韦林对RSV 的EC50与TI 值的比较
(2)青蒿多酚抗HSV:由表5、表6 可知,青蒿总多酚提取物对HSV-1 与HSV-2 均具有一定的灭活作用且对HSV-2 的抑制作用较强,两者效果均优于阳性对照,与张军峰等[19]的研究结果无明显差别。 故可确定青蒿总多酚也具备抗HSV 的生物活性。

表5 青蒿多酚与阿昔洛韦对HSV-1 的EC50与TI 值的比较

表6 青蒿多酚与阿昔洛韦对HSV-2 的EC50与TI 值的比较
(3)青蒿多酚抗EV71:如表7 所示,青蒿多酚对EV71 不存在明显的体外抑制活性。

表7 青蒿多酚与利巴韦林对EV71 的EC50与TI 值的比较
3 讨论与结论
本试验探究了6 种不同型号的大孔树脂对青蒿多酚的静、动态吸附与解吸效果,并以单因素试验对纯化树脂的最佳纯化条件进行了研究。 结果表明,HPD-100 吸附树脂对青蒿总多酚的纯化效果最优,其最佳纯化工艺参数为静态吸附液pH值为2.0、质量浓度为50 mg/mL、吸附时间为2 h,最佳洗脱液的体积分数为70%;动态吸附时其最佳上样量为13 BV,洗脱液最佳用量为5 BV。 在此条件下青蒿多酚的纯度较纯化前增加了1.63倍。 纯化后的青蒿总多酚可表现出对RSV、HSV-1 及HSV-2 的显著抑制活性,对EV71 不存在灭活作用。 王乐乐[20]研究发现,青蒿中存在猫眼草酚D 等多酚类物质,可协同青蒿素等物质发挥抗疟、抗肿瘤活性[21]。 后续可对青蒿总多酚的活性成分、体内抗病毒效果及其作用机制进行深入研究,以期为其资源的开发与应用提供更加充分的理论基础。
