猪TRIM56 全长及其截短体真核表达质粒的构建及蛋白的表达和定位
2023-10-20姚来娣吴香菊齐静丛晓燕李均同贾杏林杜以军
姚来娣吴香菊齐静丛晓燕李均同贾杏林杜以军
(1. 湖南农业大学动物医学院,湖南长沙 410128;2. 山东省农业科学院畜牧兽医研究所/山东省畜禽疫病防治与繁育重点实验室/农业农村部畜禽生物组学重点实验室,山东济南 250100)
TRIM56 是三基序蛋白(tripartite motif protein,TRIM)家族中的一员。 根据TRIM 家族成员之间C 末端结构域的结构差异分为11 个亚家族(C-Ⅰ—C-Ⅺ),而TRIM56 是C-V 亚家族成员之一[1]。 近年来TRIM 家族蛋白的重要性日益凸显,其不仅广泛表达于成年哺乳动物的各种组织中,在细胞内信号通路调控和自噬等方面也发挥着重要的调节作用,尤其是在调节先天性免疫应答方面受到高度重视[2-4]。 随着对TRIM 家族蛋白抗病毒作用的深入研究,发现TRIM 家族蛋白是一种新型的泛素化家族蛋白[5],而蛋白翻译后修饰越来越受到重视。 TRIM56 作为泛素化家族成员之一,对其结构及功能也有了初步的了解。
TRIM56 蛋白于2010 年首次被报道[6],在机体的先天免疫、转录调控、细胞凋亡、抑制肿瘤恶性进展等方面都发挥着极其重要的作用,特别是在抗病毒免疫中的功能尤为重要,而这与TRIM56的结构密切相关。 不同种属的TRIM56 氨基酸组成及结构存在差异,例如猪、人类、小鼠的TRIM56蛋白分别由755、755、734 个氨基酸组成,但它们都具有TRIM 家族共有的3 个N 端保守结构域,即锌指结构域(RING finger domain)、B-box 结构域和超螺旋结构域(Coil-Coil region)。 其中,锌指结构域能够介导不同底物的泛素化,具有E3泛素连接酶特有的标志,因此TRIM56 被认为可以参与蛋白的泛素化蛋白酶体修饰过程[6-7];Bbox 结构域是TRIM 蛋白所特有的,但其功能目前尚不明确[8];超螺旋结构域(C-C 区域)通常位于C 端,对于同源相互作用是必要的,其功能主要是促进大分子复合物的形成以及参与同源二聚体的相互作用[9]。 而TRIM56 的C 末端功能还需深入研究。
目前对人TRIM56 的研究较多,而对于猪TRIM56(swine tripartite motif 56,sTRIM56)的研究相对较少。 因此,还需对sTRIM56 结构和功能的更多特点进行深入研究。 本研究构建了sTRIM56 全长及其截短体的真核表达质粒,并检测其在细胞内的表达及定位,为进一步研究sTRIM56 蛋白全长和其不同结构域的抗病毒作用及分子机制奠定了基础。
1 材料与方法
1.1 试验材料
人胚胎肾细胞(HEK-293T)、猪肺泡巨噬细胞(3D4/21)和空载体pXJ41 由山东省畜禽疫病防治与繁育重点实验室保存。
1.2 主要试剂
RNA-easy Isolation Reagent 购自南京诺唯赞生物科技股份有限公司;DL5000DNA Marker、PrimeSTAR®HS DNA Polymerase、 PrimeScriptTMRT reagent Kit with gDNA Eraser 反转录试剂盒等购自TaKaRa 宝生物工程(大连)有限公司;限制性内切酶EcoRⅠ、BamHⅠ及T4 DNA Ligase 购自Thermo Fisher Scientific 公司;质粒小提试剂盒、DNA 回收试剂盒购自北京天根生物工程有限公司;WesternBright Sirius 化学发光检测试剂盒购自Advansta 公司;Western blotting 一抗稀释液、DAPI染色液购自碧云天生物技术有限公司;转染试剂Lipofectamine®3000、Alexa Fluor 488 标记的羊抗鼠IgG 购自Invitrogen 公司;PVDF 膜购自Millipore 公司;青链霉素混合液、PMSF、Tween-20、cocktail 购自Sigma 公司;Opti-MEM、高糖型DMEM 细胞培养基、胰蛋白酶购自Gibco 公司;DH5α 感受态细胞购自北京全式金生物技术有限公司;兔源Myc 抗体、鼠源Myc 抗体购自Sigma公司;β-actin 抗体购自SantaCruz 公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG 购自武汉博士德公司;4%多聚甲醛通用型组织固定液购自Biosharp 公司;Triton X-100、抗荧光衰减封闭剂购自Solarbio 公司。
1.3 sTRIM56 结构分析及截短体设计
sTRIM56 由755 个氨基酸组成,N 端具有TRIM 家族的3 个保守结构域——锌指结构域(21~60 aa)、B-box 结构域(164 ~205 aa)和超螺旋结构域(220 ~287 aa),但其C 末端结构(288 ~755 aa)尚不十分清楚[1,10]。 根据sTRIM56基因序列的结构特点,参考不同种属的保守序列分析,将其分为4 个不同的截短体,同时为便于表达鉴定,在N 端均添加Myc 标签,构建真核表达质粒。4 个截短体分段分别为Myc-sTRIM56-ΔRING(80~755 aa)、Myc-sTRIM56-ΔN(210 ~755 aa)、Myc-sTRIM56-ΔC(1 ~287 aa)、Myc-sTRIM56-ΔC-C(1~210 aa),结构示意图如图1 所示。

图1 sTRIM56 全长及截短体结构示意图
1.4 sTRIM56 全长及截短体的引物设计
参考NCBI 中sTRIM56的基因序列(GenBank No. KJ881160),结合真核表达载体pXJ41 的酶切位点,设计含Myc 标签的扩增sTRIM56基因全长的特异性引物。 同时根据sTRIM56全长序列以及4 个截短体序列的结构特点,分别设计相应的含Myc 标签序列的扩增sTRIM56截短体的特异性引物。 引物由北京擎科生物技术有限公司合成,引物信息如表1 所示。

表1 PCR 扩增引物及序列
1.5 sTRIM56 全长真核表达质粒的构建及鉴定
猪肺泡巨噬细胞(3D4/21)在24 孔板中培养24 h 后,使用RNA-easy Isolation Reagent 提取总RNA,再使用PrimeScriptTMRT reagent Kit with gDNA Eraser RT-PCR 试剂盒进行反转录获得cDNA。 以cDNA 为模板,分别以F-Myc-sTRIM56-EcoRⅠ和R-sTRIM56-BamHⅠ为上、下游引物,PCR 扩增Myc-sTRIM56(WT)全长基因。 PCR 反应体系为25 μL:cDNA 50 ng,dNTP 2 μL,5×PrimeSTAR Buffer 5 μL,F-Myc-sTRIM56-EcoRⅠ和R-sTRIM56-BamH Ⅰ各1 μL,PrimeSTAR®HS DNA Polymerase(2.5 U/μL)0.25 μL,ddH2O 补足25 μL。 PCR 反应条件:98 ℃预变性2 min;98 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min 30 s,35 个循环;72 ℃延伸3 min。 将PCR 产物进行0.8%琼脂糖凝胶电泳并胶回收。
用EcoRⅠ和BamHⅠ分别双酶切pXJ41 载体和Myc-sTRIM56全长基因,胶回收酶切产物。将目的基因与pXJ41 载体用T4 DNA Ligase 于16 ℃过夜连接;次日,将连接产物转化到DH5α感受态细胞中,37 ℃过夜培养,挑取单菌落接种于含有氨苄西林(50 μg/mL)的5 mL LB 液体培养基中,37 ℃、200 r/min 过夜培养,次日提取质粒,进行EcoRⅠ和BamHⅠ双酶切鉴定。 鉴定为阳性的质粒送北京擎科生物科技有限公司测序。
1.6 sTRIM56 截短体真核表达质粒的构建及鉴定
以成功构建的pXJ41-Myc-sTRIM56(WT)真核表达质粒为模板,Myc-sTRIM56-ΔRING 分别以1F-Myc-sTRIM56-ΔRING-EcoR Ⅰ和RsTRIM56-BamH Ⅰ作为上、 下游引物,Myc -sTRIM56-ΔN 分别以2F-Myc-sTRIM56-ΔNEcoRⅠ和R-sTRIM56-BamHⅠ作为上、下游引物,Myc-sTRIM56-ΔC 分别以F-Myc-sTRIM56-EcoRⅠ和3R-sTRIM56-ΔC-BamHⅠ作为上、下游引物,Myc-sTRIM56-ΔC-C 分别以F-MycsTRIM56-EcoRⅠ和4R-sTRIM56-ΔC-C-BamHⅠ作为上、下游引物,PCR 扩增Myc-sTRIM56各截短体基因。 PCR 反应体系为25 μL:pXJ41-MycsTRIM56 50 ng,dNTP 2 μL,5×PrimeSTAR Buffer 5 μL,上、下游引物各1 μL,PrimeSTAR®HS DNA Polymerase(2.5 U/μL)0.25 μL,ddH2O 补足25 μL。 PCR 反应条件:98 ℃预变性2 min;98 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,35 个循环;72 ℃延伸3 min。 将PCR 产物进行0.8%琼脂糖凝胶电泳并胶回收。
用EcoRⅠ和BamHⅠ分别双酶切pXJ41 载体和Myc-sTRIM56截短体基因,胶回收酶切产物;将目的基因与pXJ41 载体用T4 DNA Ligase 于16 ℃过夜连接;次日将连接产物转化到DH5α 感受态细胞中,37 ℃过夜培养,挑取单菌落接种于含有氨苄西林(50 μg/mL)的5 mL LB 液体培养基中,37 ℃、200 r/min 过夜培养,次日提取质粒,进行EcoRⅠ和BamHⅠ双酶切鉴定。 鉴定为阳性的质粒送北京擎科生物科技有限公司测序。
1.7 Western blotting 检测融合蛋白的表达
将HEK-293T 细胞铺于6 孔板中,待细胞密度达到70%~80%时,利用Lipofectamine®3000 转染试剂分别转染空载体pXJ41 和鉴定正确的重组质粒pXJ41-Myc-sTRIM56(WT)、pXJ41-MycsTRIM56-ΔRING、pXJ41-Myc-sTRIM56-ΔN、pXJ41-Myc-sTRIM56-ΔC、pXJ41-Myc-sTRIM56-ΔC-C 各2 μg,然后置于37 ℃、5% CO2的恒温细胞培养箱培养24 h。 将6 孔板置于冰上,弃上清,用PBS 缓冲液洗2 次后每孔加120 μL 裂解液裂解细胞,20 min 后将样品收集到1.5 mL EP 管中,4 ℃、12 000 r/min 离心10 min,取上清移至新的1.5 mL EP 管,分别加入40 μL 4×loading buffer 混匀,煮沸15 min,置于-20 ℃保存,用于鉴定蛋白表达情况。
将已处理好的蛋白样品进行12% SDSPAGE 电泳,电压分别为浓缩胶80 V、分离胶120 V。 电泳结束后用PVDF 膜进行转膜,110 V、70 min。 转膜完毕,用含5%脱脂奶的TBST 室温封闭2 h,然后TBST 洗膜5 min 并重复5 次。 分别用一抗稀释液稀释的兔源Myc 一抗于4 ℃下过夜孵育,TBST 洗膜5 min 并重复5 次。 用含5%脱脂奶的TBST 配制的HRP 标记的羊抗兔二抗室温孵育1 h,TBST 洗膜5 min 并重复5 次。 用WesternBright Sirius 化学发光检测试剂盒进行显色,BIO-RAD 凝胶成像仪进行曝光。
1.8 IFA 检测融合蛋白的细胞定位
用无菌镊子夹取细胞爬片置于24 孔板内,接种3D4/21 细胞,当细胞密度达到40%~50%时,利用Lipofectamine®3000 转染试剂,各孔分别转染空载体pXJ41 和pXJ41-Myc-sTRIM56(WT)、pXJ41 -Myc -sTRIM56 -ΔRING、pXJ41 -Myc -sTRIM56-ΔN、pXJ41-Myc-sTRIM56-ΔC、pXJ41-Myc-sTRIM56-ΔC-C 质粒各0.5 μg,静置培养24 h 后吸弃培养基,PBS 小心清洗2 次后,用4%多聚甲醛室温固定30~45 min 或4 ℃过夜。
固定结束后,弃掉4%多聚甲醛,用PBS 清洗10 min 并重复3 次。 加入0.1% Triton X-100 室温通透30~45 min,用PBS 清洗10 min 并重复3次。 接着室温孵育鼠源Myc 一抗2 h,用PBS 清洗10 min 并重复3 次。 室温避光孵育Alexa Fluor 488 标记的羊抗鼠IgG 二抗1 h,PBS 清洗10 min并重复3 次。 加入DAPI,室温避光作用10 ~15 min,弃掉DAPI,PBS 清洗10 min 并重复3 次。最后加入适量抗荧光衰减封闭剂进行封片,通过Leica 荧光显微镜观察各蛋白在细胞内的定位情况。
2 结果与分析
2.1 sTRIM56 全长真核表达质粒的构建及鉴定
通过RT-PCR 扩增获得Myc-sTRIM56全长基因。 扩增产物经0.8%琼脂糖凝胶电泳可见大小约为2 268 bp 的特异性扩增片段,与预期大小相符(图2)。 重组质粒pXJ41-Myc-sTRIM56(WT)经EcoRⅠ/BamHⅠ双酶切后得到预期大小的片段(图3),序列测定结果表明成功构建了pXJ41-Myc-sTRIM56(WT)表达质粒。

图2 Myc-sTRIM56(WT)全长基因的RT-PCR 扩增

图3 pXJ41-Myc-sTRIM56(WT)质粒的EcoRⅠ/BamHⅠ双酶切鉴定
2.2 sTRIM56 截短体真核表达质粒的构建及鉴定
通过PCR 扩增获得Myc-sTRIM56-ΔRING、Myc-sTRIM56 -ΔN、Myc -sTRIM56 -ΔC、Myc -sTRIM56-ΔC-C截短体基因。 扩增产物经0.8%琼脂糖凝胶电泳可见大小分别为2 028、1 638、861、630 bp 的特异性扩增片段,与预期大小相符(图4)。 截短体重组质粒经EcoRⅠ/BamHⅠ双酶切后得到预期大小的片段(图5),序列测定结果表明成功构建了pXJ41 - Myc - sTRIM56 -ΔRING、pXJ41-Myc-sTRIM56-ΔN、pXJ41-MycsTRIM56-ΔC、pXJ41-Myc-sTRIM56-ΔC-C 截短体表达质粒。

图4 sTRIM56 各截短体基因的PCR 扩增
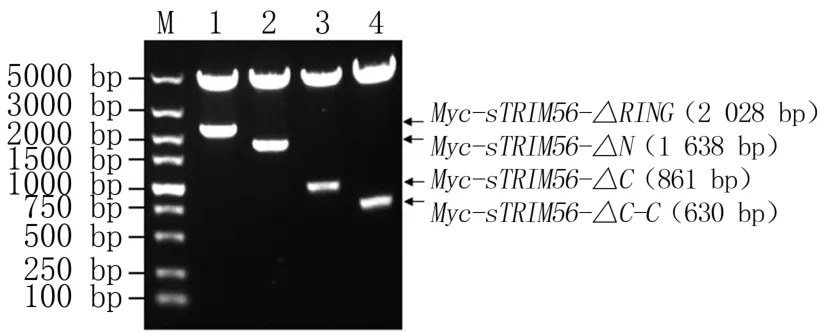
图5 sTRIM56 各截短体质粒的EcoR Ⅰ/BamH Ⅰ双酶切鉴定
2.3 sTRIM56 全长及截短体蛋白的表达
sTRIM56 全长及截短体的真核表达质粒转染HEK-293T 细胞后,提取细胞总蛋白,经Western blotting 检测,结果显示sTRIM56 全长及截短体重组质粒都能在细胞中表达,分别在约82、73、59、31、23 kDa 处出现特异性的单一蛋白条带,且条带大小与Myc-sTRIM56(WT)、Myc-sTRIM56-ΔRING、Myc-sTRIM56-ΔN、Myc-sTRIM56-ΔC、Myc-sTRIM56-ΔC-C 蛋白大小预期相符(图6);而空载体仅在约52 kDa 处出现一条非特异性条带,与其他泳道相同。 表明sTRIM56 全长及截短体蛋白都能在转染的细胞中正常表达。
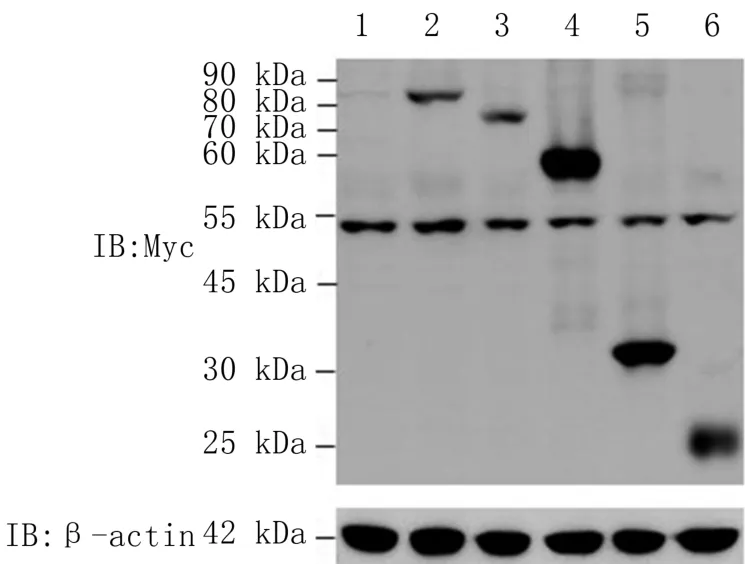
图6 Western blotting 检测sTRIM56 及其截短体质粒的蛋白表达
2.4 sTRIM56 全长及截短体在细胞中的定位
sTRIM56 全长及截短体的真核表达质粒转染3D4/21 细胞后,利用IFA 检测,荧光显微镜观察显示sTRIM56 全长Myc-sTRIM56-WT 及其不同截短体形式 Myc - sTRIM56 - ΔRING、 Myc -sTRIM56-ΔN、Myc-sTRIM56-ΔC、Myc-sTRIM56-ΔC-C 的蛋白均主要定位于细胞质中(图7)。

图7 IFA 检测融合蛋白的亚细胞定位
3 讨论与结论
近年来,研究人员已对TRIM56 蛋白的结构和功能进行了初步的研究和探索,结果表明TRIM56 在机体的许多功能中都发挥着极其重要的作用,特别是其在抗病毒免疫中的作用越来越受到研究者的重视。 最近,TRIM56 被证明是少数能够正向调节产生干扰素(IFN)的先天性免疫通路的TRIMs 之一[11]。 研究发现TRIM56 在机体先天抗病毒作用中具有多种生物学功能[12],通过与其他宿主蛋白相互作用参与TLR3 信号通路和IFN-β 信号通路[13-14]。 例如,TRIM56 不仅可以通过与干扰素激活蛋白(STING)相互作用来调节先天免疫应答,促进STING 的K63 连接泛素化,经多聚泛素化修饰靶蛋白,在机体防御病毒入侵方面发挥着重要作用[6],还可以通过诱导环状GMP-AMP 合成酶(cGAS)的Lys335 单泛素化,导致其二聚化,从而显著增加DNA 结合活性以及cGAMP(cyclic GMP-AMP)产生[15]。 除此之外,TRIM56 作为一种多功能蛋白,还可以与病毒蛋白相互作用。
随着对TRIM56 研究的不断深入,也有研究指出TRIM56 的抗病毒活性机制不依赖于TLR3/TRIF、RIG-I 或STING,而主要依赖于其E3 泛素连接酶活性和C 端区域的完整性,这表明TRIM56 是一种限制病毒感染的新型抗病毒宿主因子[11,16],有可能在抗病毒治疗方面有着巨大的潜力。 从目前的研究结果来看,TRIM56 主要针对RNA 病毒,如黄热病毒(YFV)、登革热病毒血清型2(DENV2)、牛病毒性腹泻病毒(BVDV)以及人类冠状病毒OC43(HcoV-OC43)等[16-18],其RING+超螺旋+C 末端部分序列影响YFV 的复制,RING+C 末端部分序列影响DENV2 的复制,RING 结构域+完整C 末端影响BVDV 的复制,RING 结构域影响HCoV-OC43 的复制等[11],可见TRIM56 可以通过不同结构域来抑制病毒的复制。 此外,TRIM56 对DNA 病毒如单纯疱疹病毒1 型(HSV-1)也有一定防御作用[15,19]。 尽管一些研究指出TRIM56 在肺中表达最为丰富,但关于TRIM56 对呼吸道病毒如流感病毒等负链RNA病毒的抗病毒谱及特性知之甚少[16]。
近年来虽然TRIM56 的研究主要集中于人,但对猪TRIM56 的研究也不可忽视。 目前,sTRIM56 的B-box 结构域、C-C 区域或C 末端区域的其他部分等是否在sTRIM56 的抗病毒免疫反应中发挥重要作用仍不清楚,其具体机制和功能研究尚不彻底,许多抗病毒作用也有待阐明;同时,研究已表明人TRIM56 主要定位在细胞浆中[20],但猪TRIM56 是否也定位于细胞浆中尚未明确,且sTRIM56 的具体功能与定位之间的关系还很模糊不清,需要进一步研究和探索。
本研究首先构建了sTRIM56 全长及其4 个截短体的真核表达质粒,经双酶切及测序进行了鉴定,进一步转染HEK - 293T 细胞确定了sTRIM56 全长及其截短体蛋白的表达,并在3D/421 细胞中探索了其表达的蛋白主要定位于细胞质中。 这些研究结果可为探究sTRIM56 蛋白及其不同结构域在真核细胞中的功能以及在抗病毒先天免疫反应中的作用奠定基础。
