重组人生长激素-Fc免疫融合蛋白多聚体含量尺寸排阻高效液相色谱检测方法的优化及验证
2023-10-20马陌孙瑞欣王江林刘冰莹刘景会
马陌,孙瑞欣,王江林,刘冰莹,刘景会
长春生物制品研究所有限责任公司重组蛋白研究室,吉林长春130012
生长激素(growth hormone,GH)由垂体前叶的嗜体细胞产生,在下丘脑GH 释放激素(growth hormone releasing hormone,GHRH)的正向控制和体生长抑素的负向控制下以脉冲方式分泌。对GHRH 的反应是通过GHRH 受体(GHRHR)介导的,GHRHR 是一种G 蛋白偶联受体(G-protein coupled receptor,GPCR),专门在体液营养细胞中表达。其他因素,如胰岛素样生长因子1(insulin-like growth factor 1,IGF1)、神经肽Y 和高血糖会抑制GH 的分泌,而低血糖、甲状腺素、胃泌素和糖皮质激素会刺激GH 的分泌[1-2],其中IGF1 对支持生长和调节新陈代谢非常重要[3],目前已有多项文献报道了GH与IGF1的关系[4-6]。
20世纪上半叶,临床观察、解剖学和生物化学研究为人们了解GH 的结构及其在动物体内的各种代谢作用奠定了基础[7]。在成人中,GH 缺乏症与内脏脂肪增加、瘦体质量、骨密度和运动能力下降、血脂异常、胰岛素抵抗、心脏代谢和骨折风险增加以及生活质量降低有关[8]。近年来也有报道GH 还影响许多导致纤维化的因素,包括与纤维化有关的多种蛋白和通路,如转化生长因子-β(transforming growth factor-β,TGF-β)通路,一般来说,纤维化也往往与炎症密切相关[9-10]。除了上述疾病外,对于心血管疾病,如动脉粥样硬化,用GH进行治疗有助于使身体成分正常化,降低舒张压、总胆固醇和低密度脂蛋白[11-12]。
1985 年,美国食品药品监督管理局批准将GH作为生长激素缺乏症(growth hormone deficiency,GHD)的特效疗法[13]。重组人生长激素(recombinant human growth hormone,rhGH)主要用于治疗儿童及成人身材矮小,发育迟缓等病症。目前,大多数rhGH 制剂均通过每日皮下注射给药,停止治疗的比例很高。治疗依从性差与治疗反应不理想、线性生长降低和无法达到遗传身高潜能值有关[14]。不依从性会随着时间的推移而增加,是长期治疗的一个重要问题[15-16]。考虑到患者对每日GH治疗的抗拒,长效疗法成为较有效的解决方法[17-18]。最近进行的一项离散选择实验表明,患者更愿意选择注射次数较少的方案来治疗GHD[19]。此外,其他适应证的数据也表明,患者更青睐长效疗法,如治疗血友病的长效疗法[20-21]。
rhGH-Fc 免疫融合蛋白是将rhGH基因与特异位点突变后的人抗体IgG4 Fc 段用柔性linker 连接,利用CHO-k1 细胞进行表达。CHO 细胞表达产物糖基化程度高,在细胞培养和纯化工艺流程中易于聚集产生多聚体。多聚体具备免疫原性,可能会导致过敏反应如头痛、发热、发冷等,因此,抗体蛋白质中多聚体的检测十分重要。尺寸排阻色谱(size exclusion chromatography,SEC)是目前较为常用的单克隆抗体类生物治疗药物纯度检测方法,其原理是根据蛋白分子尺寸差异进行分离。理想条件下蛋白分子不与惰性填料发生作用,但由于实验条件的客观因素会导致蛋白与色谱柱填料之间产生非特异性结合,因此需对检测条件进行优化。本实验旨在优化SECHPLC 法检测rhGH-Fc 免疫融合蛋白多聚体含量的条件,并对优化的方法进行验证,以期为rhGH-Fc 免疫融合蛋白后续临床研究等的安全性、有效性和质量可控性提供可靠的检测方法。
1 材料与方法
1.1标准品及供试品 rhGH-Fc 免疫融合蛋白标准品(批号:SCJFCGH202102)和原液(批号:S20210408)由本公司重组蛋白研究室提供;GH 国家标准品(编号:140635)和蛋白质标准品购自中国食品药品检定研究院;rhGH-Fc免疫融合蛋白对照品由本公司重组蛋白研究室留样保存。
1.2主要试剂及仪器 磷酸氢二钠和磷酸二氢钠(均为分析纯)购自湖南九典制药有限公司;氯化钠(分析纯)购自江西勤奋药业有限公司;HPLC 系统PerkinElmer Flexar 型高效液相色谱仪购自美国PerkinElmer 公司(包括UV/VIS 检测器、自动进样器、往复式柱塞泵、TCNav 色谱工作站、柱温箱);色谱柱TSKgel G3000SWxl(10µm,7.8 mm×300 mm)和TSKgel G2000SWxl(5µm,7.8 mm×300 mm)购自日本TOSOH公司。
1.3标准品溶液的配制 取GH 标准品1 支(蛋白含量为1 mg),精密加入注射用水1 mL 溶解,制成浓度为1.0 mg/mL的标准品溶液。
1.4检测条件的优化
1.4.1盐离子强度 选择NaCl浓度分别为0.1、0.2、0.3 mol/L的3种流动相,按如下色谱条件进样检测:50 mmol/L磷酸盐缓冲液(pH 7.20),检测波长280 nm,进样量100µL,流速1.0 mL/min,柱温室温。比较流动相的盐离子强度对样品中聚合物分离效果的影响。
1.4.2pH 选择pH分别为6.6、6.8、7.0的3种流动相,按如下色谱条件进样检测:50 mmol/L 磷酸盐缓冲液,检测波长280 nm,进样量100µL,流速1.0 mL/min,柱温室温。比较流动相的pH 对样品中聚合物分离效果的影响。
1.4.3柱温分别设定柱温在室温(25)、35 与45 ℃条件下,按如下色谱条件进样检测:50 mmol/L磷酸盐缓冲液(pH 7.20),检测波长280 nm,进样量100µL,流速1.0 mL/min。比较柱温对样品中聚合物分离度效果的影响。
1.4.4流速 分别设定流速为1.0、0.8、0.6 mL/min,按如下色谱条件进样检测:50 mmol/L 磷酸盐缓冲液(pH 7.20),检测波长280 nm,进样量100µL,柱温室温。比较流速对样品中聚合物分离度的影响。
1.4.5色谱柱 根据rhGH-Fc 免疫融合蛋白相对分子质量(97 370),选择适宜排阻界限的TSKgel G3000SWxl和TSKgel G2000SWxl两种色谱柱,按如下色谱条件进样检测:50 mmol/L 磷酸盐缓冲液(pH 7.20),检测波长280 nm,进样量100 µL,流速1.0 mL/min,柱温室温。比较两种色谱柱的理论塔板数。
1.5方法的验证
1.5.1系统适应性 取rhGH-Fc 免疫融合蛋白对照品进样检测。流动相为50 mmol/L 磷酸盐缓冲溶液-0.3 mol/L NaCl(pH 6.8),分别以原色谱条件(检测波长280 nm,上样量100 µL,柱温室温,流速1.0 mL/min,色谱柱TSKgel G3000SWxl)与优化后色谱条件进行检测,各重复进样3次。
1.5.2专属性 取rhGH-Fc 免疫融合蛋白对照品、GH国家标准品、rhGH-Fc免疫融合蛋白样品及蛋白缓冲液(50 mmol/L 磷酸盐缓冲溶液)各100µL,按照优化的色谱条件进样检测,记录出峰时间及峰面积。
1.5.3线性与范围 取rhGH-Fc免疫融合蛋白样品,经Lowry 法测定蛋白浓度约为3.07 mg/mL,用注射用水稀释,配制成以下6个浓度:0.307、0.614、0.860、1.228、1.596、1.842 mg/mL,精密量取100 µL,按照优化的色谱条件进样检测。以供试品溶液浓度为横坐标,色谱峰面积为纵坐标绘制曲线,得到回归方程并计算绝对系数(R2)。
1.5.4重复性 取6 份浓度为1.0 mg/mL 的rhGHFc 免疫融合蛋白样品,精密量取100 µL,按照优化的色谱条件进样检测。计算6 次检测样品峰面积的平均值及RSD。
1.5.5中间精密性 取rhGH-Fc 免疫融合蛋白样品(1.0 mg/mL),由两名操作人员(A 与B)分别于3 个不同日期及2 台不同HPLC 仪器,按照优化的色谱条件进样检测。计算峰面积的平均值及RSD。
1.5.6准确性 取9份rhGH-Fc免疫融合蛋白溶液,分别与GH标准品溶液按体积比1∶0.8、1∶1.0、1∶1.2混合,制成高、中、低3种浓度待测溶液各3份,按照优化的色谱条件进样检测,并计算回收率及RSD。取GH标准品溶液1 份,按照优化的色谱条件进样分析,记录峰面积,利用外标法计算GH标准品加入量实测值。
1.5.7定量限 取rhGH-Fc 免疫融合蛋白对照品溶液,加注射用水稀释成0.05 mg/mL,按照优化的色谱条件进样检测。根据检测结果逐步调整溶液浓度,直至信噪比S/N为1∶10时,测得定量限。
1.6数据采集及分析 所有图谱均由Total Chrom(6.3.20676)工作站处理所得。
2 结果
2.1检测条件的优化
2.1.1盐离子强度对聚合物分离效果的影响 随着NaCl浓度的升高,理论塔板数与分离度随之升高,见表1。因此选择0.3 mol/L为最佳盐浓度。
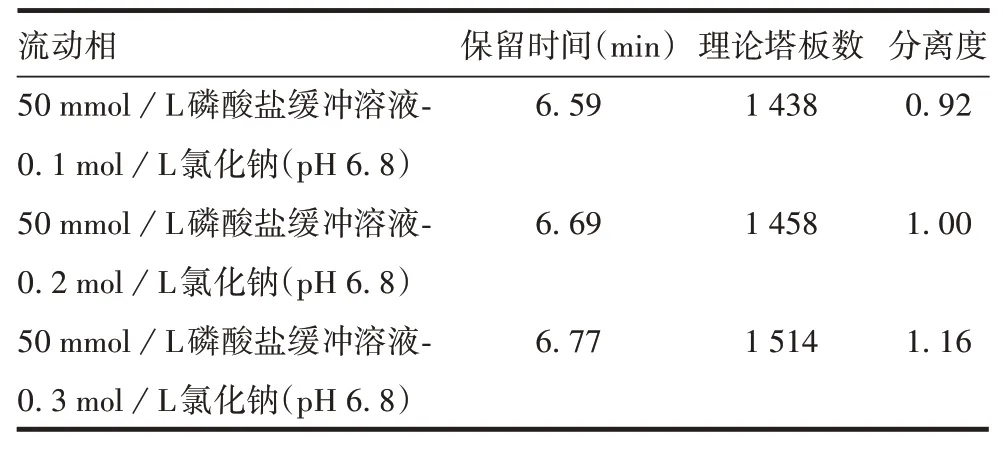
表1 不同盐离子强度下聚合物的分离效果Tab.1 Separation effect of polymer under different salt ion strength
2.1.2pH对聚合物分离效果的影响 3种pH值流动相对分离度与拖尾因子无明显影响,随着pH 的升高,保留时间略降低;在pH 为6.8 条件下,理论塔板数高于pH 6.6 和7.0。见图1 和表2。综合考虑选择6.8为流动相最佳pH。
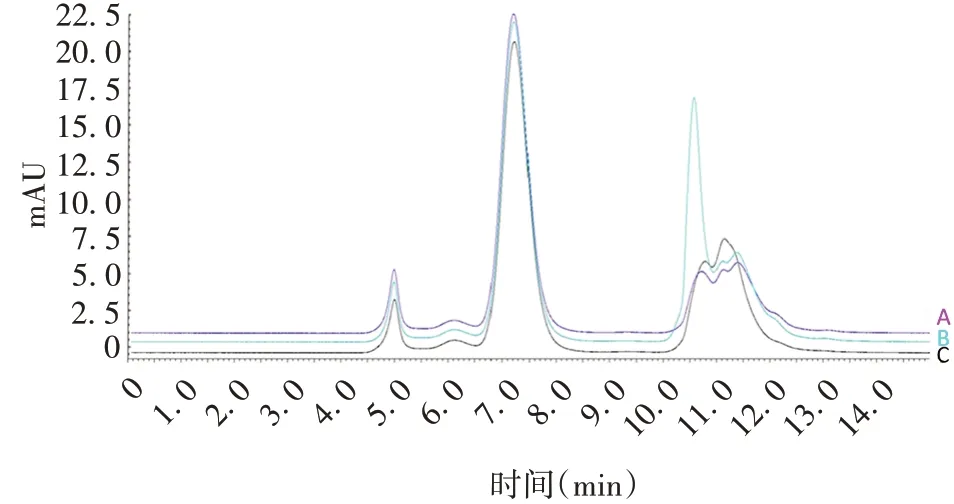
图1 流动相pH对聚合物分离效果的影响Fig.1 Effect of mobile phase pH on polymer separation effect

表2 不同流动相pH下聚合物的分离效果Tab.2 Separation effect of polymer under different mobile phase pH
2.1.3柱温对聚合物分离效果的影响 升高柱温会使理论塔板数与分离度增高,见表3。因此选择45 ℃为最佳柱温。
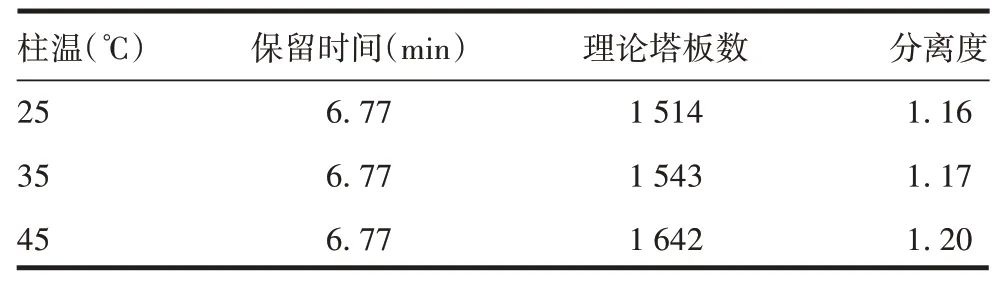
表3 不同柱温下聚合物的分离效果Tab.3 Separation effect of polymer under different column temperature
2.1.4流速对聚合物分离效果的影响 降低流速会使理论塔板数与分离度增高,见表4。因此选择0.6 mL/min为最佳流速。
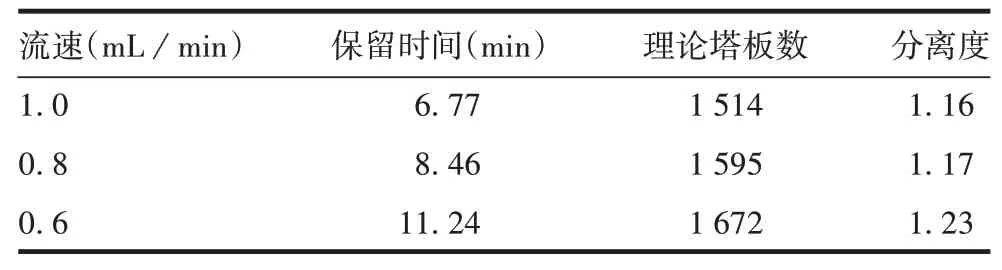
表4 不同流速下聚合物的分离效果Tab.4 Separation effect of polymer under different flow rate
2.1.5色谱柱对理论塔板数的影响 TSKgel G2000-SWxl比TSKgel G3000SWxl保留时间更短,柱效更高,且填料孔径更小,分离效果优于TSKgel G3000SWxl色谱柱。见表5。
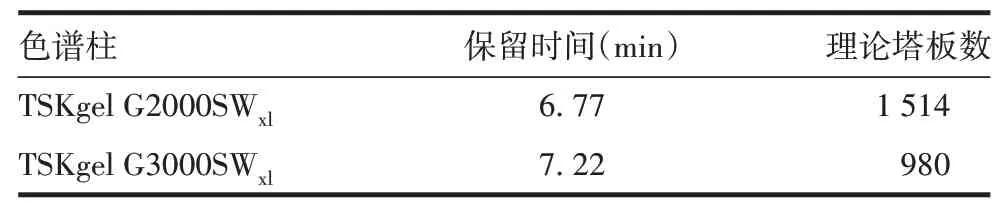
表5 不同色谱柱分离聚合物的效果Tab.5 Separation effect of polymer using different columns
最终确定检测方法为采用TSK-gel G2000SWxl色谱柱(5 µm,7.8 mm × 300 mm)进行测定,流动相为50 mmol/L 磷酸盐缓冲液(pH 6.80),检测波长为280 nm,进样量为100 µL,流速为0.6 mL/min,柱温为45 ℃。
2.2方法的验证
2.2.1系统适应性 rhGH-Fc免疫融合蛋白与聚合物分离度、理论塔板数、拖尾因子均能满足要求,见表6。
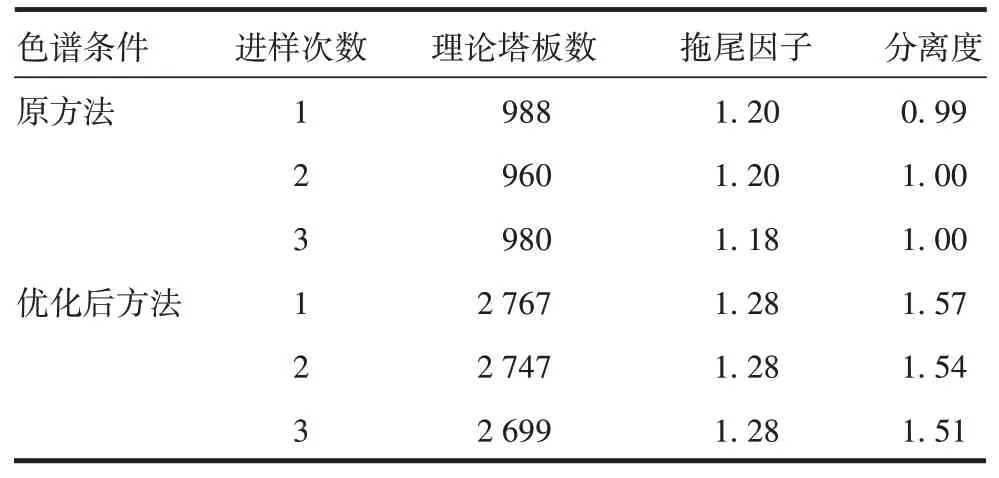
表6 系统适应性验证结果Tab.6 System adaptation verification
2.2.2专属性 rhGH-Fc 免疫融合蛋白样品与对照品出峰时间一致,GH 国家标准品与对照品出峰时间不同,蛋白缓冲液不出峰,见图2。表明该方法专属性良好。
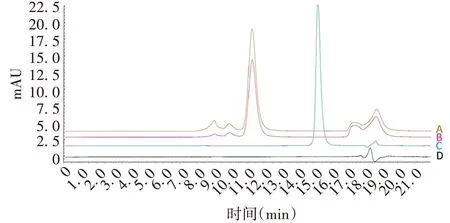
图2 专属性验证结果Fig.2 Verification for specificity
2.2.3线性与范围 回归方程为y=7 E+06x-98 891,R2为0.999 4,在可接受范围之内,表明蛋白浓度在0.307 ~1.842 mg/mL 范围内,主峰面积与上样量之间呈良好的线性关系。见图3。

图3 线性测定结果Fig.3 Linearity measurement results
2.2.4重复性 6 次测得样品峰面积的平均值为4 858 621.83,RSD为0.7%;纯度平均值为89.74,RSD为0.1%。见表7。表明该方法重复性良好。

表7 重复性验证结果Tab.7 Verification for repeatability
2.2.5中间精密性 6 次进样峰面积的平均值为4 997 402.80,RSD为0.8%,见表8。表明该方法中间精密性良好。
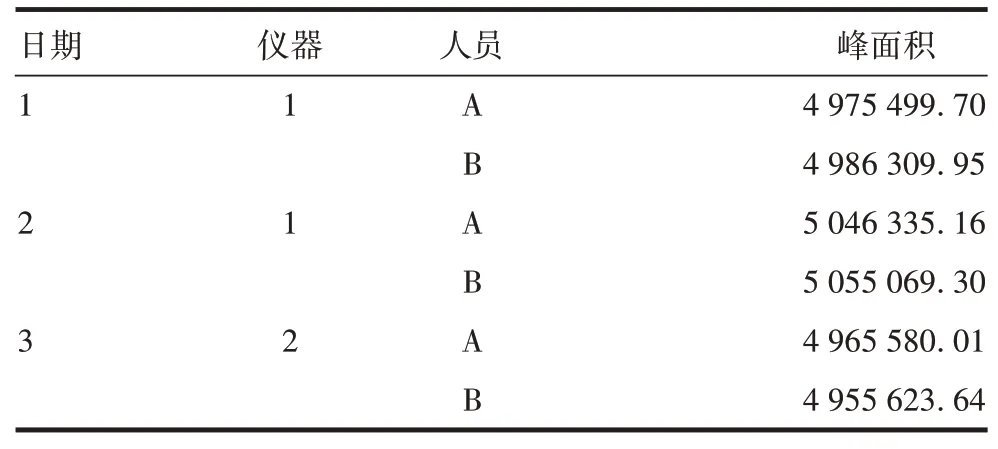
表8 中间精密性验证结果Tab.8 Verification for intermediate precision
2.2.6准确性 经计算,GH标准品平均回收率为99.1%,RSD为1.9%,见表9。表明该方法准确性较高。
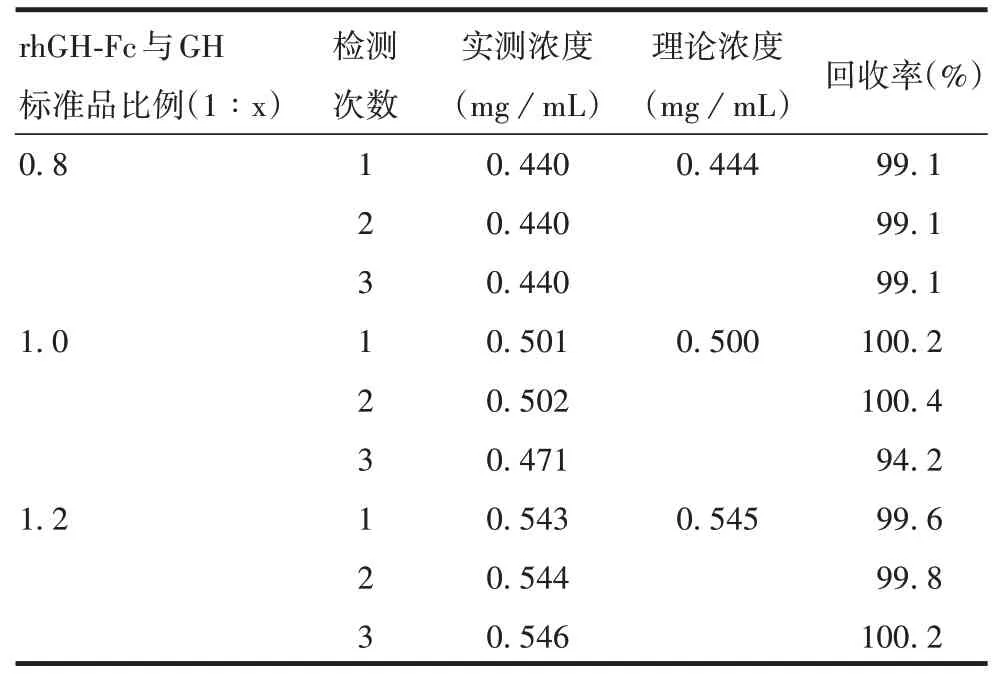
表9 准确性验证结果Tab.9 Verification for accuracy
2.2.7定量限 检测结果显示,该方法的定量限为6µg/mL。
3 讨论
HPLC 方法的优化是一个复杂的过程,需同时控制多个变量(流动相pH 值、缓冲液浓度、流速、色谱柱温度、检测器波长等)才能达到理想的分离效果[22-23]。SEC 法主要根据样品组分分子大小进行分离,但由于介质的生产工艺制约,基质不会完全表现为惰性。其表面存在少量的疏水性部位和带负电荷的离子性部位,增加盐离子强度可弱化其对分离效果的影响,但过高的盐浓度会增强蛋白与基质的疏水作用,也会对色谱系统产生腐蚀作用。rhGH-Fc免疫融合蛋白的等电点在5.2 ~5.3,流动相pH升高使蛋白表面净电荷增加,与填料表面所带的少量负电荷离子部位发生排斥作用从而缩短保留时间。但可能由于流动相中含有0.3 mol/L NaCl,削弱了排斥作用使得变化并不明显。有报道也称,在pH 7.4 的高温磷酸盐缓冲液中,蛋白容易脱酰胺化,在开发方法时对于pH 的摸索也需注意[24]。升高温度可明显提高分离效果,有资料分析原因可能为温度升高,水的黏度与介电常数减小,极性随之减小,改变了流动相的极性,对弱极性物质洗脱效果增强[25]。在经典塔板理论假设中,忽略了流动相流速对溶质分配的影响;但在色谱滑移机理假设中,流体动力学因素影响了溶质马丁-辛格分配,在一定范围内,理论塔板数随流速的减小而增加。本实验结果也反映了这一理论。在预实验中,继续减小流速,理论塔板数与分离度仍会继续增加,但相应的检测时间也会延长。综合上述原因,最终选择流动相为50 mmol/L 磷酸盐缓冲溶液-0.3 mol/L 氯化钠(pH 6.8);色谱条件为:柱温45 ℃,流速0.6 mL/min,检测波长280 nm,上样量100 µL;色谱柱为TSKgel G2000SWxl为最终检测条件。
本实验对建立的方法进行了验证,结果表明,该方法具有良好的稳定性以及精密度。在准确性验证中,用GH 国家标准品代替rhGH-Fc 免疫融合蛋白进行加标回收率试验,虽然两者相对分子质量不同,但其本质均为蛋白质,色谱行为相似,且在280 nm 处均有吸收峰。该方法检测的蛋白图谱良好,主峰无杂质峰干扰,各项指标均符合要求,可满足rhGH-Fc对检测的需求。
综上所述,利用SEC-HPLC 进行蛋白含量检测比Lowry法更加灵敏高效,可缩短检测时间。本研究建立的rhGH-Fc免疫融合蛋白多聚体含量SEC-HPLC检测方法系统适用性、专属性、精密性良好,准确性较高,有利于为纯化工艺提供数据支持,以便摸索更为优化的纯化条件。
