sIPV疫苗D抗原含量双抗体夹心ELISA检测方法的建立及验证
2023-10-20徐康维朱文慧宋彦丽英志芳王剑锋权娅茹李长贵
徐康维,朱文慧,宋彦丽,英志芳,王剑锋,权娅茹,李长贵
1.中国食品药品检定研究院国家卫生健康委员会生物技术产品检定方法及其标准化重点实验室国家药品监督管理局生物制品质量研究与评价重点实验室,北 102629;2.北京市药品检验研究院病毒疫苗室,北京102206
脊髓灰质炎(简称脊灰)是一种具有高度传染性的疾病,严重威胁儿童健康。随着脊灰疫苗的广泛接种,全球脊灰发病数显著下降但仍未完全消除[1]。目前,全球仅阿富汗和巴基斯坦2 个国家存在野生脊灰病毒流行,被列为脊灰流行国家,而由疫苗衍生脊灰病毒(vaccine derived polioviruses,VDPVs)尤其是Ⅱ型VDPVs 引起的疫情时有发生。2018 年,通过环境监测在新疆维吾尔自治区发现了1株Ⅱ型VDPVs,2019年在四川省发现了1例由Ⅱ型VDPVs引起的急性弛缓性麻痹[2]。因为口服脊灰病毒疫苗(oral poliovirus vaccine,OPV)所含的减毒株病毒在极少数情况下可能会发生变异,恢复神经毒力,并像野生脊灰病毒一样循环生存引起VDPVs。因此,《2019 —2023 年脊灰消除战略》呼吁停用所有含活脊灰病毒的疫苗,如OPV[3-4]。由于生物安全方面的考虑,WHO 推荐新企业采用减毒Sabin 株脊灰病毒用于灭活疫苗的研发生产[5-6]。我国已有3 家企业生产Sabin 株脊灰病毒灭活疫苗(Sabin strain inactivated poliovirus vaccine,sIPV)并获得上市应用,具有较好的安全性和免疫原性[7-9],还有多家企业正在进行该疫苗的研发[10-14]。
sIPV 疫苗的有效成分为D 抗原,各企业均采用自建方法进行定量。中国食品药品检定研究院(简称中检院)建立了sIPV 疫苗国家标准品[15],但目前尚无统一的D 抗原含量检测方法。本研究旨在建立检测sIPV 疫苗D 抗原含量的牛多抗对兔多抗夹心ELISA方法,并进行验证。
1 材料与方法
1.1标准品及疫苗 sIPV 疫苗国家标准品(2016 国生标字0034)由中检院呼吸道病毒疫苗室制备并保存[15];Ⅰ、Ⅱ、Ⅲ型sIPV 疫苗原液为中国医学科学院医学生物学研究所制备;sIPV 疫苗样品由中国5 家生产及研发企业提供。
1.2实验动物 清洁级新西兰白兔,雄性,体质量约2.5 kg,9 只,由中检院提供。动物生产许可证号:SCXK(京)2019-0017,实验动物使用许可证号:SYXK(京)-2017-0013。本实验均以科研为目的进行实验动物的养殖和使用,且按照中检院《实验动物福利伦理审查指导原则》等相关规定进行。
1.3主要试剂及仪器 sIPV 疫苗牛多抗由中检院呼吸道病毒疫苗室制备并保存[16];HRP-羊抗兔IgG 购自荷兰Nordic-MUbio 公司;弗氏完全佐剂/不完全佐剂购自美国Sigma公司;PBS粉末(pH 7.2)购自北京中衫金桥生物技术有限公司;吐温20 购自国药集团化学试剂有限公司;Protein G 纯化树脂和AKTA Pure 纯化仪购自美国GE 公司;96 孔细胞培养板(货号:3599)和96孔酶标板(货号:3590)购自美国Corning公司;SpectraMaxi3x 酶标仪和Aqua Max4000 洗板机购自美国Molecular Devices公司。
1.4兔源多抗制备 将Ⅰ、Ⅱ、Ⅲ型sIPV疫苗原液分别使用PBS 稀释至蛋白含量200µg/mL,加入等体积弗氏完全佐剂进行乳化,经兔皮下多点注射进行初次免疫,0.5 mL/只,每型别免疫3只,共9只。2周后进行加强免疫,将原液稀释至蛋白含量100µg/mL,加入等体积弗氏不完全佐剂进行乳化,经兔皮下多点注射,0.5 mL/只,每2周加强免疫1次,共3次;第4次免疫后2周经兔动脉采血,分离血清,得到兔源多抗。
1.5兔多抗效价及型别特异性检测 采用间接ELISA法。将Ⅰ、Ⅱ、Ⅲ型sIPV 疫苗原液用PBS(pH 7.2)稀释至蛋白含量0.5 µg/mL,加至96 孔酶标板,100 µL/孔,4 ℃过夜;PBS-T(含0.25‰吐温20 的PBS)洗液洗板5 次,加入2%脱脂奶粉(PBS 溶解),200µL/孔,室温封闭1 h;加入各型兔多抗(封闭液初始1∶2 000稀释后,再进行3倍系列稀释),100µL/孔,室温放置1 h;洗板5 次,加入HRP-羊抗兔IgG 抗体(封闭液1∶5 000 稀释),室温孵育1 h;洗板5 次,加入TMB 显色液,100 µL/孔,室温放置15 min;加入0.5 mol/L 硫酸,50 µL/孔,终止反应,读取A450/630值。以A值>2对应的稀释倍数作为抗体效价。
1.6牛多抗对兔多抗夹心ELISA方法的建立 用碳酸盐(pH 9.5)包被液对牛多抗进行1∶10 000 稀释后,加至96 孔酶标板,100 µL/孔,4 ℃放置12 ~20 h;洗板5 次,加入封闭液,200 µL/孔,室温封闭1 h;将sIPV 疫苗标准品及样品进行系列稀释至(0.25 ~8.00)DU/mL后,加至酶标板,100µL/孔,室温放置2 h;洗板5次,加入兔多抗(用封闭液,Ⅰ型1∶100 000稀释,Ⅱ型1∶100 000 稀释,Ⅲ型1∶15 000 稀释),100µL/孔,室温孵育1 h;洗板5 次,加入HRP-羊抗兔IgG(封闭液1∶5 000 稀释),100µL/孔,室温孵育1 h;洗板5次,加入TMB显色液,100µL/孔,室温放置15 min;加入0.5 mol/L 硫酸,50µL/孔,终止反应,读取A450/630值。将标准品抗原含量和对应A值进行四参数曲线拟合,计算样品抗原含量。
1.7方法验证
1.7.1准确度 将标准品3 个型别D 抗原含量分别稀释至4.0 DU/mL 后,再进行2 倍系列稀释至4.0、2.0、1.0、0.5 DU/mL,进行检测。样品同样根据各型别D 抗原含量稀释至4.0、2.0、1.0、0.5 DU/mL。将稀释后的标准品与样品按照1∶1 混合后进行检测。试验重复6次。按下式计算回收率。
回收率(%)=(2×混合样抗原含量-样品抗原含量)/标准品理论浓度值×100%
1.7.2精密度 将样品按照3 个型别D 抗原含量分别稀释至高、中、低3 个浓度,抗原含量约4.0、2.0、1.0 DU/mL。同一试验内每个浓度进行3个平行样品检测,计算同浓度下3 个检测结果及不同浓度下9 个检测结果间的CV值,评价重复性。同批次样品不同日期试验检测6 次,计算CV值,评价中间精密度。
1.7.3D 抗原专属性 将sIPV 疫苗样品56 ℃水浴加热15 min、30 min、1 h、2 h,使D 抗原变为C 抗原,检测样品加热前后抗原含量并计算变化百分比,以评价D抗原专属性。
1.8方法初步应用 采用建立的方法检测国内5 家企业(每个企业2 批)sIPV 疫苗样品,重复3 次检测,以评价方法对不同厂家sIPV疫苗产品的适用性。
1.9数据采集及分析 使用GraphPad Prism 8和Excel 2010软件绘图并进行数据分析。
2 结果
2.1兔多抗效价及型别特异性 Ⅰ型兔多抗对Ⅰ型原液的ELISA 效价为162 000;Ⅱ型兔多抗对Ⅱ型原液的ELISA 效价为162 000;Ⅲ型兔多抗对Ⅲ型原液的ELISA 效价为54 000,而3个兔多抗对非对应型别原液的ELISA 效价均小于2 000,具有良好的型别特异性。见图1。
2.2牛多抗对兔多抗夹心ELISA方法的建立 3个型别的标准曲线在D 抗原含量(0.25 ~8.00)DU/mL 范围内,均具有良好的线性,R2均>0.99。见图2。
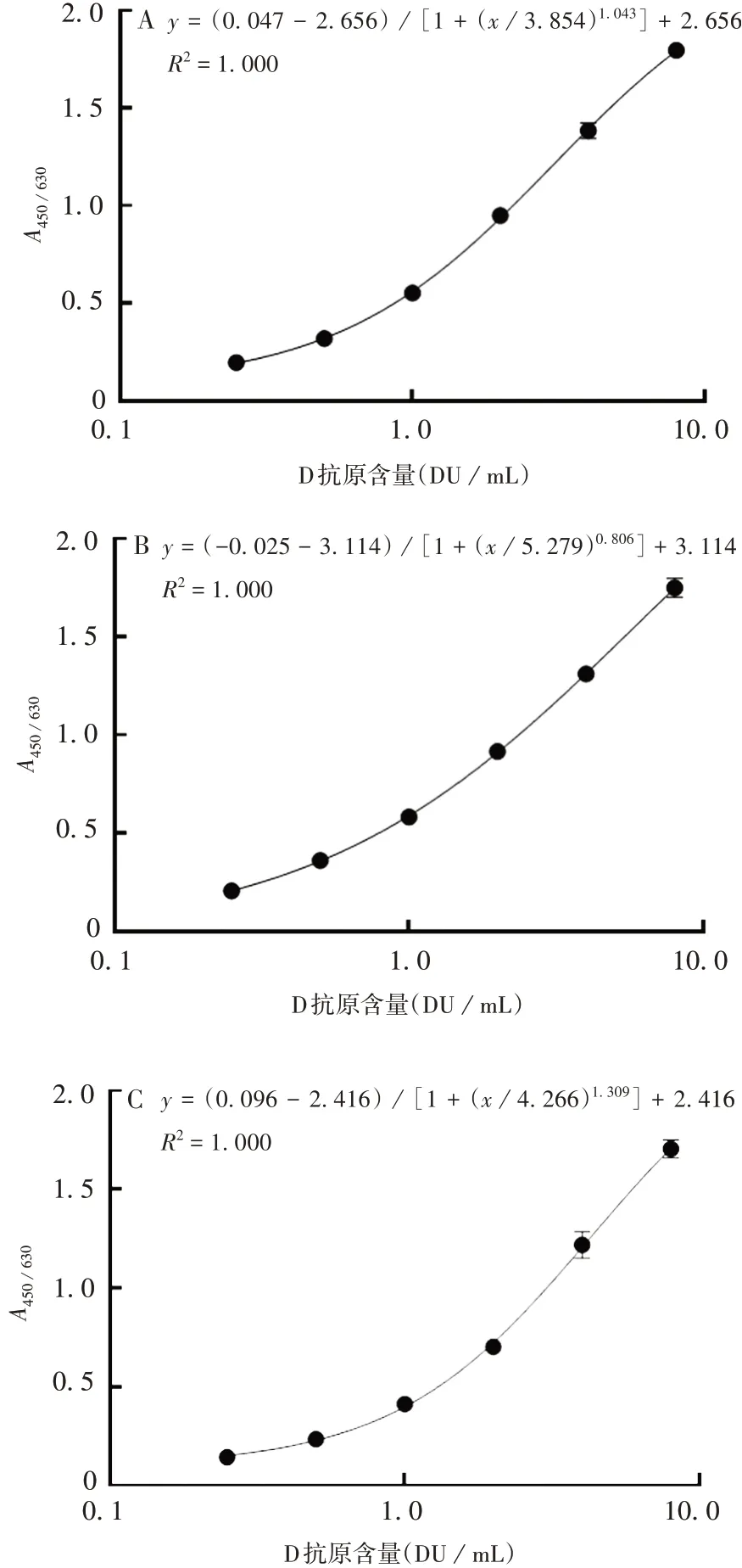
图2 Ⅰ(A)、Ⅱ(B)、Ⅲ型(C)抗原检测标准曲线Fig.2 Standard curves for antigen detection of type Ⅰ(A),Ⅱ(B)and Ⅲ(C)
2.3方法的验证
2.3.1准确度 Ⅰ型各次试验回收率为84.40% ~107.50%,D 抗原浓度为4.0、2.0、1.0、0.5 DU/mL时回收率平均为97.31%、100.00%、95.85%、99.27%,各浓度平均回收率为98.11%。Ⅱ型各次试验回收率为85.40%~111.80%,D抗原浓度为4.0、2.0、1.0、0.5DU/mL时回收率平均为95.48%、96.68%、100.32%、97.17%,各浓度平均回收率为97.41%。Ⅲ型各次试验回收率为87.30%~110.60%,D抗原浓度为4.0、2.0、1.0、0.5 DU/mL时回收率平均为97.84%、97.61%、97.83%、101.37%,各浓度平均回收率为98.66%。见表1。
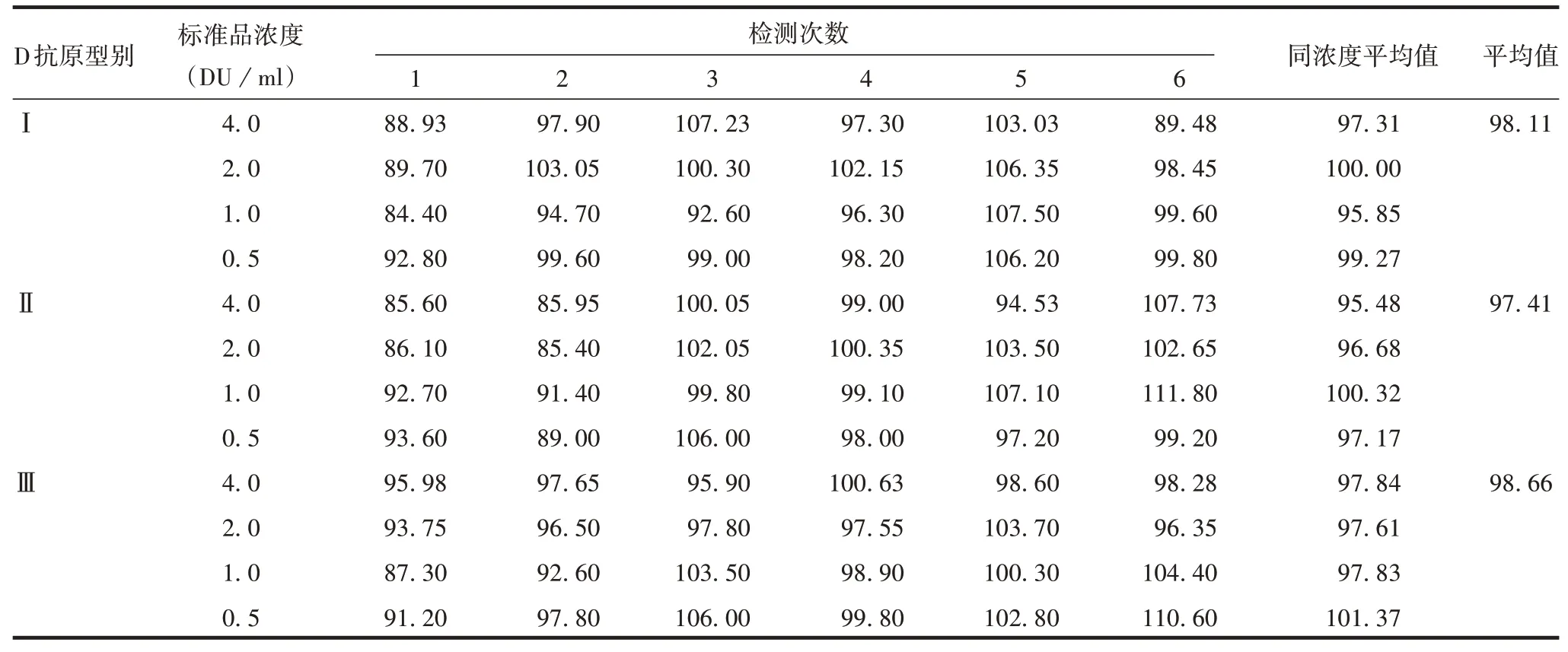
表1 准确度验证(%)Tab.1 Verification for accuracy(%)
2.3.2精密度 重复性验证结果显示,Ⅰ、Ⅱ、Ⅲ型抗原在高、中、低浓度下检测结果的CV均<10%,Ⅰ、Ⅱ、Ⅲ型平均CV分别为5.98%、1.72%、2.46%,均<10%,见表2。中间精密度验证结果显示,Ⅰ、Ⅱ、Ⅲ型CV分别为5.73%、5.37%、4.93%,均<10%,见表3。表明方法精密度良好。
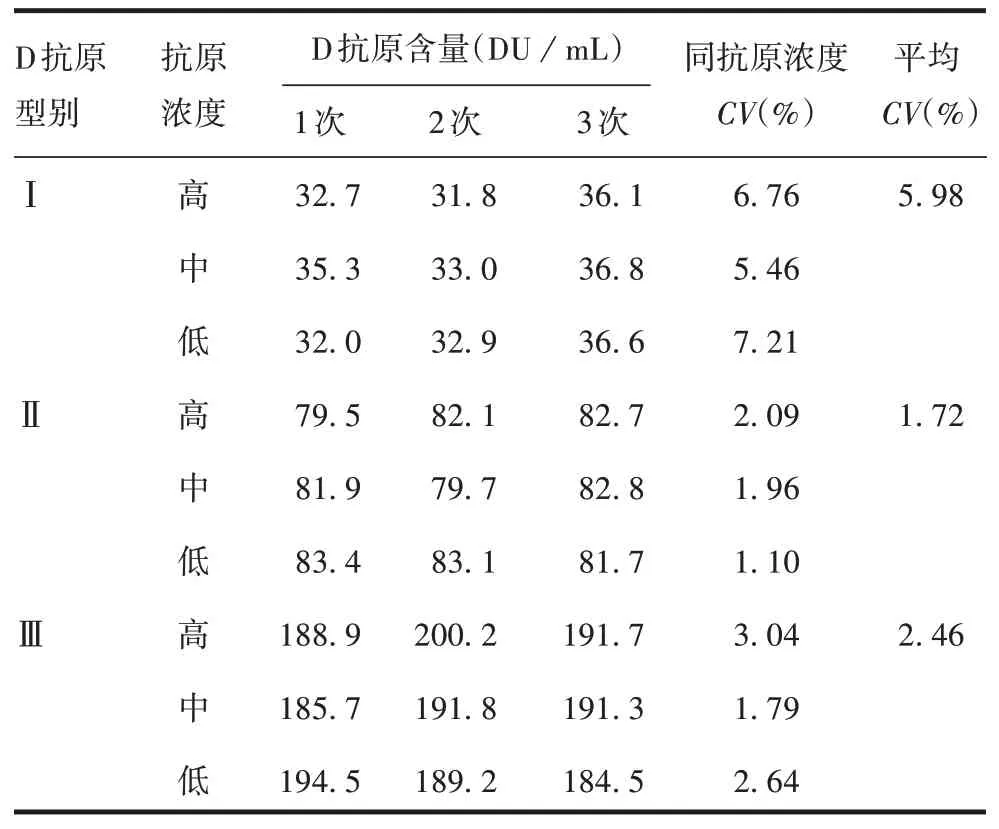
表2 重复性验证Tab.2 Verification for repeatability
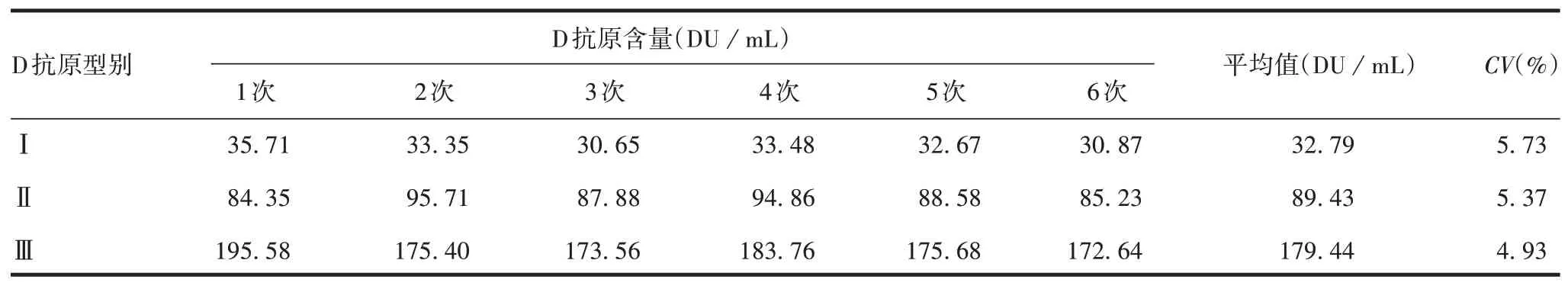
表3 中间精密度验证Tab.3 Verification for intermediate precision
2.3.3专属性 对于3个型别的D/C 抗原均能够有效区分,与Ⅰ、Ⅱ、Ⅲ型C 抗原的交叉反应率分别约为10%、40%和20%,Ⅰ、Ⅲ型D/C 抗原特异性较好,而Ⅱ型交叉反应略强,见表4。
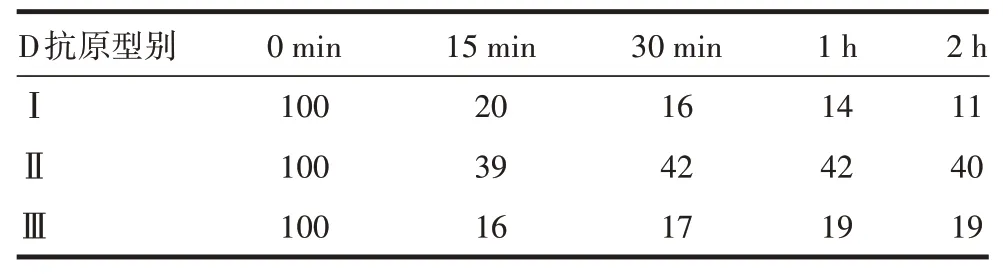
表4 方法的专属性验证(%)Tab.4 Verification for specificity of method(%)
2.4方法的初步应用 同批次样品3 次检测结果标准差远小于均值,不同试验间结果较为一致,见表5。表明建立的方法对5 家企业生产的sIPV 疫苗均能够进行D抗原定量检测。
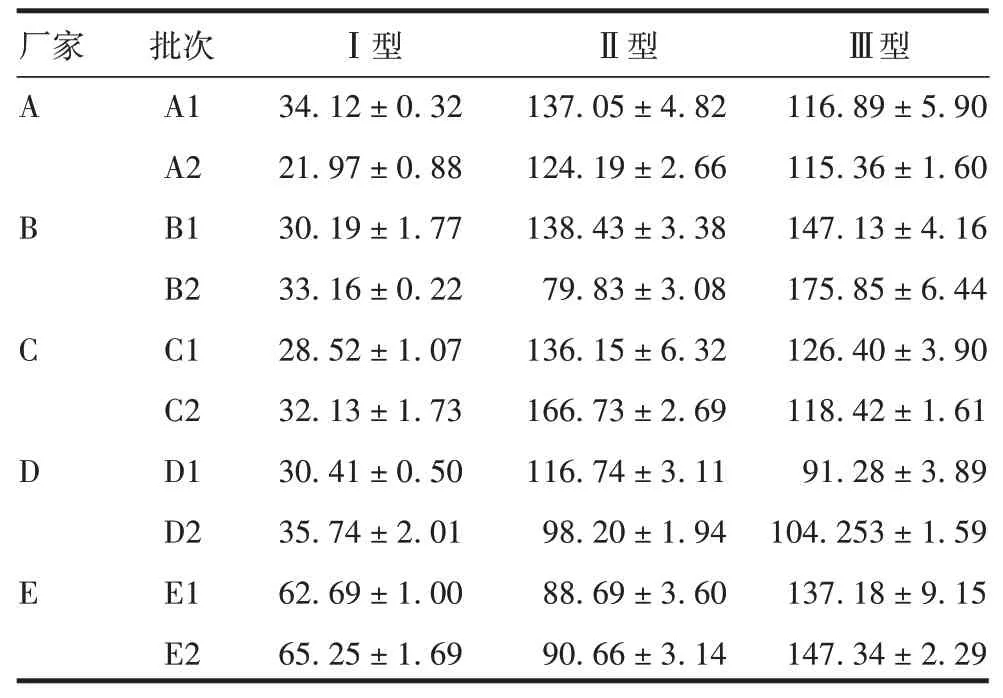
表5 不同企业sIPV疫苗D抗原含量(DU/mL,x±s,n=3)Tab.5 Dantigen contents in sIPV vaccines from different enterprises(DU/mL,x±s,n=3)
3 讨论
脊灰病毒在复制过程中可产生2 种病毒颗粒,包含核酸具有感染性的完整病毒颗粒称为D 抗原,免疫引起的抗体能够中和病毒,具有保护作用。不含核酸的空心病毒颗粒不具有感染性,不能激发保护性免疫反应,称为C 抗原。D 抗原是sIPV 疫苗的主要有效成分,目前各生产研发企业均使用ELISA方法进行定量,使用的抗体包括单抗、多抗或者两种抗体结合[15-17]。使用单抗建立的检测方法对D 抗原有较好的特异性[16-17]。但由于脊灰病毒至少有4 个保护性抗原表位[18],对于特定抗原表位对脊灰病毒的保护作用目前尚不完全了解,sIPV 疫苗的总体保护效果可能是不同表位组合的结果。因此,仅检测1个抗原表位可能不能够准确反映样品的整体效力,因为抗原成分的组成可能受到灭活、纯化等生产制造条件的影响。该问题可通过使用针对不同表位单克隆抗体的混合物来克服,但会使方法更加复杂化和难以标准化。因此,本研究采用针对Sabin 株脊灰全病毒的牛多抗和兔多抗建立了sIPV疫苗D抗原含量检测方法。
采用Ⅰ、Ⅱ、Ⅲ型sIPV 疫苗原液免疫兔制备兔多抗,3 个型别的兔多抗与对应型别的疫苗原液的ELISA效价均较高,且对其他型别原液的ELISA效价均较低,均具有较好的型别特异性。采用牛多抗作为包被抗体[16]、兔多抗作为显示抗体建立夹心ELISA方法,该方法在D抗原含量(0.25 ~8.00)DU/mL范围内,采用4参数曲线拟合具有良好的线性。方法验证结果显示,3 个型别的抗原加标回收率均为80% ~120%;重复性和中间精密度CV均<10%,准确性和精密度良好。本方法对D/C 抗原也能够进行区分,与Ⅰ、Ⅱ、Ⅲ型C 抗原的交叉反应率分别约为10%、40%和20%。Ⅰ、Ⅲ型D/C抗原特异性较好,而Ⅱ型交叉反应略强,后续需改进免疫方案,进一步增强Ⅱ型兔多抗的特异性。采用建立的方法对国内5 家企业的sIPV 疫苗进行D 抗原定量,同批次疫苗3 次检测结果较为一致,表明方法具有良好的适用性。同时也发现,同一企业不同批次样品以及不同企业来源样品间D 抗原含量具有较大差异,这可能由样品配制剂量或检验方法不同导致的。因此,需要探讨不同方法对检测结果的影响,为统一sIPV 疫苗D 抗原定量的方法提供条件。
