重组抗SARS-CoV-2 IgA单克隆抗体的优化表达及其初步鉴定
2023-10-20师江龙孙文泽乐鑫潘勇兵
师江龙,孙文泽,乐鑫,潘勇兵
武汉生物制品研究所有限责任公司抗体研究室,湖北武汉430207
由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的COIVD-19已在世界范围内引起了广泛流行,严重危害公众健康,制约了经济发展[1-3]。单克隆抗体因靶向高效、毒副作用小而成为抗SARS-CoV-2 的有力武器,目前上市的抗SARS-CoV-2 单克隆抗体均为IgG 型且基本均通过静脉注射给药,但SARS-CoV-2主要通过呼吸道黏膜感染机体[4],而经由静脉注射的IgG 抗体在肺部及上呼吸道的滴度远远低于血清[5],因此,治疗COIVD-19 一般需要给予高剂量抗体[6]。
黏膜免疫是构成机体抵御病原体的第一道防线,其中IgA发挥极大作用,特别是二聚体IgA(dimeric IgA,dIgA)和分泌型IgA(secretory IgA,sIgA)[7-8]。呼吸道中富含丰富的黏膜系统,说明IgA抗体在抗SARSCoV-2 中应该能中和病毒并阻断病毒入侵体内。本研究通过将本实验室1株抗SARS-CoV-2单克隆抗体F61(IgG)重链(heavy chain,Hc)、轻链(light chain,Lc)可变(variable region,V)区分别克隆至含IgA1 Hc、Lc 恒定(constant region,C)区的载体上,应用聚乙烯亚胺(polyethyleneimine,PEI)转染293F 细胞,通过优化质粒之间的比例、质粒与PEI 的比例以及转染后上清收获时间来提高单体IgA1(monomeric IgA1,mIgA1)-F61 和dIgA1-F61 表达量。表达后上清经亲和层析纯化后,经SDS-PAGE、体积排阻高效液相色谱(size exclusion chromatography-high performance liquid chromatography,SEC-HPLC)法分析纯度,并利用假病毒中和试验进行中和活性检测,以验证IgA 在抗SARS-CoV-2中的效应。
1 材料与方法
1.1细胞、载体及病毒 EXPi293FTM细胞购自美国ThermoFisher 公司;Huh-7细胞(第21代)由武汉生物制品研究所有限责任公司抗体研究室保存,KS001载体由该研究室提供;编码人IgA1 Hc、Lc恒定区及J链(joining chain,Jc)的pcDNA3.4(+)载体由南京金斯瑞生物科技有限公司合成;OmicronBA.4/5 假病毒购自北京云菱生物技术有限公司。
1.2主要试剂及仪器 Expi293TM、Opti-MEM、DMEM、人IgA ELISA 检测试剂盒购自美国ThermoFisher 公司;质粒抽提试剂盒购自天根生化科技(北京)有限公司;PEI MAX 40K 转染试剂购自美国Polysciences公司;人IgA蛋白、HRP-山羊抗人IgA Fc购自美国Abcam公司;Primatone®RL 购自美国Sigma 公司;Gibson 试剂盒购自美国NEB 公司;PeptideM/Agarose 纯化介质购自美国Invivogen 公司;PerkinElmerEnSight 多功能酶标仪购自美国PerkinElmer 公司;SEC 色谱分析柱(型号:TSKgelG4000 SWxl)购自日本TOSHO公司;高效液相色谱仪CBM-20A 购自日本岛津仪器有限公司。
1.3重组质粒的构建 以pcDNA3.4(+)和KS001 为载体,分别设计引物[见表1,引物由生工生物工程(上海)股份有限公司合成],将抗SARS-CoV-2 单克隆抗体F61(IgG1,抗体序列由中国疾病预防控制中心病毒病预防控制所梁米芳研究员提供)重(351 bp)、轻链(330 bp)的V 区分别克隆至编码IgA1 Hc、Lc 恒定区(Fc)的载体上(见图1),并送生工生物工程(上海)股份有限公司测序。其中IgA1 Hc(1 059 bp,GenBank登录号:AY647978.1)和Lc(318 bp,GenBank登录号:AH002839.2)Fc 区基因原始序列以及Jc(414 bp,GenBank 登录号:NP_653247.1)由南京金斯瑞生物科技有限公司合成。
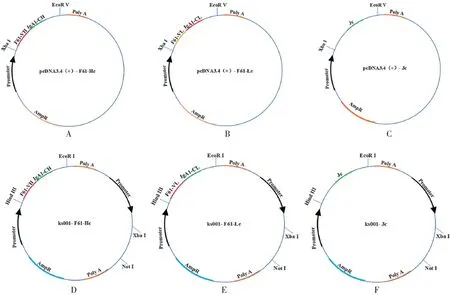
图1 重组IgA1-F61质粒的构建图谱Fig.1 Construction map of recombinant IgA1-F61 plasmids
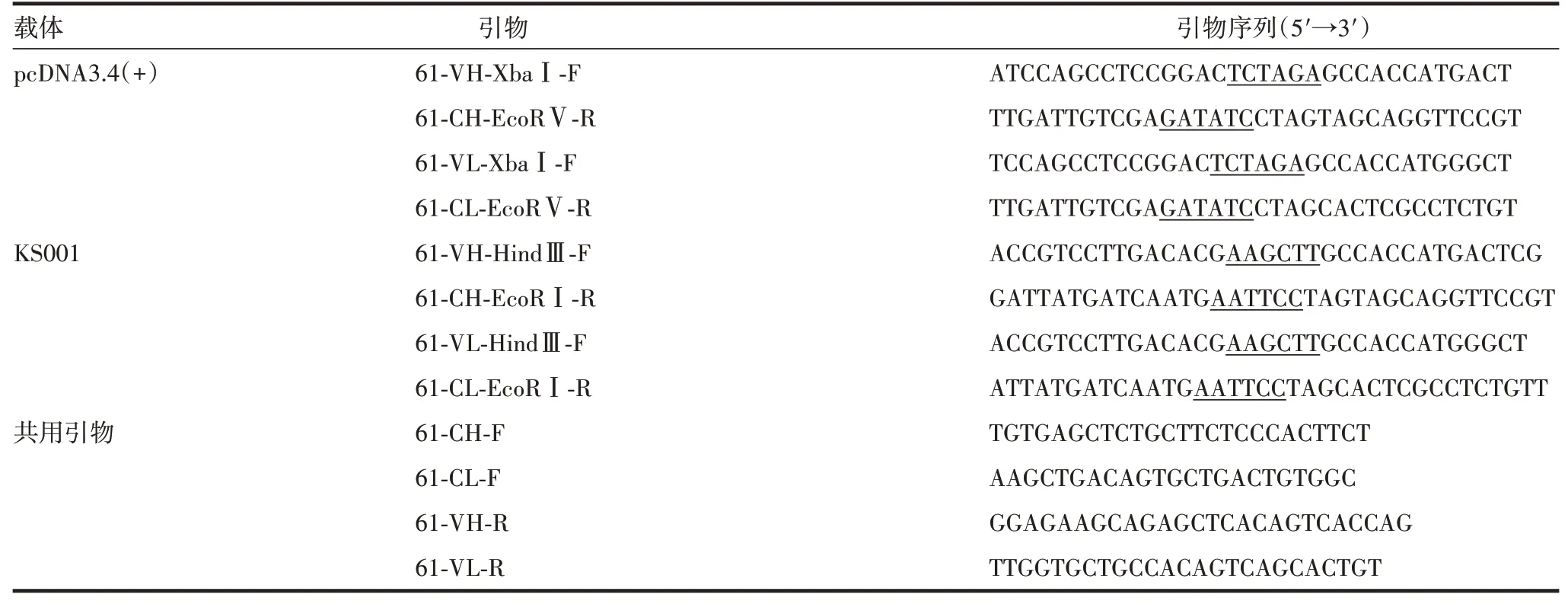
表1 引物序列Tab.1 Primer sequences
1.4mIgA1-F61 瞬时转染表达条件优化 将重组IgA1-F61质粒用PEI MAX 40K共转染入Expi293TM细胞,通过调整Hc、Lc 质粒、质粒DNA 与转染试剂PEI的比例以及最佳收获时间来确定最佳表达条件[9-10]。转染前24 h,将Expi293TM细胞以0.5×106cells/mL接种至25 mL Expi293TM表达培养基中,转染当天确保细胞密度为(1.0 ~1.2)× 106cells/mL,活率≥95%,以1 × 106cells/mL 所需质粒总量1 µg,Hc 与Lc质量比为1∶1、1∶1.25、1∶1.5、1∶2、1∶2.5进行转染,转染后6 h,于摇瓶中加入终浓度为0.6%的Primatone®RL[11],每天记录活细胞密度及活率,采用ELISA 法检测上清表达量。将筛选的最佳Hc 与Lc比例用于筛选DNA 与PEI 比例,以DNA 与PEI 质量比为1∶1、1∶2、1∶3、1∶4,再进行转染,每天记录活细胞密度及活率,ELISA 法检测细胞上清表达量,确定最佳收获时间。
1.5dIgA1-F61 瞬时转染表达条件优化 在mIgA1-F61 优化条件下,通过调整Jc 的比例,即Hc∶Lc∶Jc=1∶X∶0.5、1∶X∶1、1∶X∶1.5、1∶X∶2、1∶X∶2.5来确定最佳表达条件。
1.6细胞上清中抗体表达量的检测 采用ELISA法。将人IgA 检测ELISA 试剂盒中IgA 标准品经梯度稀释绘制标准曲线。细胞上清经12 000 ×g离心3 min,取上清,进行1∶10 000 稀释,加至包被好的96 孔板中,100 µL/孔,37 ℃水浴1 h;PBST 洗板5 次,加入羊抗人IgA-HRP(1∶15 000 稀释),100 µL/孔,37 ℃水浴1 h;PBST 洗板5 次,加入TMB 显色,最后用2 mol/L H2SO4终止。酶标仪读取A450值,通过标准曲线计算抗体浓度。
1.7IgA1 抗体的纯化 采用PeptideM/Agarose 纯化介质进行纯化[12]。以平衡缓冲液(10 mmol/L Na2HPO4,150 mmol/L NaCl,pH 7.2)平衡层析柱,将细胞培养液离心后经0.22µm 滤膜过滤,按1 mL/min 上样;加入洗脱缓冲液(0.1 mol/L 甘氨酸,pH 3.0)洗脱,洗脱后样品用1 mol/L Tris-HCl,pH 8.0中和缓冲液至pH 7.2 左右,用30 kD 超滤浓缩管,PBS 缓冲液进行超滤浓缩置换。纯化后的抗体用BCA测定试剂盒进行浓度测定,并进行4%~12%SDS-PAGE鉴定,同时设mIgA为阳性对照,检测抗体表达情况。
1.8IgA1 抗体纯度的检测 采用SEC-HPLC 法。以TSKgelG4000 SWxl(001FA00200G)为分析柱,流动相为0.1 mol/L PB、0.1 mol/L Na2SO4(pH 6.7),流速为0.5 mL/min,运行时间为35 min。上高效液相仪分析,mIgA1-F61 上样量为50 µg,dIgA1-F61 上样量为100µg,通过面积归一法分别计算纯度。
1.9IgA 抗体体外活性的初步分析 采用假病毒中和试验[13]。将mIgA1-F61、dIgA1-F61、IgG-F61 单克隆抗体从相同浓度(10µg/mL)起始,用含10%FBS的DMEM 完全培养基进行4 倍系列稀释,共9 个梯度;用DMEM 完全培养基将OmicronBA.4/5 假病毒稀释至1.3 × 104TCID50/mL,等体积加至稀释好的抗体中,混匀,加至96 孔白板中,100 µL/孔,同时设置细胞对照(cell control,CC)孔和病毒对照(virus control,VC)孔,37 ℃孵育1 h,并设复孔;将Huh-7 细胞稀释至2 × 105cells/mL,加至上述混合物中,100µL/孔,于37 ℃,5%CO2细胞培养箱培养24 h;每孔弃100 µL 上清,加入荧光素酶检测试剂,100 µL/孔,室温避光反应2 min;反复吹打,于Perkin-ElmerEnSight 多功能酶标仪读取发光值(RLU),按下式计算抑制率,并将计算所得抑制率通过Graphpad Prism 8.0.2软件进行四参数非线性拟合,确定其最大半数抑制浓度(half maximal inhibitory concentration,IC50)。
抑制率(%)=[1-(样品组发光强度均值-CC 均值)/(VC均值-CC均值)]×100%
1.10数据采集及分析 所有数据均采用Graphpad Prism 8.0.2软件进行处理并作图。
2 结果
2.1重组质粒的鉴定 以pcDNA3.4(+)和KS001 载体为模板,Hc、Lc电泳结果见图2,Hc出现在约1 400 bp处,Lc 出现在约750 bp 处,大小与理论值相符,将其插入质粒模板后,经测序验证,插入序列与理论序列一致。表明分别编码F61-IgA1 Hc、Lc 的重组质粒构建正确。
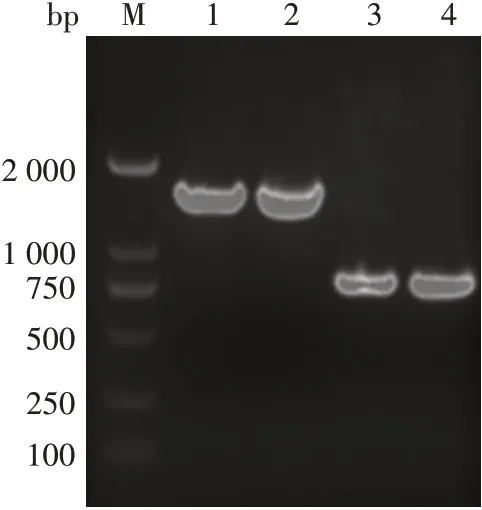
图2 IgA1-F61 Hc、Lc扩增电泳图Fig.2 Electrophoretic profile of amplification of IgA1-F61 Hc and Lc
2.2mIgA1-F61最佳瞬时转染条件以pcDNA3.4(+)载体为模板,Hc∶Lc=1∶2 时,抗体表达量最高,为89.25µg/mL,见图3;在最佳Hc 与Lc 比例基础上,当DNA∶PEI=1∶3时,抗体表达量在转染后第5天达到最高,为123.45 µg/mL,见图4。因此,确定mIgA1-F61最佳瞬时转染条件为:以pcDNA3.4(+)为载体,Hc与Lc比例为1∶2,DNA与PEI比例为1∶3;在该转染条件下,转染后第5 天为最佳收获时间。经优化后的抗体表达量为未经优化(Hc∶Lc=1∶1)时的2倍左右。
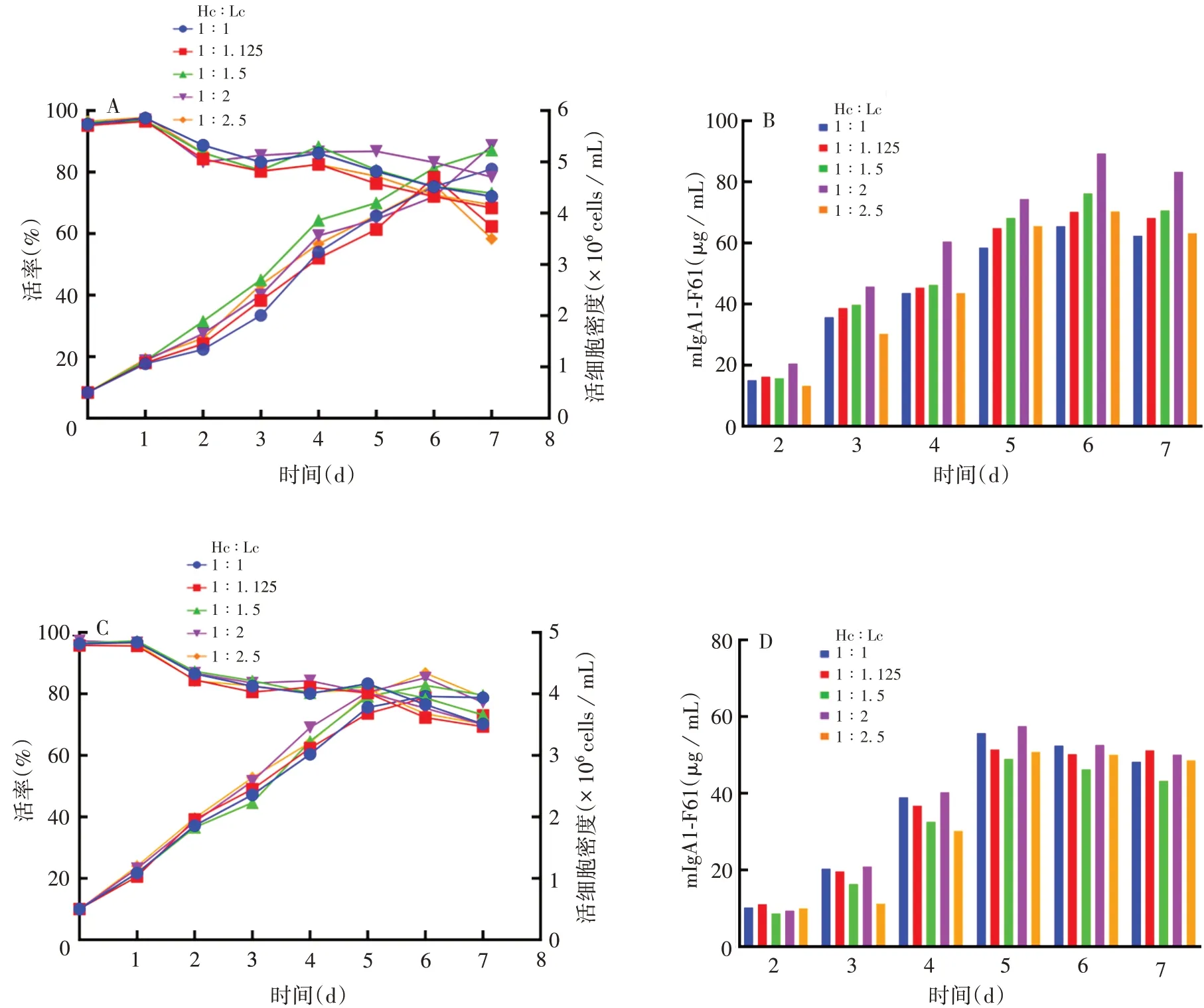
图3 不同载体中Hc与Lc比例对细胞密度、活率以及瞬时转染后上清mIgA1-F61表达的影响Fig.3 Effects of proportion of Hc and Lc in different vectors on cell density,viability and expression of mIgA1-F61 in supernatant after transient transfection
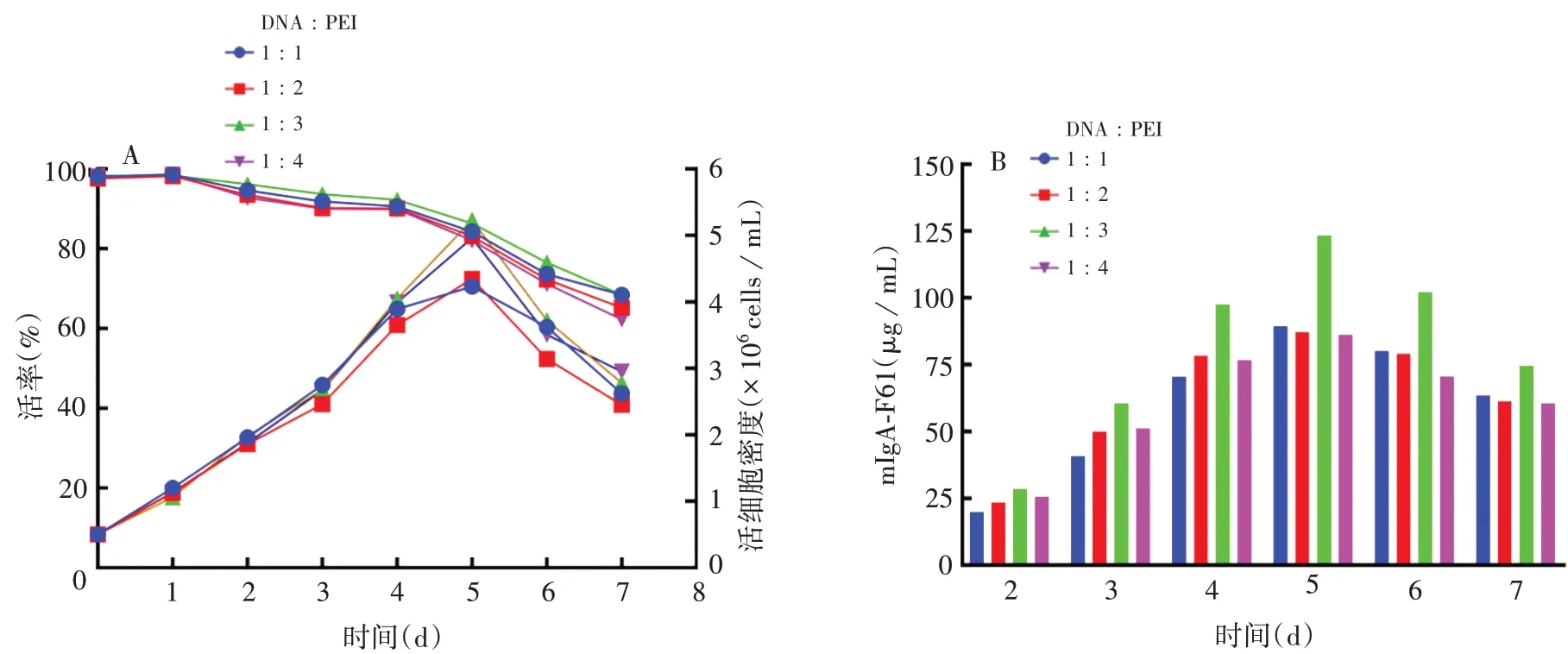
图4 以pcDNA3.4(+)为载体的DNA与PEI比例对细胞密度、活率(A)以及瞬时转染后上清mIgA1-F61表达(B)的影响Fig.4 Effects of proportion of DNA and PEI on cell density,viability(A)and expression of mIgA1-F61 in supernatant(B)after transient transfection using vector pcDNA3.4(+)
2.3dIgA1-F61最佳瞬时转染条件 经SEC-HPLC分析,当Hc∶Lc∶Jc=1∶2∶1时,dIgA1-F61主峰(目标峰)面积占比最大,为92.35%,随着Jc 增加,会降低二聚体的表达量且出现一些非目的峰,见图5。因此,确定dIgA1-F61瞬时转染最佳质粒比例Hc∶Lc∶Jc=1∶2∶1。
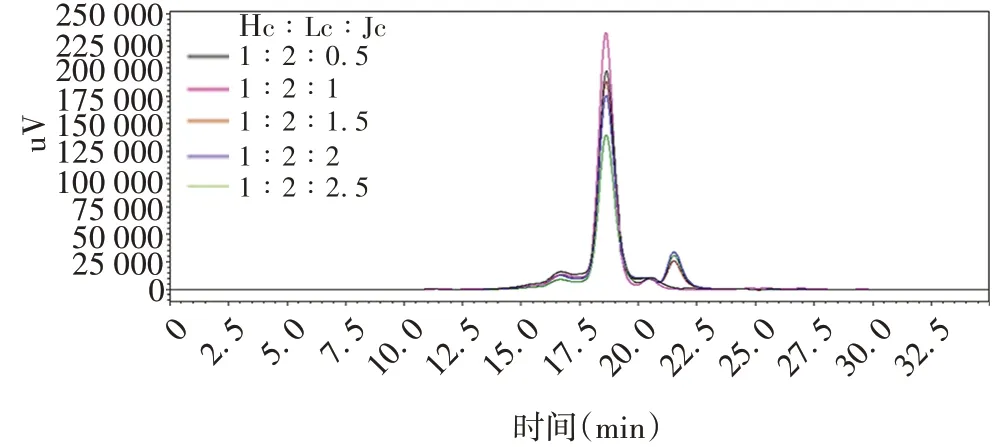
图5 Jc比例对dIgA1-F61表达的影响Fig.5 Effect of proportion of Jc on expression of dIgA1-F61
2.4IgA1抗体纯度 还原条件下,mIgA1-F61和dIgA1-F61分别在约55 000和25 000处可见明显条带,与人IgA Hc、Lc相对分子质量相符;非还原条件下,mIgA1-F61 在约160 000 处可见明显条带,与人IgA 相对分子质量相当,而dIgA1-F61 相对分子质量与理论值(330 000)相符。见图6。经SEC-HPLC 分析,mIgA1-F61 的纯度为95%以上,dIgA1-F61 纯度为90%以上,表达的抗体纯化后纯度较高,可用于下一步分析。见图7。
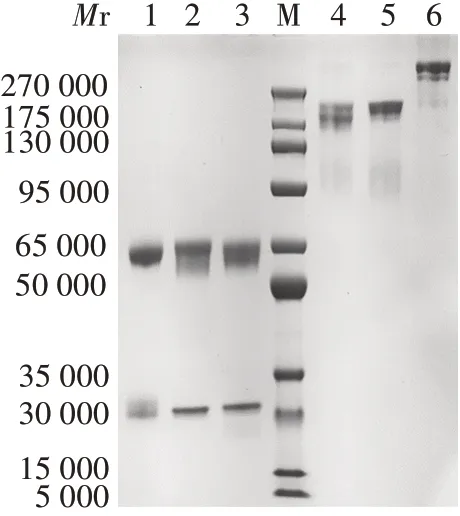
图6 纯化蛋白的SDS-PAGE分析Fig.6 SDS-PAGE analysis of purified protein
2.5IgA抗体初步活性 dIgA1-F61抑制病毒的中和活性IC50为0.09 nmol/L,mIgA1-F61的IC50为0.76 nmol/L,IgG-F61 的IC50为0.39 nmol/L,dIgA1-F61 的中和活性优于IgG-F61。见图8。
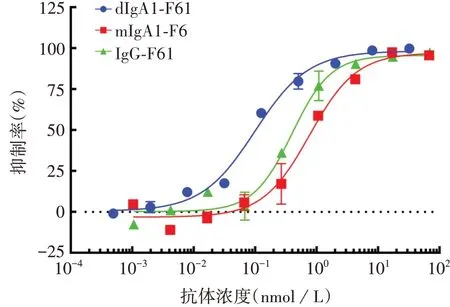
图8 F61对Omicron BA.4/5假病毒中和活性结果Fig.8 Results of pseudovirus neutralizing activity of F61 antibody against Omicron BA.4/5
3 讨论
蛋白瞬时转染表达系统相较于稳定转染表达体系,可短时间获得目的基因表达产物,有利于抗体药物的早期评价[14]。293F细胞具有生长速度快、悬浮培养、易于转染、外源蛋白表达量高等优点而常用作瞬时转染[15-16],但瞬时转染系统表达量受多种因素影响,因此需要对其优化来确定最佳反应体系。本研究通过对质粒间的比例、质粒与PEI 的比例以及转染后收获时间3个因素进行优化,并在转染后一定时间添加一定浓度蛋白胨,明显提高了IgA抗体蛋白的表达量[11],优化后mIgA1-F61的表达量为123.45µg/mL,约为未优化前的2 倍。同时本研究还在单体优化的基础上通过调整Jc 比例来优化dIgA 的最佳表达条件,经优化后,该抗体在Hc∶Lc∶Jc = 1∶2∶1 时dIgA表达最高,纯度可达90%以上,无需经二次纯化才能获得纯度较高的dIgA[17],减少了抗体纯化过程中的损失。
呼吸道是SARS-CoV-2 感染的主要靶标,其病毒载量与疾病严重程度相关[18]。黏膜表面分泌的dIgA、sIgA 在抵御外源病原体入侵中发挥重要作用[19]。本研究体外假病毒中和试验发现,mIgA 的中和效力比IgG 低2 倍,但dIgA 的中和效力为IgG 的4 倍,表明dIgA 是比IgG 更有效的中和抗体,提高抗体的价位可增强抗体中和活性,这一发现与之前的研究中,流感病毒更易被dIgA中和而不是mIgA一致[20-22]。
综上所述,本研究通过优化质粒比例、质粒与PEI 比例以及转染后上清收获时间,提高了抗SARSCoV-2 IgA 单克隆抗体瞬时转染的表达量,为大规模瞬时转染生产该类抗体奠定了基础,同时为抗SARSCoV-2治疗及预防提供了新思路,开发通过鼻腔黏膜给药的IgA 抗体制剂,或能诱导产生IgA 抗体的鼻喷或吸入式SARS-CoV-2疫苗将是一个较好研究方向。
