抗PD-1/CTLA-4双特异性抗体的质量评价
2023-10-20俞小娟于传飞刘春雨武刚李萌王文波郭璐韵付志浩赵雪羽王兰
俞小娟,于传飞,刘春雨,武刚,李萌,王文波,郭璐韵,付志浩,赵雪羽,王兰
中国食品药品检定研究院卫生部生物技术产品检定及标准化重点实验室国家药品监督管理局生物制品质量研究与评价重点实验室,北京102629
细胞毒性T 淋巴细胞相关蛋白4(cytotoxic Tlymphocyte-associated protein 4,CTLA-4)和程序性死亡受体1(programmed cell death protein 1,PD-1)均属于目前研究较为成熟的免疫检查点,也是抗肿瘤药物开发的重要靶点[1-2]。其中,PD-1 是存在于细胞毒性T 淋巴细胞表面的受体,在与肿瘤细胞或抗原呈递细胞中的PD-L1或PD-L2配体结合后,可诱导效应T细胞和记忆T细胞的细胞耗竭,并引起Treg细胞增加,导致免疫系统的抑制[3]。CTLA-4 是Treg 细胞中组成性表达分子,可阻断T 细胞中CD28 与抗原呈递细胞CD80/CD86 受体的相互作用,降低后者的激活,从而抑制细胞毒性T细胞增殖[4]。
抗PD-1 单抗的主要作用机制为与T 细胞表面的PD-1 相结合,以阻断PD-1 与PD-L1 的相互作用,从而逆转肿瘤细胞对效应型T细胞的抑制,激活T细胞产生对肿瘤细胞的杀伤效应,而抗CTLA-4单抗可解除CTLA-4 对T 细胞的抑制作用,上调T 细胞的活化增殖,从而诱导或增强其抗肿瘤免疫反应。在临床使用中,PD-1单一抗体易产生耐药性,为应对该问题,FDA 已经批准PD-1 与CTLA-4 单抗联合应用,但二者联用时,会发生较高的免疫相关副作用,在临床使用上受到限制[5]。因此,PD-1/CTLA-4 双特异性抗体的开发成为全球药企的选择[6],其具有单抗难以比拟的治疗优势,但由于其分子结构和作用机制复杂,在前期研发或后期质量控制方面均存在巨大挑战。
为了对抗PD-1/CTLA-4 双特异性抗体产品进行质量控制,保证其安全、有效,并为后期其他双特异性抗体的开发和质控提供指导,本研究结合该产品特点,采用国际先进的分析手段,建立了重组人源化抗PD-1/CTLA-4双特异抗体的质控方法,现将结果报道如下。
1 材料与方法
1.1供试品 重组人源化抗PD-1/CTLA-4 双特异性抗体(12.5 mg/mL)由本实验室留存,为抗PD-1的完整抗体C-端连接抗CTLA-4 的单链可变区片段(single chain antibody fragment,scFv)组合而成,可同时与细胞表面抗原PD-1及CTLA-4相互作用。
1.2细胞 Jurkat-CTLA-4-NFAT-luc(CTLA-4靶点的转基因测活效应细胞)由本实验室构建;PD-1效应细胞和PD-L1aAPC/CHPO-K1 细胞购自美国Promega公司;293T-CTLA4细胞由本实验室留存。
1.3主要试剂及仪器 Bright-GloTMLuciferase Assay System 购自美国Promega 公司;hB7.1-hFc-Biotin 蛋白由中山康方生物医药有限公司提供;RPMI1640(Lglutamine and HEPES)培养基、Ham’s F-12培养基、Antibiotic G-418 Sulfate Solution、DMEM 培养基、0.25%胰酶、丙酮酸钠、MEM 非必须氨基酸、磷酸盐缓冲液、BLasticidin、胎牛血清购自美国Gibco 公司;潮霉素B 购自美国Invitrogen 公司;牛血清白蛋白购自德国VETEC 公司;FITC Streptavidin 购自美国Biolegend公司;ATPlite试剂盒购自美国PerkinElmer公司;SDSMW 分析试剂盒(390953)、Beckman SDS-MW GelBuffer(A30341)、Beckman 毛细管(50 µm ID × 65 cm)、Beckman eCAP N-CHO 涂层毛细管、BeckmanPA800 plus毛细管电泳系统购自美国Beckman Coulter公司;1%甲基纤维素溶液、pI marker 5.85 及9.22 自美国ProteinSimple 公司;Pharmalyte pH 3 ~10 和pH 5 ~8购自美国GE 公司;2-AB 购自阿拉丁试剂(上海)有限公司;流式细胞仪FACSCalibur购自美国BD公司;Agilent TC C-18 色谱柱(150 mm × 4.6 mm,5 µm)购自美国Agilent公司;Acquity UPLC Glycan 300 A氨基柱(1.7µm,2.1 mm×150 mm)、XBridge BEH C18 XP(2.5µm,2.1 mm×150 mm)色谱柱、WATERS 2695 HPLC 系统购自美国Waters 公司;TSK-G3000SWXL(5µm,300 Å,7.8mm ×300 mm)购自东曹生物科技有限公司;10、30 kD 超滤管购自德国Sartorius 公司;Spectra MaxGeminiXS 多功能酶标仪及SoftMax 分析软件购自美国Molecular Devices 公司;iCE280 成像毛细管等点聚焦电泳系统购自加拿大Protein simple公司。
1.4活性检测
1.4.1细胞生物学活性(检测PD-1靶点) 采用报告基因法。将PD-L1 aAPC/CHO-K1 细胞复苏后,于Ham’s F-12 培养基(含10%FBS,200µg/mL Hygromycin B,250µg/mL Antibiotic G-418 Sulfate Solution)37 ℃,5%CO2培养;检测前1天用0.25%胰酶消化收集细胞,调整活细胞密度至4×104个/孔,细胞活力不低于90%,铺至96 孔板中,100µL/孔,培养过夜(贴壁时间要求≥8 h),检测当天,弃培养基待用。将PD-1/CTLA-4 单抗以2 000 nmol/L 的起始浓度进行2.5 倍稀释至3.28 nmol/L(8 个浓度)后,再进行20 倍稀释(2 个浓度)至0.008 nmol/L,共10 个浓度梯度(2 000、800、320、128、51.20、20.48、8.19、3.28、0.16、0.008 nmol/L),加至96 孔板中,40 µL/孔,每个浓度设2 个复孔。将PD-1 效应细胞复苏后,于RPMI1640 L-glutamine and HEPES 培养基(含10%FBS,200µg/mL Hygromycin B,500µg/mL Antibiotic G-418 Sulfate Solution,1mmol/L丙酮酸钠,0.1 mmol/L MEM nonessential amino acids)37 ℃,5%CO2培养;于检测当天收获细胞,用RPMI1640 L-glutamine and HEPES 培养基(含1%FBS)重悬,调整活细胞密度至5×104个/孔,加至96孔板中,40µL/孔,即每孔含80 µL 溶液,混匀,37 ℃,5% CO2培养箱孵育6 h;取出96孔板,平衡至室温(22 ~25 ℃,5 ~10 min),加入Bright-Glo™,80µL/孔,室温孵育20 min。上Perkin Elmer EnVision酶标仪,检测荧光素酶信号值(RLU)。独立制备1 份样品作为参比品,试验重复6 次。用SoftMax软件对读数结果进行分析。以抗PD-1/CTLA-4 单抗浓度的对数值为横坐标,RLU 值为纵坐标,绘制四参数曲线。计算生物学活性的半数最大效应浓度(concentration for 50%of maximal effect,EC50)及细胞生物学活性。该方法系统适用性要求为:标准曲线R2≥0.90,平行复孔间RLU值的相对标准偏差(RSD)应≤30%。
1.4.2竞争结合活性(检测CTLA-4 靶点) 采用流式细胞荧光分选法。将293T-CTLA-4 细胞复苏后于DMEM培养基(含10%FBS)37 ℃,5%CO2培养;检测当天用0.25%胰酶消化收集细胞,调整细胞密度,以(1.5 ~2)×105个/孔加至96孔板中,800×g离心,弃上清;将PD-1/CTLA-4单抗用1%BSA以200 nmol/L的起始浓度进行1∶3稀释,共8个浓度(200、66.66、22.22、7.4、2.46、0.82、0.28、0.10 nmol/L),加至96 孔板中,100µL/孔,混匀,冰上孵育30 min,即完成供试品与细胞的孵育过程;用1%BSA配制浓度为40 nmol/L 的hB7.1-hFc-Biotin 蛋白,加至96 孔板中,100µL/孔,混匀,冰上孵育60 min,即完成蛋白加入及孵育过程;5 ℃,1 000×g离心5 min,弃上清,加入1%BSA 溶液,100µL/孔,洗涤细胞,离心去上清,重复1次;加入FITC Streptavidin荧光二抗(1%BSA 1∶500稀释),100µL/孔,混匀,冰上避光孵育40 min;低温离心,弃上清,加入1% BSA 溶液,100µL/孔,洗涤细胞,离心去上清,重复1 次;加入1%BSA 重悬细胞,100µL/孔。上流式细胞仪FACSCalibur检测。独立制备1份样品作为参比品,试验重复6次。将读取的MFI值导入SoftMax软件进行分析。以抗PD-1/CTLA-4 单抗浓度的对数值为横坐标,MFI 值为纵坐标,绘制四参数曲线。计算生物学活性的EC50及竞争结合活性。该方法系统适用性要求为:标准曲线R2≥0.950,平行复孔间RLU值的RSD应≤30%。
1.5纯度分析
1.5.1还原/非还原十二烷基硫酸钠毛细管电泳(capillaryelectrophoresis-sodiumdodecylsulfonate,CE-SDS)法 将PD-1/CTLA-4 单抗用SDS-MW Sample Buffer稀释成含蛋白约0.5(非还原CE-SDS)或1 mg/mL(还原CE-SDS)的溶液,均平行制备6份样品,按20 ∶1的比例加入碘乙酰胺(非还原CE-SDS)或巯基乙醇(还原CE-SDS)溶液,混匀,70 ℃水浴孵育3 min;冷却至室温,10 000×g离心1 min;取上清,采用Beckman PA800 plus 毛细管电泳系统上样分析,其中非还原CE-SDS 采用10 kV 反相极性电动进样40 s,还原CESDS 采用5 kV 反相极性电动进样20 s,分离电压15 kV,毛细管温度25 ℃,样品室温度6 ℃,PDA 检测器,检测波长220 nm。试验重复6 次,还原CE-SDS计算轻链与重链峰面积之和百分比及RSD;非还原CE-SDS 计算主峰峰面积、片段及聚体峰峰面积百分比和RSD。该方法系统适用性要求为:电泳图谱应与提供的典型电泳图谱一致,且供试品进样第1 针与最后1针主峰的迁移时间差<1.0 min。
1.5.2分子排阻高效液相色谱(size exclusion chromatography-high performance liquid chromatography,SECHPLC)法 色谱柱:TSK-G3000SWXL(5 µm,300 Å,7.8 mm ×300 mm);流动相:25 mmol/L磷酸盐缓冲液(NaH2PO4-Na2HPO4),300 mmol/L 氯化钠,pH 6.5;流速:0.8 mL/min;上样量:8µL(12.5 mg/mL);柱温:室温;样品池温度:4 ℃;检测波长:280 nm;检测时间:20 min。采用WATERS 2695 HPLC系统工作站对试验结果进行数据处理,面积归一化法计算单体峰和聚体峰含量。试验重复6 次,分别计算单体峰及聚体峰峰面积百分比和RSD。该方法系统适用性要求为:每1针供试品的主峰理论塔板数应≥2 000,主峰和聚体峰间的分离度应≥1.5。
1.6电荷异质性检测 采用成像毛细管等电聚焦电泳(imaging capillary isoelectric focusing electrophoresis,iCIEF)法。将样品用超纯水稀释至5 mg/mL,取1 440µL超纯水、875µL 1%甲基纤维素、50µL Pharmalytes 5 ~8、50 µL Pharmalytes 3 ~10、12.5 µL pI marker 5.85 及12.5 µL pI marker 9.22 配置预混液,取5µL样品与195µL预混液混合上样进行检测。试验重复6次,分别计算A、B、C、D组峰的峰面积百分比和RSD。分析条件:预聚焦电压1.5 kV,持续1 min;聚焦电压3 kV,持续9 min。该方法系统适用性要求为所有供试品特征峰的pI 值与第1 针供试品特征峰pI值相差范围在±0.10之间。
1.7鉴别试验 采用肽图进行鉴别分析。用Trypsin酶解缓冲液将样品稀释至2 mg/mL,取稀释后样品50µL,加入6µL 1%Rapigest 和6µL 50 mmol/L TCEP 溶液,60 ℃还原反应30 min;向还原后样品中加入4 µL 100 mmol/L 碘乙酰胺溶液,室温避光反应30 min;加入20 µL 0.1 µg/µL Trypsin 溶液,37 ℃水浴中酶切20 h;酶切后加入含10% TFA 的乙腈溶液4µL,37 ℃反应1 h;10 000×g离心3 min;取上清,用超高效液相色谱系统、紫外检测器、Waters XBridge BEH C18 XP(2.5µm,2.1 mm ×150 mm)色谱柱进行样品分离,在214 nm 波长处检测。液相色谱条件:流动相A 为0.1%三氟乙酸-水溶液;流动相B 为0.1%三氟乙酸-乙腈溶液;采用梯度洗脱(0 ~105 min,流动相B 从2%升至100%;106 ~120 min,流动相B 从100%降低至2%);流速为0.2 mL/min;上样量为10 µL;样品室温度为5 ℃;柱温为40 ℃。制备2 份样品,分别命名为样品1 和2。该方法系统适用性要求为:供试品特征峰的相对保留时间在固定范围内(以保留时间79.7 min处的峰为参考峰)。
1.8含唾液酸糖型组分含量的分析 采用超高效液相色谱法。将样品用50 mmol/L 碳酸氢铵溶液稀释至2 mg/mL,按25 ∶1 的比例加入PNGase F,37 ℃水浴中酶切反应20 h;加入3 倍体积的-20 ℃预冷乙醇,-20 ℃冰箱放置1 h;10 000×g离心10 min;取上清,用真空干燥离心机干燥样品后,加入2-AB荧光标记试剂,65 ℃反应3 h。用Waters H-Class 超高效液相色谱仪、荧光检测器进行分析。试验重复6次。检测器激发波长:330 nm,发射波长:420 nm;色谱条件:流动相A 为50 mmol/L 甲酸铵,pH 4.5;流动相B 为乙腈;色谱柱:Acquity UPLC Glycan(300 A,1.7 µm,2.1 mm × 150 mm);进样体积:1 µL;柱温:40 ℃;样品盘温度:10 ℃。采用面积归一化计算含唾液酸糖型的含量。该方法系统适用性要求为:供试品图谱和提供的参考品图谱一致。
1.9数据采集及分析 细胞生物学活性使用Perkin Elmer EnVision 酶标仪系统自带软件采集数据,Soft-Max Pro 5.4.1 软件处理数据;竞争结合活性使用BD CellQuest Pro软件采集数据,SoftMax Pro 5.4.1软件处理数据;还原/非还原CE-SDS、iCIEF均采用32 Karat™软件采集及分析数据;SEC-HPLC、肽图及含唾液酸糖型组分含量的分析均采用EmpowerTM3 软件采集及处理数据。
2 结果
2.1细胞生物学活性(PD-1 靶点) 6 次检测的EC50为(6.91±0.78)nmol/L,RSD为11.29%;相对参比品的生物学效价为(103.50±13.08)%,RSD为12.64%。见图1。
2.2竞争结合活性(CTLA-4 靶点) 6次检测的EC50为(0.35±0.28)nmol/L,RSD为10.42%;相对参比品的生物学效价为(99.30±9.15)%,RSD为8.32%。见图2。
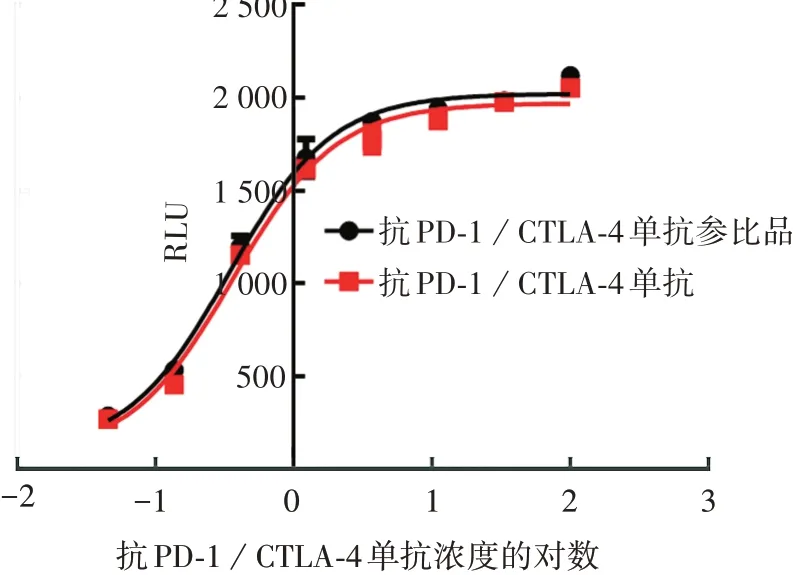
图2 抗PD-1/CTLA-4双特异性抗体的竞争结合活性效应曲线Fig.2 Competitive binding activity effect curve of anti-PD-1/CTLA-4 bispecific antibody
2.3纯度
2.3.1还原/非还原型CE-SDS 还原CE-SDS典型图谱见图3,轻链与重链峰面积之和百分比为(98.86±0.02)%,RSD为0.02%。非还原CE-SDS 典型图谱见图4,主峰峰面积百分比为(93.07±0.13)%,RSD为0.14%;片段百分比为(4.44 ± 0.13)%,RSD为2.93%,聚体峰面积百分比为(2.49 ± 0.15)%,RSD为0.21%。
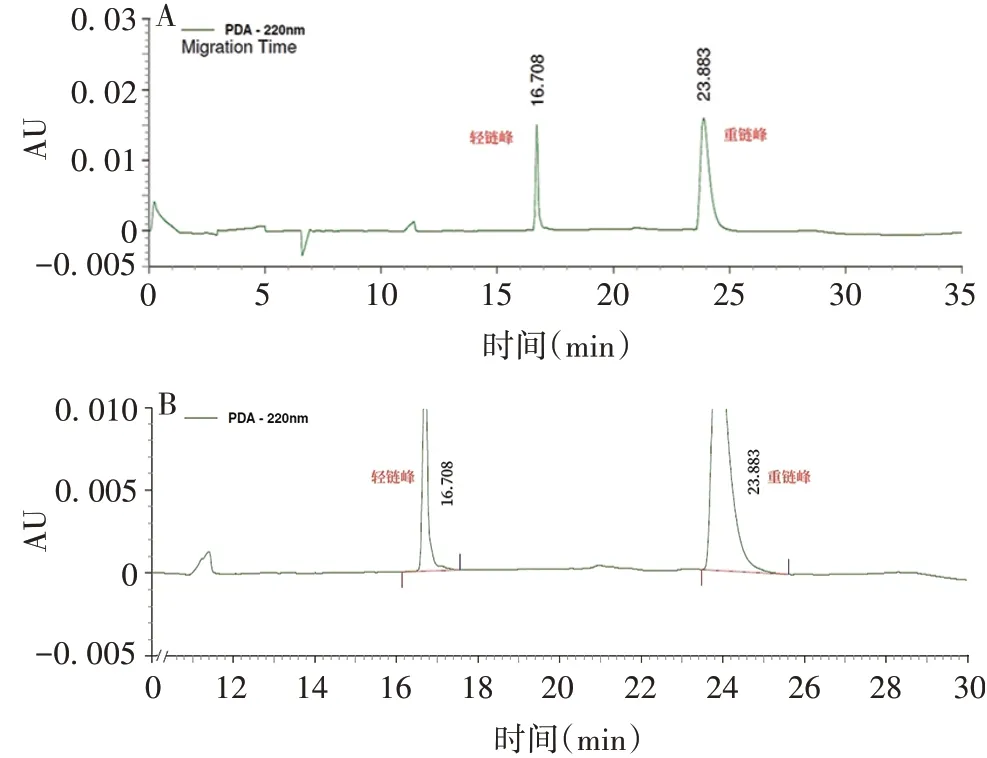
图3 抗PD-1/CTLA-4 双特异性抗体的还原CE-SDS 典型图谱Fig.3 Reducing CE-SDS typical chromatogram of anti-PD-1/CTLA-4 bispecific antibody
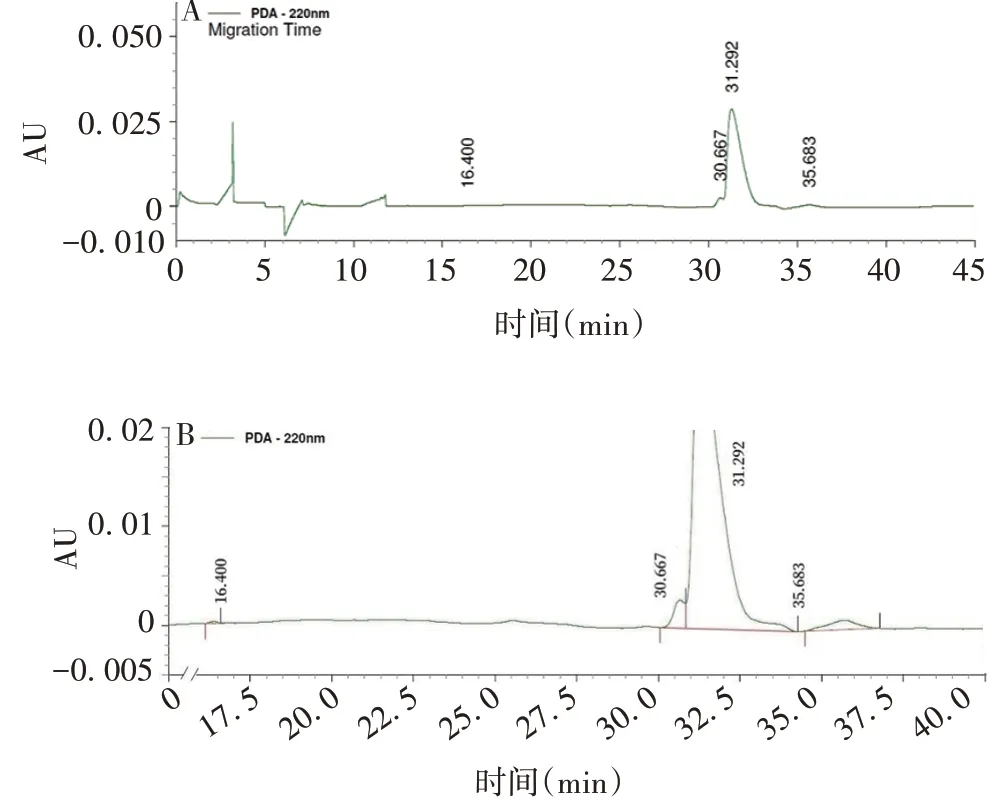
图4 抗PD-1/CTLA-4 双特异性抗体的非还原CE-SDS典型图谱Fig.4 Non-reducing CE-SDS typical chromatogram of anti-PD-1/CTLA-4 bispecific antibody
2.3.2SEC-HPLC 结果显示,单体的峰面积百分比为(97.20 ± 0.01)%,RSD为0.01%;聚体峰面积百分比为(2.68±0.01)%,RSD为0.37%。见图5。
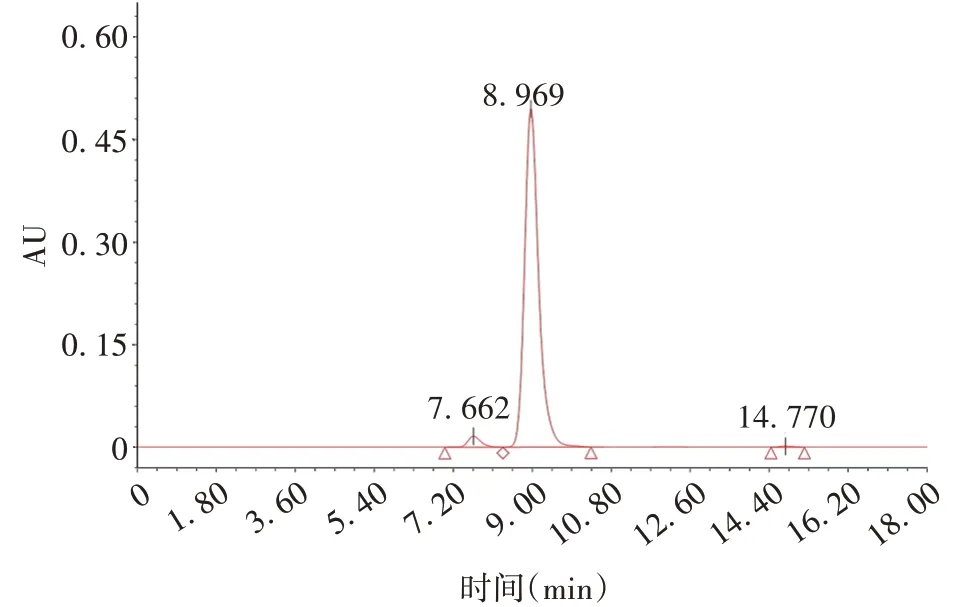
图5 抗PD-1/CTLA-4双特异性抗体的SEC-HPLC 典型图谱Fig.5 SEC-HPLC typical chromatogram of anti-PD-1/CTLA-4 bispecific antibody
2.4电荷异质性 结果显示,图中A组峰面积百分比为(38.43±0.54)%,RSD为0.1.41%;B 组峰面积百分比为(43.26±0.32)%,RSD为0.74%;C 组峰面积百分比为(11.31±0.14)%,RSD为1.24%;D 组峰面积百分比为(7.00±0.17)%,RSD为2.43%。见图6。
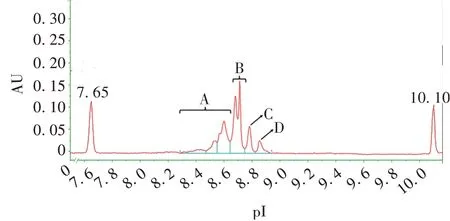
图6 抗PD-1/CTLA-4双特异性抗体的iCIEF典型图谱Fig.6 iCIEF typical chromatogram of anti-PD-1/CTLA-4 bispecific antibody
2.5肽图样品1和2各特征峰与参比标准品图谱初步观察具有可比性,见图7。
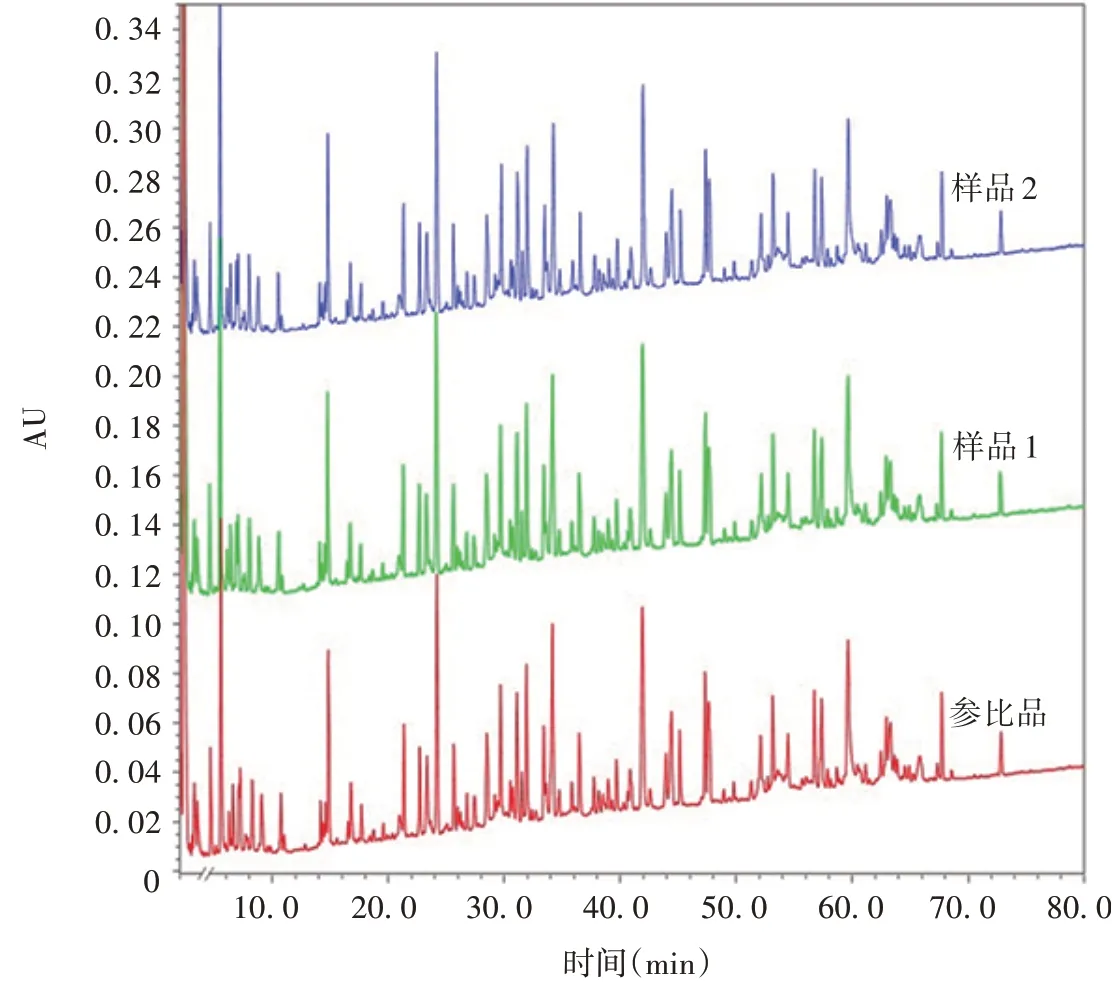
图7 抗PD-1/CTLA-4 双特异性抗体的肽图典型图谱Fig.7 Typical peptide map of anti-PD-1/CTLA-4 bispecific antibody
2.6糖型分析 糖基化分析的典型图谱见图8,糖型命名见图谱。其中,占比最高的糖型为G0F,含量为(41.06 ± 0.11)%,RSD为0.27%。含唾液酸的糖型共3 种,分别为G2F+G1F-NANA、G2F-NANA 和G2F-2NANA,G2F+G1F-NANA 含量为(12.44 ± 0.12)%,RSD为0.96%;G2F-NANA 含量为(12.00±0.05)%,RSD为0.42%;G2F-2NANA 含量为(5.37±0.05)%,RSD为0.93%;含唾液酸糖型的总体含量为(29.80±0.20)%,RSD为0.67%。
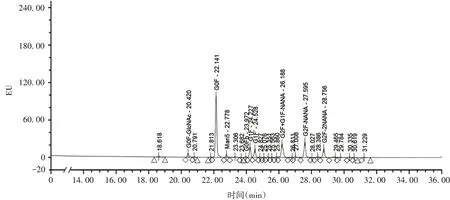
图8 抗PD-1/CTLA-4双特异性抗体的糖型典型图谱Fig.8 Glycosylation typical chromatogram of anti-PD-1/CTLA-4 bispecific antibody
3 讨论
随着研究的不断深入,抗体的靶点从传统的单一靶点逐渐向多样化、复杂化过渡,抗体偶联药物、双特异性抗体,甚至四特异性抗体逐渐从研发走向上市。其中,双特异性抗体呈爆炸式增长。目前我国药企参与或在国内申报的双特异抗体已达100 多个。从2015年友芝友实业集团有限公司申报第1款HER2/CD3双特异抗体,至2020年安进公司的贝林妥欧的获批[7-8],均极大促进了双特异抗体的发展。靶点方面,已经申报临床的抗体多集中在CD19、CD20、BCMA、HER2、TIGIT、EGFR、TGF-β、4-1BB、Claudin18.2和CD47等靶点。在国内,除了中山康方生物医药有限公司的卡度尼利(AK104)外[9],还有多款单抗申报临床。
活性是单抗的关键质量属性之一,阿斯利康的MEDI5752 是国际上最早进入临床的PD-1/CTLA-4单抗[10],最近报道的该单抗生物学活性测定方法为双靶点报告基因测定活性方法[11]。该方法构建2 个工程细胞系:CHO/CD80/PD-L1 和Jurkat/CTLA-4/PD-1/IL2-Luc,将细胞与梯度稀释的抗体孵育后,抗体在Jurkat/CTLA-4/PD/1/IL2-Luc细胞上与各自抗原靶点(CTLA-4/PD-1)结合,导致荧光素酶蛋白浓度依赖性表达,通过RLU 值反映抗体生物学活性。本研究结合该单抗的结构特征,即与CTLA-4抗原呈弱结合状态,并参考PD-1[12-13]和CTLA-4[14-15]单抗的活性测定方法,开发了报告基因法用于测定PD-1 靶点的细胞生物学活性。原理如下:PD-1 effector 细胞表达的PD-1 分子结合于PD-L1 aAPC/CHO-K1 细胞表面的PD-L1 分子会抑制TCR 信号通路从而抑制萤光素酶蛋白的表达。加入抗PD-1/CTLA-4 双特异性抗体阻断PD-1 与PD-L1 结合并重新释放TCR 信号通路激活萤光素酶蛋白的表达,因此萤光素酶蛋白的表达水平与PD-1抗体呈浓度梯度依赖关系,加入萤光素酶底物试剂后产生生物化学发光信号,见图9。流式细胞荧光分选法用于测定CTLA-4靶点的竞争结合活性,原理如下:使用的293TCTLA-4 细胞表面含有CTLA-4 分子,通过在板中加入293T-CTLA-4细胞,再加入抗CTLA-4抗体与hB7.1-hFc-Biotin配体蛋白,使二者竞争与细胞表面的CTLA-4结合。孵育洗涤后,加入FITC Streptavidin 荧光二抗,使其与hB7.1-hFc-Biotin配体蛋白结合,在激光激发后,荧光素产生荧光,见图10。因此荧光强度与hB7.1-hFc-Biotin 配体蛋白的结合量呈正相关,与抗CTLA-4抗体的结合量呈负相关。通过以上2种方法对抗PD-1/CTLA-4 单抗的活性进行有效控制。采用还原/非还原CE-SDS配合SEC-HPLC[16]的方法进行单抗纯度的控制,相比于SDS-PAGE,CE-SDS 具有高分辨率、高自动化和高重复性的特点,近年来得到了广泛应用[17]。由于IEC-HPLC法分离度有限,无法将组成复杂的双特异性抗体各电荷异质体完全分开,并且不易于平台化,因此,针对该单抗的特点,本研究建立了iCIEF 法用于测定电荷的异质性。本研究建立了肽图的方法,使用Trypsin 酶解之后,通过UPLC法对抗PD-1/CTLA-4的双抗进行分子水平鉴别。该双特异性抗体的N-糖糖型中含有唾液酸,而唾液酸是引起抗体电荷异质性的重要原因,且各电荷异质体在糖型上主要差异在于唾液酸的比例,因此,本研究建立了HPLC法用于分析抗PD-1/CTLA-4单抗的糖基化,对含唾液酸糖型的总量进行控制[18]。
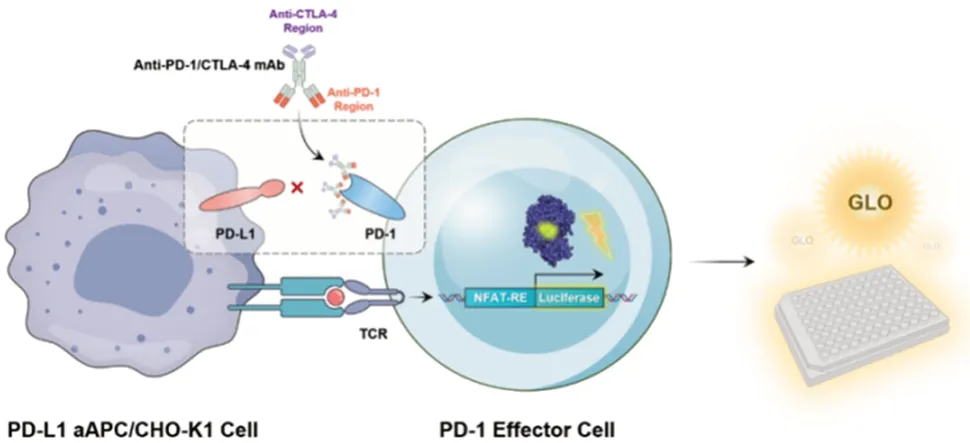
图9 细胞学活性(PD-1靶点)原理图Fig.9 Schematic diagram of biological activity(PD-1 target)
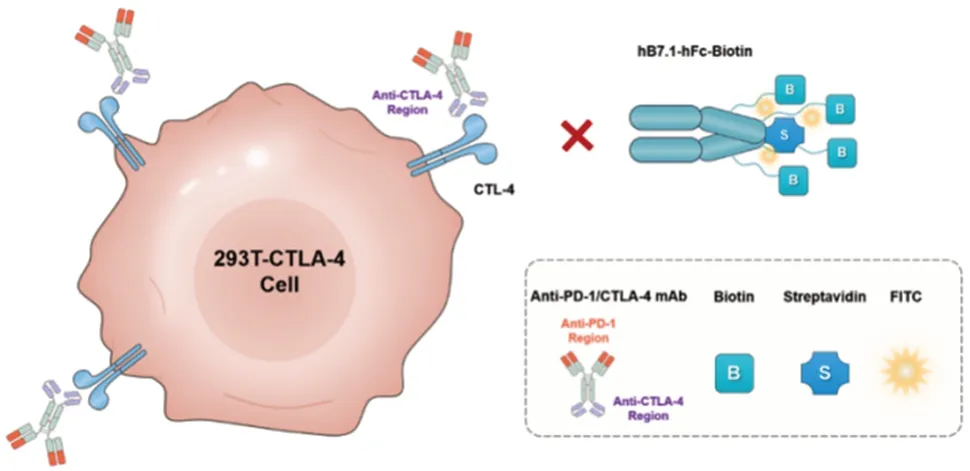
图10 竞争结合活性(CTLA-4靶点)原理图Fig.10 Schematic diagram of competitive binding activity(CTLA-4 target)
此外,本研究使用Fortebio 分子相互作用的方法分别测定了PD-1/CTLA-4 双特异性抗体与CD16a和C1q 的亲和能力,结果表明,该双特异性抗体与两种受体均无结合。同时,在膜表达PD-1的293T-PD1细胞系和膜表达CTLA-4 的293T-CTLA4 细胞系进一步验证了PD-1/CTLA-4 双特异性抗体的抗体依赖性细胞介导细胞毒(antibody-dependent cellular cytotoxicity,ADCC)活性和补体依赖的细胞毒(complement dependent cytotoxicity,CDC)活性,结果表明均无活性,即该双特异性抗体引起ADCC 或CDC 效应的风险极低。
本研究专门针对双特异抗体的质量控制开展研究,依据ICHQ6B 指导原则[19],针对此类产品的关键质量属性建立了基于不同原理的质量控制方法,以保证该产品的安全性、有效性和质量可控性,对于我国双特异性抗体的早期研发和申报上市均具有重大意义。
