高效表达人源可溶性转铁蛋白受体sTfR抗原及多克隆抗体制备和应用
2023-10-19卢振华吴振兴袁新松吴坚平
卢振华,吴振兴,袁新松,王 剑,吴坚平
(1.宁波普瑞柏生物技术股份有限公司,宁波 315033; 2.浙江大学 化学工程与生物工程学院,杭州 310027; 3.合肥师范学院 化学与化学工程学院,合肥 230601)
转铁蛋白受体(transferrin receptor,TfR)是一种单次穿膜的糖蛋白,由两个对称的、以二硫键连接在一起的亚单元组成[1-2],可以介导含有铁的铁蛋白以胞吞的形式进入细胞,在血红蛋白等含铁蛋白的合成中有着极其重要的作用[3-5]。可溶性转铁蛋白受体(serum transferrin receptor,sTfR)是转铁蛋白受体TfR通过细胞表面的蛋白水解作用而产生的,缺少完整转铁蛋白受体的前100个氨基酸,其可以和携带铁的转铁蛋白结合形成复合体,并进行铁的转运,与人体中红细胞生成和铁含量成正相关[6-7]。
sTfR在血清中的浓度可以作为一些疾病判断以及治疗效果的重要指标,可以反映机体对铁的需求,在疾病诊断以及药物疗效监测方面有着重要的意义[7-10]。当机体铁缺乏时,会合成较多的sTfR,使更多的铁蛋白进入细胞用于合成蛋白质,使铁的利用率升高[11-12]。sTfR作为介导功能性铁的重要媒介,其浓度相较转铁蛋白的浓度更加稳定,不受急性时相反应的影响,更加适合作为诊断的指标。因此,测定sTfR的浓度可以鉴定如急性肝功能异常造成的缺铁性贫血等一些疾病[13]。在临床实践中,血清铁蛋白、sTfR和血红蛋白联合检测能更加准确地判断患者的铁缺乏状态[14]。在怀孕时sTfR值也会升高,但此时不作为功能性铁缺乏的指标[15-17]。另外,sTfR的浓度还可以作为促红细胞生成素药物治疗效果的重要指标参数[18]。sTfR在糖尿病诊断中也有重要的诊断意义,体内如果有较高的铁含量则有患非胰岛素依赖性糖尿病(NIDDM)的可能,因为NIDDM是铁过多性疾病的并发症,如血色素沉着症等[19]。
目前,sTfR的主要检测手段有酶联免疫吸附法(ELISA)、自动免疫比浊法(IdeA STFE-IT assay)等[20-22],其中以免疫比浊法的灵敏度以及准确性最高,操作最为简便。本研究通过HEK293细胞高效表达重组人sTfR抗原,并进行纯化,利用该抗原免疫新西兰兔获得高效价抗体后进行抗体纯化,纯化后的抗体进行胶乳耦联制成试剂后进行样本比对。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒及试剂
HEK293细胞购自珠海恺瑞生物科技有限公司;质粒 pCDNA3.4-TOPO购自赛默飞世尔;表达质粒pCDNA3.4-sTfR(添加组氨酸标签及分泌信号肽)由安徽通用生物科技有限公司合成并构建。
1.1.2 主要试剂
大肠杆菌E.coliDH5a为本公司保藏;HEK293细胞表达套装购自珠海恺瑞生物科技有限公司;CHO细胞表达套装、蛋白Marker购自赛默飞世尔;sTfR 单克隆抗体11F5购自海肽生物科技(上海)有限公司;sTfR检测试剂盒为罗氏市售试剂盒,其他试剂均为分析纯。
1.2 方法
1.2.1 sTfR蛋白表达
培养HEK293细胞至细胞密度2×106mL-1,且镜检活细胞数大于98% 进行转染操作:以细胞悬液的1/20准备试剂KPM并加入1 μg/mL(DNA/细胞培养液体积)的质粒,混匀后进行膜过滤除菌;另一支1/20的KPM中加入1 μg/μL的转染试剂TA-293,两者混匀并静置10 min后加入细胞悬液中进行转染,并于转染后第2天加入0.6%的KE-293进行补料,于转染后第6天收集细胞上清液,细胞样本送北京擎科生物科技有限公司进行mRNA的相对转录水平检测(相对定量qPCR实验)。
1.2.2 sTfR抗原抗体纯化
sTfR抗原纯化采用Ni柱亲和层析,上样之前先用10倍柱体积超纯水冲洗层析柱,5倍柱体积平衡液平衡;随后将细胞上清液进行上样,上样完成后再用5倍柱体积平衡液进行平衡;待杂蛋白流穿后用洗脱缓冲液进行蛋白洗脱并收集进行SDS-PAGE,并置于PBS缓冲液(pH 7.4)中进行透析,透析后加入10%甘油并置于-20 ℃保存。sTfR抗体采用Protein A柱进行纯化,操作过程同sTfR抗原纯化。
1.2.3 酶联免疫吸附测定
sTfR免疫原性ELISA试验方案:在96孔板用CBS将捕获抗体稀释至合适浓度,每孔100 μL,封上胶条,4 ℃包被过夜。第2天弃去液体并洗板,随后加入200 μL 1% 的明胶溶液,37 ℃封闭2 h;弃液洗板后加入100 μL稀释至100 ng/μL的sTfR抗原,37 ℃孵育1 h;弃液洗板后加入100 μL稀释一定倍数的一抗(兔血清),并逐级对半稀释,最后一排不加一抗设为阴性对照,37 ℃孵育1 h;弃液洗板后加入1∶4 000比例稀释的HRP标记的二抗(羊抗兔),每孔加入100 μL二抗,37 ℃孵育0.5 h;弃液洗板后加入100 μL TMB,37 ℃孵育10 min后加入50 μL终止液并于OD450检测吸光度。
免疫压制ELISA试验方案(竞争法):在96孔板用CBS包被sTfR抗原,每孔100 ng,封上胶条,4 ℃包被过夜。第2天弃液洗板后加入200 μL 1% 的明胶溶液,37 ℃封闭2 h;弃液洗板后每两个孔为一组:其中一孔加入100 μL 人血清样本,另一孔加入等量的生理盐水,37 ℃孵育1 h;弃液洗板后各加入100 μL稀释一定倍数的一抗(兔血清),37 ℃孵育1 h;弃液洗板后加入1∶4 000比例稀释的HRP标记的二抗(羊抗兔),之后操作同sTfR免疫原性ELISA试验方案。
1.2.4 sTfR 抗原抗体热稳定性
sTfR加速稳定性检测:将sTfR抗原平均分成若干份(1 mg/mL),置于37 ℃培养箱中,每隔2 d进行生化检测,共进行14 d。sTfR抗原长期稳定性检测:在纯化好的sTfR抗原中加入30%的甘油,并平均分成若干份(1 mg/mL),置于-20 ℃冰箱中冻存,每隔1个月取出1份进行生化检测。sTfR抗体长期稳定性检测:抗体保存方法同抗原一致,并每月将1 mg/mL的抗体按照相同工艺制成检测试剂,测定sTfR抗原含量,并以首次测定的sTfR抗原含量作为100%相对活性。
1.2.5 sTfR生化检测
以人可溶性转铁蛋白标准品为校准品,在日立全自动生化分析仪7180上采用两点终点法进行测定,反应方向为上升反应,校准方式为Spline,测定波长为570 nm,测定温度为37 ℃,取2 μL样本和120 μL试剂R1(三羟甲基氨基甲烷缓冲液)加入反应杯,由仪器自动混匀并于37 ℃孵育3 min,随后加入120 μL的试剂R2(sTfR和胶乳微球耦联后加入R1相近的缓冲液配置而成),由仪器自动混匀后在570 nm处读取第一读数点A1和第二读数点A2,通过软件计算△A=A2-A1并根据校准曲线计算sTfR浓度。
2 结果与分析
2.1 sTfR抗原表达体系筛选
将pCDNA3.4-sTfR质粒转染入HEK293细胞和CHO细胞中进行sTfR蛋白的表达,结果如图1所示,sTfR表达条带明显,大小为70~90 ku(sTfR分子质量理论大小为75.5 ku)。通过7180生化分析仪测定纯化后的蛋白含量发现,CHO细胞表达系统蛋白产量可达 0.68 mg/mL,而HEK293细胞表达系统蛋白产量可达 0.52 mg/mL。由于HEK293的单位蛋白生产成本更低且蛋白产量尚可,因此,优选HEK293作为表达宿主。
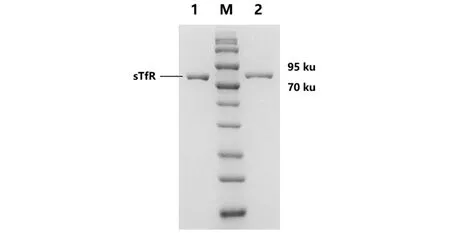
1:CHO细胞表达体系; M:蛋白Marker; 2:HEK293细胞表达体系。
2.2 sTfR抗原增强表达
为提高sTfR蛋白的表达水平,通过筛选表达启动子以及分泌信号肽进行表达强化。在pCDNA 3.4的CMV启动子基础上选择哺乳动物细胞表达常用的EF1a以及CAG启动子,以pCDNA 3.4为骨架载体进行启动子替换并进行sTfR蛋白表达,如图2(a)所示。CMV启动子和CAG启动子的表达强度相差不大,EF1a启动子在这3种启动子中表达强度最弱。在转录水平mRNA定量分析中,发现CMV启动子转录水平最高,CAG启动子略低于CMV启动子,EF1a启动子处于较低水平[图2(b)],因此,优选CMV启动子表达sTfR。

(a)1:CMV启动子; M:蛋白Marker; 2:CAG启动子;3:EF1a启动子。(b)不同启动子下的sTfR相对转录水平。(c)1:Kappa轻链信号肽; 2:白蛋白信号肽; 3:重链信号肽。(d)不同信号肽下的sTfR相对转录水平。(e)1:第1天; 2:第5天; 3:第10天; M:蛋白Marker。
选取人体中已知大量存在的蛋白信号肽,分别为Kappa轻链信号肽、重链信号肽以及白蛋白信号肽,以pCDNA 3.4为骨架构建质粒进行表达后,表达情况如图2(c)所示,以白蛋白信号肽为分泌肽的表达体系sTfR蛋白表达增强明显,从转录水平[图2(d)]中也能明显看出白蛋白信号肽的效果较好。通过优选CMV启动子和白蛋白信号肽,sTfR蛋白的表达水平可达到0.86 mg/mL。SDS-PAGE图中杂带经10 d的37 ℃孵育较第1天无明显变化,为纯化残留[图2(e)]。
2.3 sTfR抗原免疫剂量确定
通过优化后的表达体系对sTfR抗原进行表达和纯化,以不同的免疫剂量对新西兰兔进行免疫。免疫结果如表1所示(ELISA夹心法,包被11F5外购单抗)。0.1 mg/只剂量组血清抗体滴度在16~32 mIU/mL,其效价GMT为21,相比第2、3、4次免疫,抗体滴度上升趋势不明显;0.3 mg/只剂量组血清抗体滴度在64~256 mIU/mL,其效价GMT为128,相比第2、3、4次免疫血清抗体滴度均有不同程度的提高;0.5 mg/只剂量组血清效价和0.5 mg/只剂量整体效价无明显提高,效价GMT和0.3 mg剂量组相同(图3)。因此,优选0.3 mg抗原作为免疫剂量,5次免疫后可取全血纯化制备多克隆抗体。
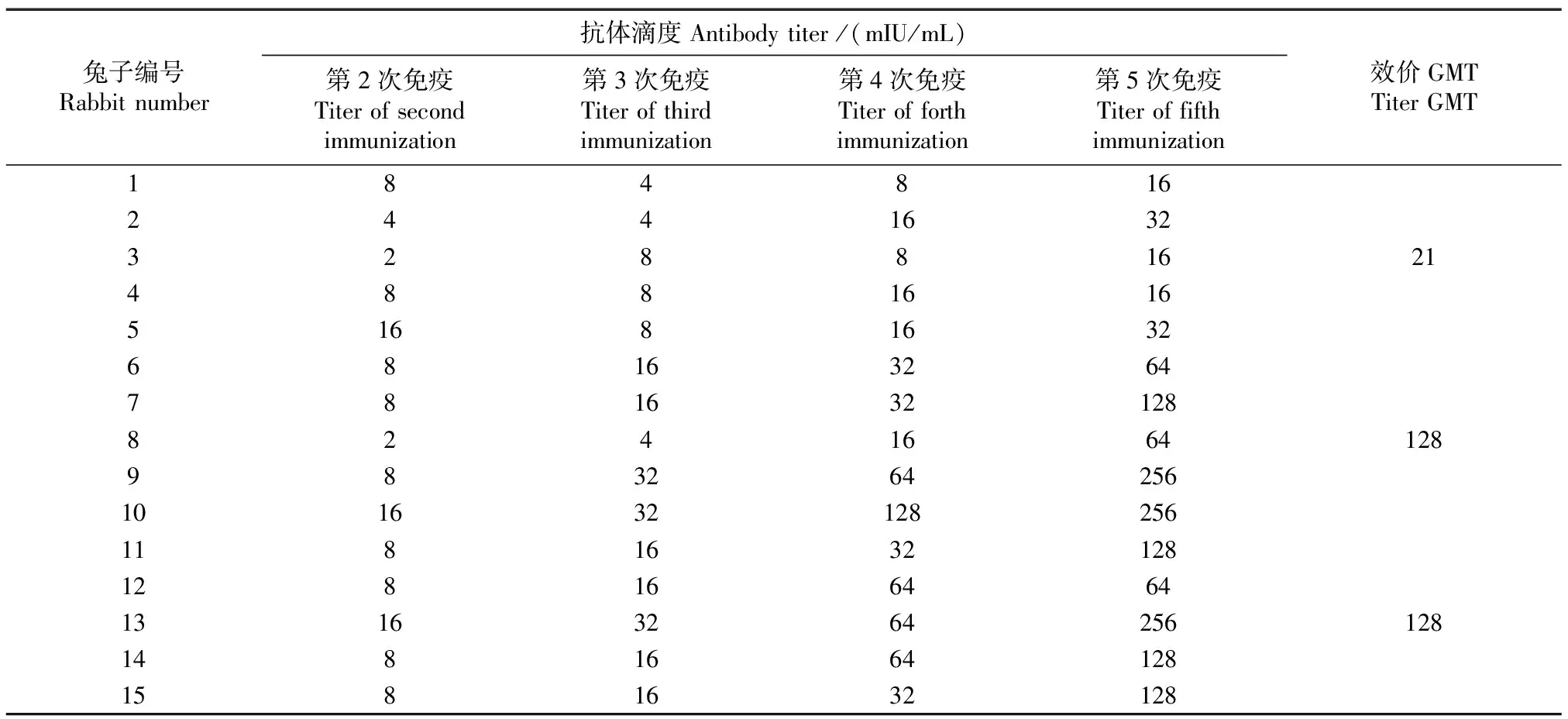
表1 sTfR兔多克隆抗体滴度
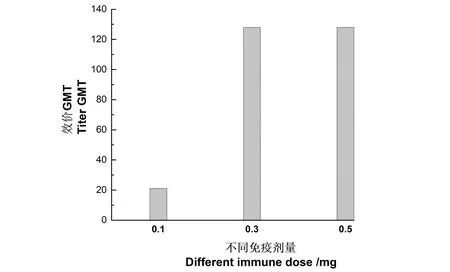
图3 不同免疫剂量下的效价GMT分析
2.4 sTfR 抗体血清压制
sTfR抗体纯化并透析(PBS缓冲液,pH 7.4)后,对抗体进行免疫压制试验观察抗体免疫效果,随机抽取5个人血清样本进行ELISA。免疫压制效果如图4所示(对应OD450值见表2),1号、2号、3号人血清样本几乎能够完全压制,4号、5号血清压制效果也很明显,表明sTfR兔抗血清能够很好地和人sTfR抗原结合。
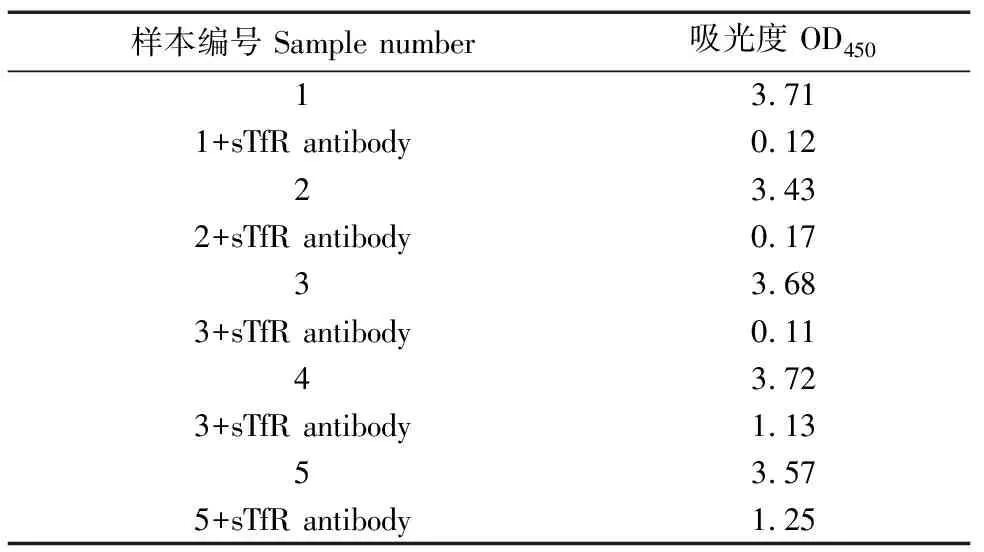
表2 免疫压制试验OD450检测值

图4 sTfR兔抗体免疫压制试验
2.5 sTfR抗原抗体稳定性
sTfR抗原加速稳定性如图5(a)所示,表明sTfR抗原在PBS缓冲液中(pH 7.4)较为稳定,37 ℃孵育14 d仍有95%以上的活性蛋白。sTfR抗原长期稳定性(-20 ℃)中,sTfR抗原在一年的稳定性监测中均未出现明显下降[图5(b)],sTfR抗体在PBS缓冲液(pH 7.4),-20 ℃的条件下,也可以保持稳定[图5(c)]。综上,sTfR抗原抗体均具有良好的稳定性,符合工业化生产需求。

(a)sTfR 抗原在37 ℃,PBS缓冲液(pH 7.4)环境下的稳定性;(b)sTfR 抗原(含甘油)在-20 ℃,PBS缓冲液(pH 7.4)环境下的稳定性;(c)sTfR 兔抗(含甘油)在-20 ℃,PBS缓冲液(pH 7.4)环境下的稳定性。
2.6 sTfR兔多克隆抗体的应用
将胶乳微球和所生产的sTfR兔抗进行共价耦联,并置于主要成分为pH 7.4的0.05 mmol/L三羟甲基氨基甲烷(Tris)缓冲液中,混匀作为R2试剂,同时将pH 7.4的0.05 mmol/L Tris缓冲液作为R1试剂。利用该试剂测定人血清样本中sTfR的含量,同时,利用进口成品试剂对同一个样本进行测定,样本比对结果如图6所示。结果表明,所生产的sTfR检测灵敏度高且线性宽,满足临床检验的检测需求。
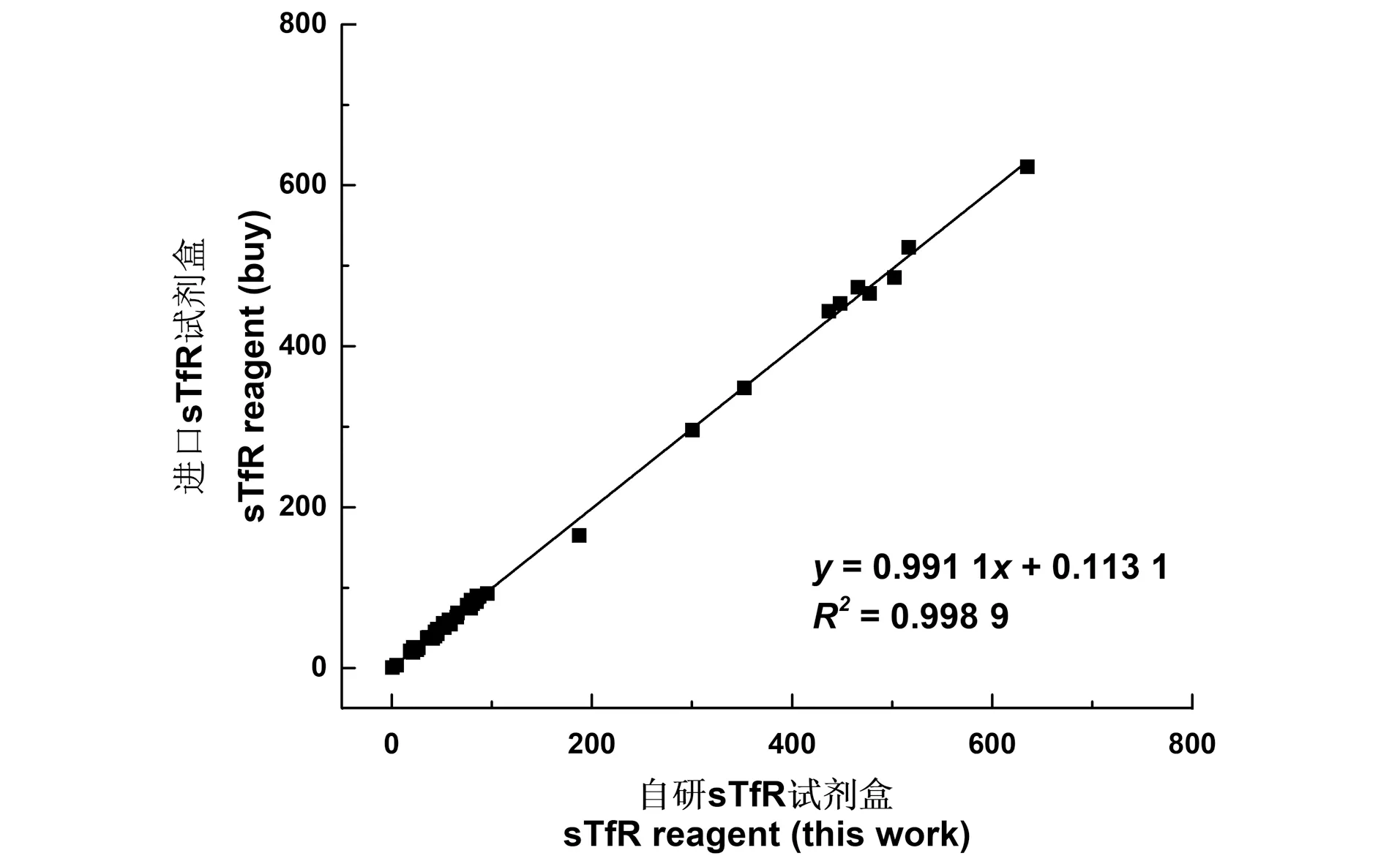
图6 自研试剂和进口试剂样本比对实验
3 结论
本文优选HEK293细胞搭配pCDNA 3.4质粒对sTfR抗原进行表达,表达量可达0.52 mg/mL,并筛选较优的CMV-F启动子及白蛋白信号肽,使表达量提升至0.86 mg/mL。使用该抗原对新西兰兔进行免疫,以0.3 mg/只的剂量免疫5次,所产生的兔sTfR抗体可以达到最高的效价。利用该抗体进行人血清免疫压制试验能产生很好的压制效果。同时,所制备的sTfR抗原和抗体具有良好的稳定性。
